Selection of and considerations for primary endpoints in confirmatory trials for new anticancer drugs
-
摘要: “十三五”是中国医药创新生态系统建设着力发展的5年,也是中国抗肿瘤药物临床研发蓬勃发展的重要阶段,大批抗肿瘤新药成功获批。关键注册研究主要终点的科学设计及合理选择是影响新药获益评价及能否上市的重要环节,包括单终点设计和多终点设计、总生存期及替代终点等选择。本文汇总国内外2018年1月1日至2019年12月31日登记注册的肿瘤药物临床试验终点设计相关指导文件,厘清主要终点指标类型、优缺点及选择的关键考量;基于中国药物临床试验登记与信息公示平台数据,分析中国抗肿瘤新药临床试验主要终点设计特点;提出抗肿瘤新药临床试验主要终点选择的若干建议,旨在为中国抗肿瘤新药的关键注册试验设计者提供支持和参考。Abstract: The 13th five-year period is remarkable regarding the construction of pharmaceutical innovation ecosystems in China and the vigorous advances in clinical research and development that have led to many anticancer drugs being successfully approved in China. The scientific design and rational selection of primary endpoints in confirmatory trials have fundamental impacts on the reliable evaluation of clinical benefits and whether new drugs could be marketed successfully. Such endpoints include the choice between single-endpoint design and multi-endpoint design, overall survival, and alternative endpoints. This study first summarized published regulatory guidelines related to clinical trial endpoints in China and beyond, especially for cancer trials. Then, classification, advantages, and disadvantages of commonly used endpoints of anticancer new drugs were described along with key considerations for the selection of primary endpoints. Based on January 1st, 2018 to December 31st, 2019 clinical trials published on the China Food and Drug Administration Registration and Information Disclosure Platform, characteristics of primary endpoint design and usage of common endpoints of new anticancer drugs in phase Ⅲ trials were analyzed and described. Meanwhile, key suggestions for the design of primary endpoints in confirmatory trials of anticancer drugs were recommended, to provide support and reference for related stakeholders and designers of key trials in new anticancer drugs.
-
Key words:
- neoplasm /
- clinical trial /
- primary endpoints /
- multiple endpoints /
- multiplicity
-
表 1 抗肿瘤新药主要终点类型、优缺点及研究设计特点
疗效终点 监管批准 优点 缺点 研究设计 OS 常规批准 1)公认金标准;
2)易于测量,结果精确1)易受交叉治疗和后续治疗影响;
2)含非癌症死亡;
3)样本量较大及随访时间较长1)随机研究;
2)首选盲法;
3)无需盲态/独立评价基于肿瘤测量的时间事
件终点(PFS、DFS、EFS等)加速/常规批
准(替代终点)1)所需样本少、随访时间短;
2)包括对稳定疾病的测定;
3)不受交叉治疗和后续治疗影响1)依赖于频繁检查,难以精确测量;
2)不是临床获益的直接测量,并非
所有情况均为有效的替代指标;
3)不同研究存定义有所不同1)随机研究;
2)首选盲法;
3)首选盲态/独立评价基于肿瘤测量的治疗
反应终点(ORR和CR)加速批准
(替代终点)1)可用于单臂试验支持注册;
2)所需样本更小、随访时间更短;
3)有效性归因于药物,而非疾病的
自然进程1)不是临床获益的直接测量,并非
所有情况均为有效的替代指标;
2)不是对药物活性的综合测量;
3)受益仅局限于患者亚组盲态/独立评价 症状评估终点 常规批准 患者临床获益的直接感受,体现以
患者为中心1)数据缺失和不完整情况较普遍;
2)微小变化的临床意义不清楚;
3)缺乏经过验证的测量工具1)随机研究;
2)首选盲法表 2 2018~2019年中国抗肿瘤新药Ⅲ期临床试验主要终点设计概况 (n=174)
主要终点 试验数量(项) % 单终点 135 77.6 PFS 69 51.1 OS 26 19.3 ORR 18 13.3 DFS 7 5.2 BOR 4 3.0 CR 3 2.2 pCR 3 2.2 MPR 2 1.5 EFS 1 0.7 RFS 1 0.7 TTPP 1 0.7 多终点 39 22.4 OS+PFS 31 79.5 OS+ORR 2 5.1 OS+DFS 1 2.6 OS+EFS 1 2.6 OS+RFS 1 2.6 EFS+PCR+CR 1 2.6 EFS+PCR 1 2.6 MFS+PCR+CR 1 2.6 TTPP:PSA进展时间 -
[1] Li N, Huang HY, Wu DW, et al. Changes in clinical trials of cancer drugs in mainland China over the decade 2009-18: a systematic review[J]. Lancet Oncol, 2019, 20(11):e619-e626. doi: 10.1016/S1470-2045(19)30491-7 [2] Li GQ, Liu Y, Xie CC, et al. Characteristics of expedited programmes for cancer drug approval in China[J]. Nat Rev Drug Discov, 2021, 20(6):416. doi: 10.1038/d41573-021-00080-0 [3] Huang HY, Miao HL, Wang J, et al. Advances on anticancer new drugs in China and the USA in 2020: from ongoing trial to drug approval[J]. J Natl Cancer Cent, 2021, 1(4):147-152. [4] Lewis J, Louv W, Rockhold F, et al. The impact of the international guideline entitled statistical principles for clinical trials (ICH E9)[J]. Stat Med, 2001, 20(17-18):2549-2560. [5] Beaver JA, Howie LJ, Pelosof L, et al. A 25-year experience of US food and drug administration accelerated approval of malignant hematology and oncology drugs and biologics: a review[J]. JAMA Oncol, 2018, 4(6):849-856. doi: 10.1001/jamaoncol.2017.5618 [6] Delgado A, Guddati AK. Clinical endpoints in oncology-a primer[J]. Am J Cancer Res, 2021, 11(4):1121-1131. [7] Wilson MK, Karakasis K, Oza AM. Outcomes and endpoints in trials of cancer treatment: the past, present, and future[J]. Lancet Oncol, 2015, 16(1):e32-e42. doi: 10.1016/S1470-2045(14)70375-4 [8] Dmitrienko A, D'Agostino RB Sr. Multiplicity considerations in clinical trials[J]. N Engl J Med, 2018, 378(22):2115-2122. doi: 10.1056/NEJMra1709701 [9] Alosh M, Bretz F, Huque M. Advanced multiplicity adjustment methods in clinical trials[J]. Stat Med, 2014, 33(4):693-713. doi: 10.1002/sim.5974 [10] 周明,陈晓媛,张虹,等.单臂试验支持抗肿瘤新药注册的考虑[J].中华肿瘤杂志,2018,40(1):58-62. doi: 10.3760/cma.j.issn.0253-3766.2018.01.011 [11] 黄慧瑶,吴大维,王海学,等.2019年中国肿瘤药物临床试验进展[J].中华肿瘤杂志,2020,42(2):127-132. doi: 10.3760/cma.j.issn.0253-3766.2020.02.008 [12] Wu DW, Huang HY, Tang Y, et al. Clinical development of immuno-oncology in China[J]. Lancet Oncol, 2020, 21(8):1013-1016. doi: 10.1016/S1470-2045(20)30329-6 [13] 宋彩梅.美国食品药品监督管理局以患者为中心的药物开发系列指导原则1-《综合和有代表性的信息收集指导原则》介绍[J].中国临床药理学杂志,2021,37(17):2381-2384. [14] 唐凌,周明,夏琳,等.以患者为核心的抗肿瘤药物临床研发的审评考虑[J].临床肿瘤学杂志,2021,26(7):577-582. doi: 10.3969/j.issn.1009-0460.2021.07.001 [15] Gamble C, Krishan A, Stocken D, et al. Guidelines for the content of statistical analysis plans in clinical trials[J]. JAMA, 2017, 318(23):2337-2343. doi: 10.1001/jama.2017.18556 -



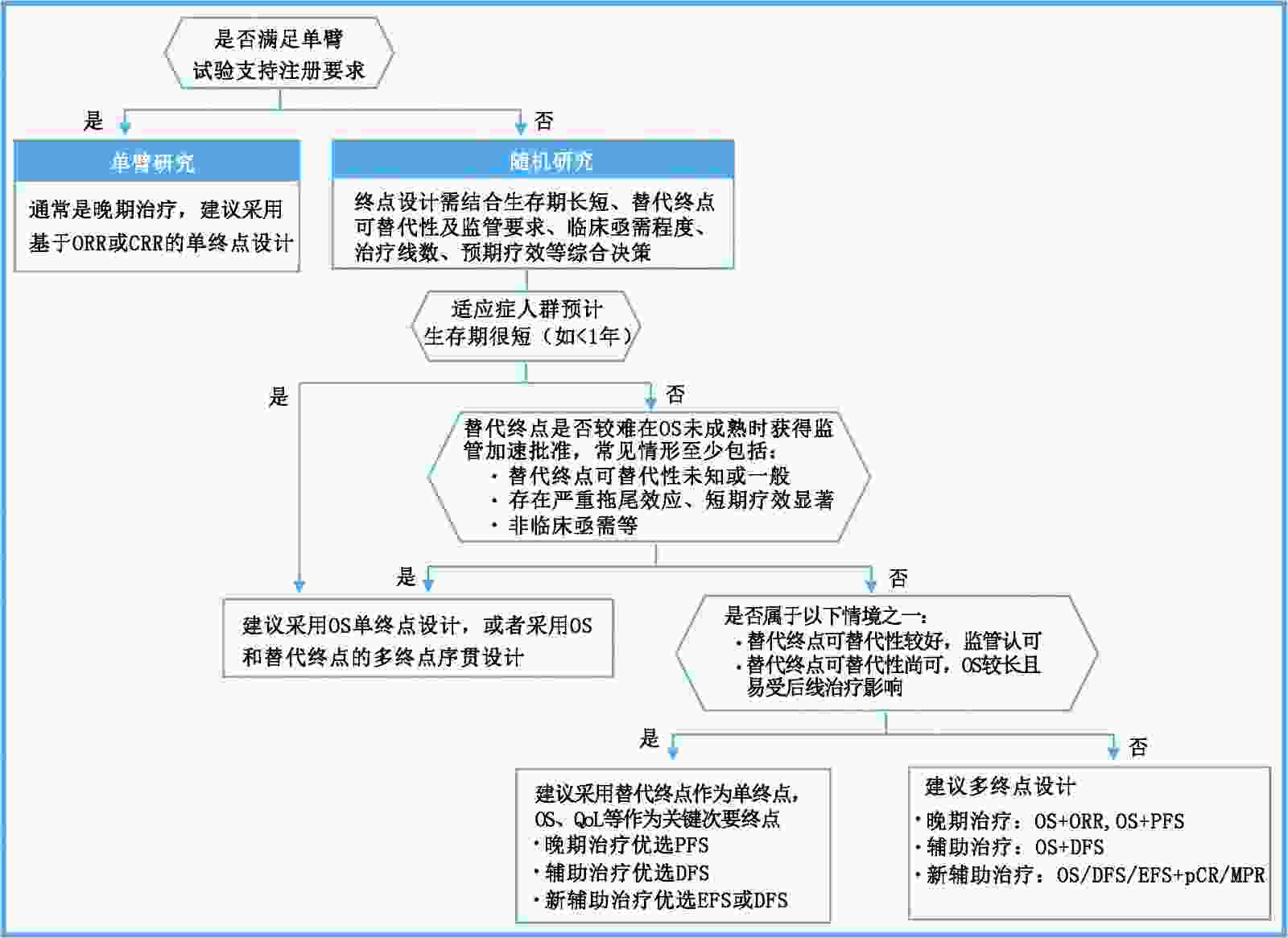
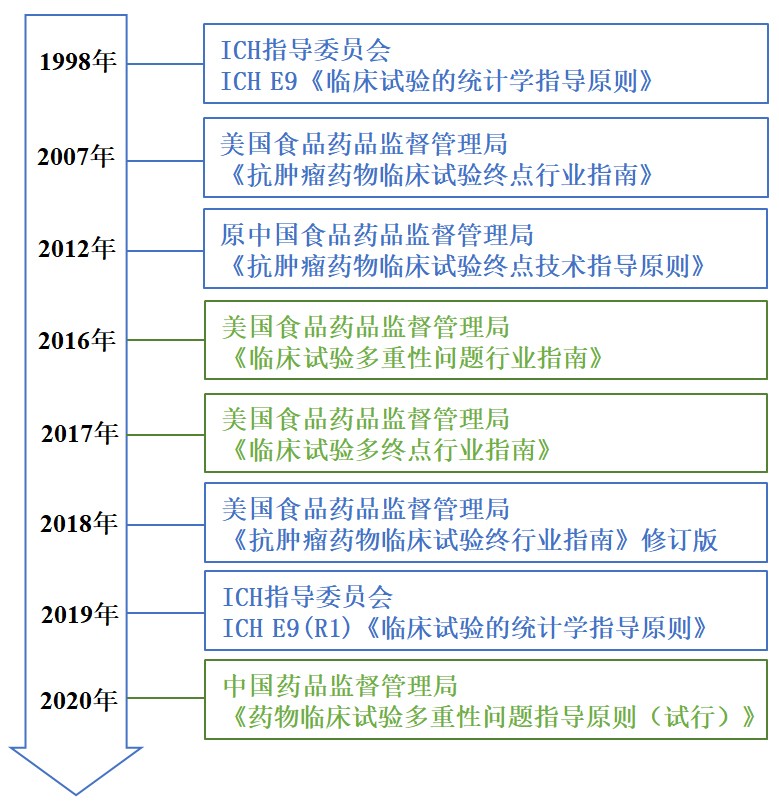
 下载:
下载: