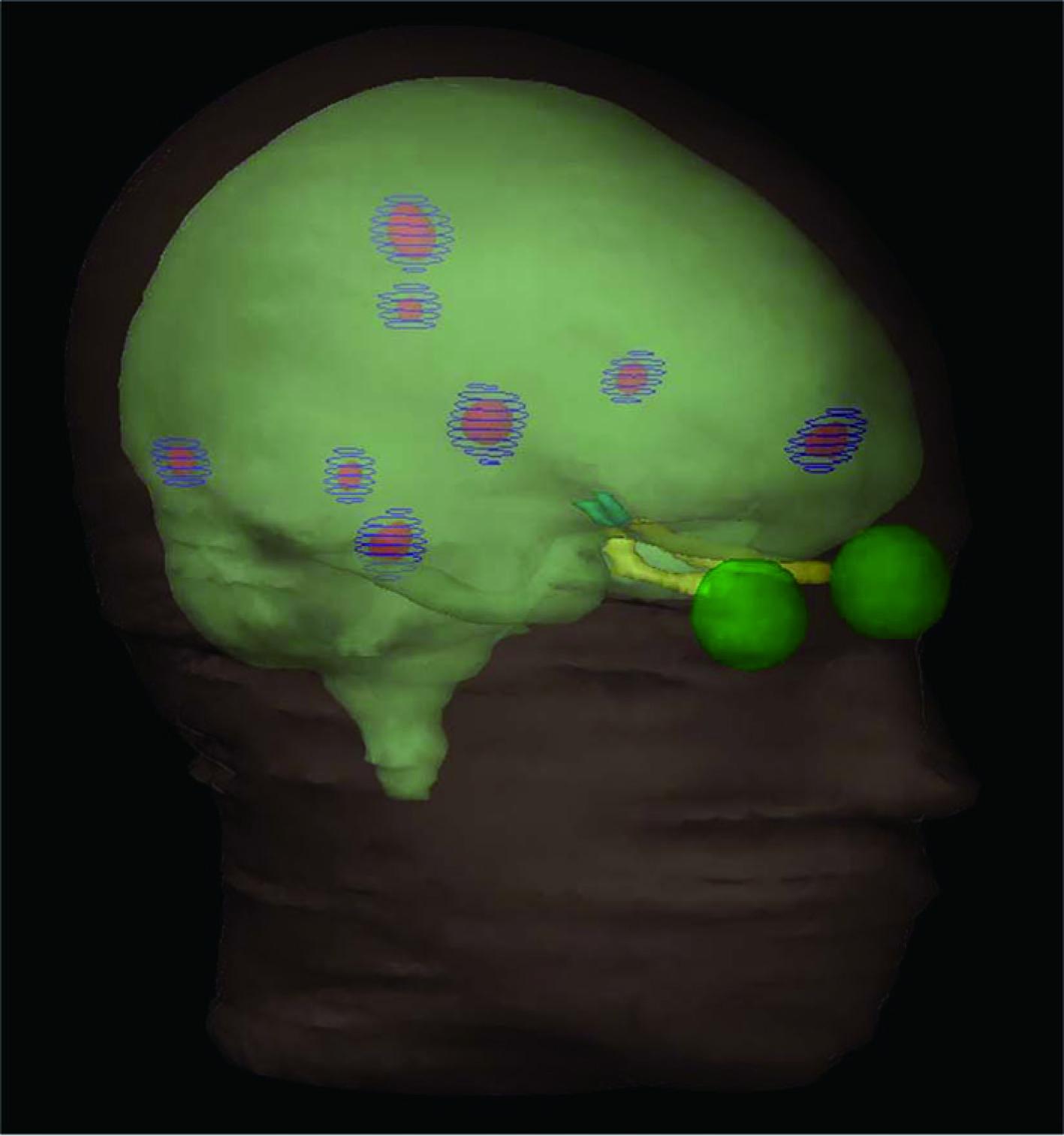
-
摘要: 近十年来放疗和药物治疗的发展大大促进了对肺癌合并中枢神经系统(central nervous system,CNS)转移的治疗。最新放疗相关的临床研究主要包括:拓展立体定向放射外科(stereotactic radiosurgery,SRS)局部治疗脑转移的指征、筛选适合全脑放疗(whole brain radiation therapy,WBRT)的患者并降低全脑放疗的不良反应、探索对小细胞肺癌脑转移患者仅行头颅磁共振检查随访而不做预防性脑照射的可行性、对WBRT和PCI治疗保护海马组织的临床意义以及首选SRS治疗的疗效进行深入研究等。肿瘤内科学近期研究显示,多种酪氨酸激酶抑制剂对CNS转移具有治疗作用,免疫检查点抑制剂对部分患者具有一定疗效,上述新发现均为肺癌合并CNS转移的内科治疗和多学科综合治疗拉开序幕。未来的研究将集中于有更稳定CNS活性作用的靶向治疗和免疫治疗,以及涉及对CNS活性药物、放疗和CNS监测等多学科治疗策略的优化和患者筛选。
-
表 1 NSCLC患者合并CNS转移放疗的主要试验
比较组 试验名称/试验地点 患者特征 干预措施 样本量 (例) 1~4个脑转移灶的SRS JROSG-99-1 1~4个脑转移灶 SRS联合或不联合WBRT 132 M.D. Anderson 1~3个脑转移灶 SRS联合或不联合WBRT 58 EORTC 22952-26001 1~3个脑转移灶 SRS或手术(由医生决定)联合或不联合 WBRT 359 NCCTG N0574 1~3个脑转移灶 SRS联合或不联合WBRT 213 ≥4个脑转移灶的SRS JLGK0901 1~10个脑转移灶 SRS(单臂,观察性) 1 194 M.D. Anderson(NCT01592968) 4~15非黑色素瘤脑转移灶 SRS vs. WBRT 72 手术及术后放疗 肯塔基大学牵头的多
中心试验单个脑转移灶接受手术患者 手术联合或不联合术后WBRT 95 M.D. Anderson 脑转移接受手术患者 手术联合或不联合术后 SRS 132 NCCTG N107C/CEC.3 脑转移接受手术患者 术后WBRT vs.术后 SRS 194 WBRT联合或不联合N-甲基D-天冬氨酸受体拮抗剂 RTOG 0614 脑转移接受WBRT患者 WBRT联合或不联合为期6个月的同步或辅助N-甲基D-天冬氨酸受体拮抗剂治疗 554 WBRT vs. HA-WBRT NRG CC001 接受WBRT的脑转移患者 WBRT联合N-甲基D-天冬氨酸受体拮抗剂 vs. HA-WBRT联合N-甲基D-天冬氨酸受体拮抗剂 518 台大医院 接受WBRT的脑转移者 WBRT vs. HA-WBRT 70 WBRT vs. 最佳支持性护理 QUARTZ 不适合SRS的NSCLC脑转移患者 BSC联合或不联合WBRT 538 表 2 选定的NSCLC TKI的CNS疗效数据
试验 阶段 全身治疗 设定 CNS疾病样本量 CNS相关结局 经典EGFR AURA3 Ⅲ期 奥希替尼
vs. 化疗EGFR T790M患者+既往EGFR TKI治疗后发生PD的晚期NSCLC 任何CNS转移a:奥希替尼(n=75),化疗(n=41)
可测量的CNS转移:奥希替尼(n=30),化疗(n=16)CNS ORR(任何CNS转移):40%(奥希替尼)vs. 17%(化疗);OR 3.24(P=0.014)
CNS ORR(可测量的CNS转移):70%(奥希替尼)vs. 31%(化疗);OR 5.13(P=0.015)
CNS mDoR:8.9个月(奥希替尼)vs. 5.7个月(化疗)
CNS mPFS(任何CNS转移):11.7个月(奥希替尼)vs. 5.6个月(化疗);HR= 0.32(P=0.004)FLAURA Ⅲ期 奥希替尼vs. SOC TKI 初治 任何CNS转移:奥希替尼(n=61),SOC TKI (n=67)
可测量的CNS转移:奥希替尼(n=22),SOC TKI(n=19)CNS ORR(任何CNS转移):66%(奥希替尼)vs. 43%(SOC TKI);OR 2.5(P=0.011)
CNS ORR(可测量的CNS转移):91%(奥希替尼)vs. 68%(SOC TKI);OR 4.6(P=0.066)
CNS mDoR:15.2个月(奥希替尼)vs. 18.7个月(SOCTKI)
CNS mPFS(任何CNS转移):NR(奥希替尼)vs. 13.9个月(SOC TKI);HR=0.48(P=0.014)EGFR/HER2第20外
显子插入ZENITH20 Ⅱ期 波齐替尼 经治(队列1和队列2),初治(队列3) n=36(22例EGFR第20外显子插入和14例HER2第20外显插入)。 CNS ORR:8.3%(CR);66.7% CNS疾病稳定 NCT02716116 Ⅰ或Ⅱ期 莫博替尼 经治 n=12 CNS ORR:无报告
总体ORR:在12个有基线脑转移的患者中为25%ALK ALEX Ⅲ期 阿来替尼vs. 克唑替尼 初治 任何CNS转移:阿来替尼(n=64),克唑替尼(n=58)
可测量的CNS转移:阿来替尼(n=21),克唑替尼(n=22)CNS ORR(任何CNS转移):有既往放疗史 36.0%(阿来替尼)vs. 28.6%(克唑替尼);无既往放疗史 74.4%(阿来替尼)vs. 24.3%(克唑替尼)
CNS ORR(可测量的 CNS转移):有既往放疗 85.7%(阿来替尼) vs. 71.4%(克唑替尼);无既往放疗78.6%(阿来替尼)vs. 40.0%(克唑替尼)
CNS mDoR:NR(阿来替尼) vs. 17.3个月(克唑替尼)
CNS进展的12个月CIR(无既往非CNS进展):58.3%(克唑替尼) vs. 16.0%(阿来替尼)有基线CNS转移患者;31.5%(克唑替尼)vs. 4.6%(阿来替尼)无基线CNS转移患者。J-ALEX Ⅲ期 阿来替尼vs. 克唑替尼 初治或接受过一个化疗方案 阿来替尼(n=14);克唑替尼(n=29) CNS进展的HR(支持阿来替尼获益):基线CNS转移,0.51(P=0.2502);基线无CNS转移,0.19(P=0.0004)。
CNS进展的1年CIR:16.8%(克唑替尼)vs. 5.9%(阿来替尼)。phⅠ/Ⅱ(NCT01449461);ALTA(A组:90 mg每日1次;B组:180 mg 每日1次7天,起始量90mg) Ⅰ或者Ⅱ期 布格替尼 phⅠ/Ⅱ:92%既往克唑替尼,76%既往化疗
ALTA(A + B):100%既往克唑替尼,75%既往化疗phⅠ/Ⅱ:n=50
ALTA A组:n=80
ALTA B组:n=73可测量的脑转移:phⅠ/Ⅱ:CNS ORR 53%
ALTA A组:CNS ORR 46%
ALTA B组:CNS ORR 67%
任何脑转移:phⅠ/Ⅱ:CNS mPFS 14.6个月
ALTA A组:CNS mPFS 15.6个月
ALTA B组:CNS mPFS 18.4个月ALTA-1L Ⅲ期 布格替尼vs. 克唑替尼 初治 任何脑转移患者:布格替尼(n=47),克唑替尼(n=49)
可测量的脑转移:布格替尼(n=18),克唑替尼(n=23)CNS ORR(可测量的脑转移):78%(布格替尼)vs. 26%(克唑替尼);OR 11.67(P=0.0014)
CNS mPFS:基线CNS转移的患者为24.0个月(布格替尼) vs. 5.6个月(克唑替尼);基线无CNS转移的患者为32.3 个月(布格替尼)vs. NR(克唑替尼)NCT01970865 Ⅱ期 洛拉替尼 EXP1队列(初治)
EXP2队列(既往克唑替尼治疗)EXP1:n=3
EXP2-3A:n=23EXP1:CNS ORR:66.7%(2/3)
CNS mDoR:NR(95% CI,NR-NR)
EXP2-3A:CNS ORR:87%;CNS mDoR:NR(95% CI,8.4~NR)NCT01970865 Ⅱ期 洛拉替尼 EXP3B-5 队列(既往第二代ALK TKI治疗)) 任何CNS转移:n=95
可测量的CNS 转移:n=57可测量的CNS转移:CNS ORR:56.1%
CNS mDoR:12.4个月CROWN Ⅲ期 洛拉替尼vs. 克唑替尼 未接受过治疗 任何脑转移:洛拉替尼(n=38),克唑替尼(n=40)
可测量的脑转移:洛拉替尼(n=17),克唑替尼(n=13)CNS ORR(任何脑转移):66%(洛拉替尼)vs. 20%(克唑替尼);OR 8.41(95% CI:2.59~27.23)
CNS ORR(可测量的脑转移):82%(洛拉替尼)vs. 23%(克唑替尼);OR 16.83(95% CI:1.95~163.23)
CNS DoR ≥ 12个月:72%(洛拉替尼)vs. 0%(克唑替尼)
12个月CNS PFS率(ITT):96%(洛拉替尼) vs. 60%(克唑替尼);HR=0.07(95% CI:0.03~0.17)ROS1 ALKA-372-001
STARTRK-1
STARTRK-2Ⅰ或Ⅱ期 恩曲替尼 初治和经治 任何CNS转移:n=46
可测量的CNS转移:n=24任何CNS转移:
CNS ORR:52.2%
CNS mDoR:12.9个月
CNS mPFS:8.3 个月
可测量的CNS转移:
CNS ORR:79.2%
CNS mDoR:12.9个月
CNS mPFS:12.0个月NCT01970865 Ⅱ期 洛拉替尼 初治和经治 未经TKI治疗:n=11
仅接受过克唑替尼:n=24未接受TKI治疗:
CNS ORR:64%
mDoR:NR(95% CI:5.7~NR)
仅接受过克唑替尼治疗:
CNS ORR:50%
mDoR:NR(95% CI:11.0~NR)TRIDENT-1 Ⅱ期 洛普替尼 初治和经治 未接受过TKI治疗:n=3
曾接受过TKI-治疗:n=4未接受TKI治疗:
CNS ORR:100%(3/3)
DoR:5.5+,7.2+,14.85+个月
接受过TKI治疗:
CNS ORR:50%(2/4)
DoR:5.5+,14.8+个月NTRK 1/2/3 ALKA-372-001
STARTRK-1
STARTRK-2Ⅰ或者Ⅱ期 恩曲替尼 未接受TRK抑制剂治疗的实体瘤b 任何:n=16
可测量的:n=8任何CNS转移:
CNS ORR 50%
CNS mPFS:8.9 个月
可测量的CNS转移:
CNS ORR 62.5%
CNS mPFS 10.1个月
既往RT≥6 个月:CNS mPFS 9.5个月
既往RT<6 个月:CNS mPFS 6.3个月NCT02637687和NCT02576431 Ⅰ或者Ⅱ期 拉罗替尼 非原发性CNS实体肿瘤合并脑转移或原发性CNS肿瘤b 5例非原发性CNS实体瘤(3例肺癌和2例甲状腺癌) CNS ORR 60%
CNS DoR 9+~13个月MET第14外显子改变 GEOMETRY mono-1 Ⅱ期 卡马替尼 初治和经治 n=13 CNS ORR 54% VISION Ⅱ期 特泊替尼 初治和经治 任何CNS转移:n=15
可测量的CNS 转移:n=7CNS ORR(可测量的CNS转移):71%(5/7)
CNS DCR 87%(13/15)RET ARROW Ⅰ或者Ⅱ期 帕拉西替尼 初治和经治 可测量的疾病:n=9 CNS ORR 56%(5/9;3名患者达到CR) LIBRETTO-001 Ⅰ或者Ⅱ期 塞尔帕替尼 初治和经治 可测量的疾病:n=22 CNS ORR 81.8%(总),85.7%(无既往RT),75.0%(有既往RT)
CNS mDoR:9.4个月BRAF V600E NCT01336634 Ⅱ期 达拉非尼和曲美替尼 初治和经治 初治:n=2(不可测量);经治:n=1(不可测量) 初治:患者均无CNS CR/CNS PD
经治:NAcKRAS G12C CodeBreak 100 Ⅱ期 索托拉西布 经治 n=26 NAc KRYSTAL-1 Ⅰ或者Ⅱ期 阿达格拉西布 经治 NAc NAc CIR:累计发病率;CR:完全缓解;mPFS:中位无进展生存期;NR:未达到;OR:优势比;PD,疾病进展;ph:期;RT:放疗;SOC:标准护理;a:任何转移指可测量和/或不可测量的转移;b:试验还包括其他实体肿瘤类型; c:NA指在出版物或公开资料中无法获得或不适用的数据 表 3 优化脑转移治疗的多学科综合治疗概念和其他可行的方案
概念 描述 脑转移治疗的应用 空间协同 全身药物治疗亚临床和可见病变,SRS和SBRT
强化对可见病灶的治疗取得较高的长期局部
控制率一些CNS活性药物可以得到较高CNS ORR,但随后常见CNS的进展。SRS提供了较高的持久的局部控制率,但新发病灶较为常见;SRS和药物联合治疗可能比任一单独治疗获得更好的CNS控制 寡转移情况 SRS和SBRT可用于清除寡转移病灶、寡残留及
寡进展病灶同颅外寡转移一样,对转移灶的SRS消融治疗可以作为一线治疗、巩固治疗或病灶进展时使用以延长有效药物的缓解时间或在全身治疗中断时使用 CNS降期治疗 全身用药可能有助于将一些患者从弥漫性的疾病状态转化为较为局限的疾病状态以便于应用
局部治疗。在弥漫性脑转移和/或LMD患者中,通过CNS活性药物降低分期可能使一些患者避免WBRT,转为可以采用SRS治疗 生物协同 RT和全身药物生物学机制上可以调节互补产生
协同效应RT的致免疫原性效应和全身免疫治疗剂的协同应用可能会改善局部和远处CNS的控制结果 细胞毒性增强 药物治疗可以影响放疗诱导产生的DNA损伤及
其修复过程CNS活性药物可提高放射治疗病灶的有效率和持久性 时间协同 药物可以在分次放疗的间期调节影响放射
生物学的4Rs(DNA损伤修复、细胞再增殖、
肿瘤再氧化和细胞周期再分配)CNS活性药物可通过调节4Rs提高多分割放疗的疗效 CNS药物暴露 由于血脑屏障的存在,相关药物的暴露减少,
CNS可作为转移性肿瘤的避难所放疗可增加血脑屏障通透性,有研究观察到先行放疗可增加CNS药物浓度,在某些情况下改善全身药物对CNS的控制效果 不良反应 联合治疗的一个潜在优势是在无重叠不良
反应的情况下更好地控制疾病,然而,在实践中,
某些组合可能会增加不良反应需要进一步的研究来确定特异性CNS活性药物联合放疗的不良事件发生率,以及设计最佳方案降低不良反应重叠 SBRT:立体定向体部放射治疗 -
[1] Liu L, Chen W, Zhang R, et al. Radiotherapy in combination with systemic therapies for brain metastases: current status and progress[J]. Cancer Biol Med, 2020, 17(4):910-922. doi: 10.20892/j.issn.2095-3941.2020.0109 [2] Hughes RT, Masters AH, McTyre ER, et al. Initial SRS for patients with 5 to 15 brain metastases: Results of a multi-institutional experience[J]. Int J Radiat Oncol Biol Phys, 2019, 104(5):1091-1098. doi: 10.1016/j.ijrobp.2019.03.052 [3] Yang JJ, Zhou C, Huang Y, et al. Icotinib versus whole-brain irradiation in patients with EGFR-mutant non-small-cell lung cancer and multiple brain metastases (BRAIN): a multicentre, phase 3, open-label, parallel, randomised controlled trial[J]. Lancet Respir Med, 2017, 5(9):707-716. doi: 10.1016/S2213-2600(17)30262-X [4] Kim PH, Suh CH, Kim HS, et al. Immune checkpoint inhibitor therapy may increase the incidence of treatment-related necrosis after stereotactic radiosurgery for brain metastases: A systematic review and meta-analysis[J]. EurRadiol, 2021, 31(6):4114-4129. [5] Asher AL, Alvi MA, Bydon M, et al. Local failure after stereotactic radiosurgery (SRS) for intracranial metastasis: analysis from a cooperative, prospective national registry[J]. J Neurooncol, 2021, 152(2):299-311. doi: 10.1007/s11060-021-03698-7 [6] Magnuson WJ, Lester-Coll NH, Wu AJ, et al. Management of brain metastases in tyrosine kinase inhibitor-naïve epidermal growth factor receptor-mutant non-small-cell lung cancer: A retrospective multi-institutional analysis[J]. J Clin Oncol, 2017, 35(10):1070-1077. doi: 10.1200/JCO.2016.69.7144 [7] Yan M, Toh TS, Lindsay PE, et al. Limited-stage small cell lung cancer: Outcomes associated with prophylactic cranial irradiation over a 20-year period at the Princess Margaret Cancer Centre[J]. Clin TranslRadiat Oncol, 2021, 30:43-49. [8] Rusthoven CG, Yamamoto M, Bernhardt D, et al. Evaluation of first-line radiosurgery vs whole-brain radiotherapy for small cell lung cancer brain metastases: the FIRE-SCLC cohort study[J]. JAMA Oncol, 2020, 6(7):1028-1037. doi: 10.1001/jamaoncol.2020.1271 [9] Sun H, Xu L, Wang Y, et al. Additional radiation boost to whole brain radiation therapy may improve the survival of patients with brain metastases in small cell lung cancer[J]. Radiat Oncol, 2018, 13(1):250. doi: 10.1186/s13014-018-1198-4 [10] Liu Q, Yin Q, Dong Y, et al. Microsurgery vs. radiosurgery for the treatment of multiple metastases in the brain: a retrospective cohort study[J]. Cancer Biol Med, 2021, 19(6):884-892. -



 下载:
下载: