Apigenin Induces p53-Dependent Apoptosis and G2/M Arrest in Breast Cancer T47D Cells
-
摘要:目的 探讨芹菜素(apigenin)对乳腺癌T47D细胞系凋亡及细胞周期的影响。方法 常规培养T47D细胞, 用四甲基偶氮唑盐法(MTT法)检测芹菜素对乳腺癌T47D细胞系细胞增殖的影响。荧光染色法观察凋亡细胞的形态变化。流式细胞仪检测细胞凋亡率及周期分布。Western blot检测不同浓度(0、10、20、40、80 μM)芹菜素对凋亡及周期相关蛋白表达的影响。结果 随着芹菜素浓度的增加, 芹菜素对T47D细胞的增殖抑制作用明显增强(P < 0.05); 凋亡荧光染色及流式细胞仪显示, 芹菜素能够诱导乳腺癌T47D细胞凋亡, 随着其浓度的增高, 各组凋亡率分别为(2.41±0.072)%、(10.87±0.028)%、(18.02±0.056)%、(37.05± 0.092)%和(78.38±0.082)%, 与对照组相比, 差异有统计学意义(P < 0.05); 流式周期分析显示, 芹菜素能够使T47D细胞系G2/M期阻滞, 随着芹菜素浓度的增高, 不同浓度组细胞G2/M期所占的比例逐渐增加, 差异有统计学意义(P < 0.05); Western blot显示p53、p21、Bax和p-Cdc2的含量及Caspase-3, PARP剪切明显增加, 而Bcl-2、CyclinB1及Cdc2的含量却显著减少。结论 芹菜素能够诱导乳腺癌T47D细胞系p53依赖性凋亡及G2/M期阻滞, 从而明显抑制其增殖。Abstract:Objective The present study aims to investigate the effects of apigenin on the proliferation breast cancer of T47D cell line.Methods T47D cells were cultured in vitro. Cell proliferation was measured by MTT assay. Morphological changes in the apoptotic cells were observed by a fluorescent microscope. Flow cytometry was used to detect the ratio of apoptotic cells and cell cycle distribution. Western blot analysis was used to detect the apoptosis- and cycle-related protein.Results MTT showed that apigenin could inhibit the proliferation of T47D cells in a dose-dependent manner (P < 0.05). Fluorescent staining and flow cytometry showed a significant increase in the apoptosis of T47D cells after apigenin treatment, and the apoptotic ratios of the different groups were (2.41 ± 0.072)%, (10.87 ±0.028) %, (18.02 ±0.056) %, (37.05 ±0.092) %, and (78.38 ±0.082) %, respectively, with a statistically significant difference (P < 0.05). Apigenin could induce G2/M arrest of T47D cells, and the ratio of G2/M phase increased with increasing concentration of apigenin (P < 0.05). The cleaved PARP, caspase3, p53, p21, Bax, and p-Cdc2 significantly increased, whereas Bcl-2, cyclin B1, and Cdc2 expression decreased.Conclusion Apigenin could induce p53-dependent apoptosis and G2/M arrest of the breast cancer T47D cell line.
-
Keywords:
- Apigenin /
- Breast cancer /
- Apoptosis /
- Cell cycle
-
目前,化疗仍是乳腺癌的主要治疗手段,但化疗造成的骨髓抑制等不良反应限制了化疗药物的使用,因而近年来联合中医药治疗乳腺癌成为研究热点。芹菜素是一种存在于蔬菜、水果及茶叶等植物中的天然化合物[1],本研究以乳腺癌T47D细胞系作为研究对象,探讨其抗肿瘤效应的机制。
1. 材料与方法
1.1 材料
人乳腺癌T47D细胞系由天津医科大学附属肿瘤医院中心实验室提供。芹菜素购于SIGMA公司。p53,p21,Bax,Bcl-2,Caspase-3,PARP,CyclinB1,Cdc2及p-Cdc2等一抗购于CST公司。染料Hochest33342,Mitotrack Red,Yo-pro-1购于Invitrogen公司。
1.2 方法
1.2.1 细胞培养
T47D细胞系常规培养于RPMI 1640培养液中,内含10%胎牛血清,1%双抗(青霉素100 U/mL,链霉素100 U/mL),于37℃,5% CO2培养箱中恒温培养。
1.2.2 MTT法检测T47D细胞的增殖情况
常规培养T47D细胞,选取指数期的细胞以3×103个/mL接种于96孔板。细胞贴壁后分别加入不同浓度的芹菜素(0、10、20、40、80 μM)培养24 h。每组设4个复孔。向每孔中加入5 g/L的MTT 20 μL继续培养4 h,1 000 r/min转离心5 min,弃上清。然后向每孔中加入DMSO 100 μL,37 ℃震荡15 min,直至紫褐色沉淀完全溶解。用酶标仪测定每孔在570 nm波长下的OD值。并计算肿瘤生长抑制率。生长抑制率(%)=(对照孔A值-加药孔A值)/ 对照孔A值×100%。
1.2.3 荧光染色观察细胞形态学变化
取对数生长期的T47D细胞以1×105个/mL的浓度接种于6孔板内,每孔2 mL。加入不同浓度的芹菜素处理24 h后分别加入终浓度为5 μ g/mL的Hoechst33342、250nM的Mito-Tracker Red和1 μM的Yo-pro-1,室温孵育30min后,倒置荧光显微镜下观察。
1.2.4 流式细胞仪(FCM)检测细胞凋亡率
细胞处理同上。处理24 h后收集细胞,并调整的细胞数至1×106个/mL,用冷PBS洗涤细胞2次。弃上清,加入100 μL染料结合缓冲液(Binding Buffer)重悬后加入10 μL AnnexinV-FITC染色,混匀后室温避光静置15 min,补加200 μL的Binding Buffer和5 μL PI染液(50 mg/L),静置5 min,立即进行FCM分析,实验重复3次。
1.2.5 流式细胞仪检测细胞周期
细胞分组及处理同上。芹菜素处理24 h后收集细胞。加入预冷的70%乙醇,于4℃固定12h,离心洗涤后,悬浮于PI染液中,室温下避光染色30min。最后以300目筛网过滤,调整细胞浓度为1×105~1×106/mL,用流式细胞仪分析细胞周期。
1.2.6 Western blot检测凋亡及周期相关蛋白的表达
细胞分组及处理同上。24 h提取总蛋白,BSA法测定蛋白浓度,行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转移至硝酸纤维素膜,5%牛奶封闭,放入一抗中4℃孵育过夜,次日用TBST洗涤,用滴加辣根过氧化物酶标记的二抗(1:500)室温孵育1 h,ECL显色。
1.3 统计学分析
实验结果采用SPSS 16.0软件进行分析,实验结果用x±s表示。细胞生长抑制率及凋亡指数使用单因素方差分析。P < 0.05为差异有统计学意义。
2. 结果
2.1 芹菜素抑制乳腺癌T47D细胞的增殖
随芹菜素浓度增加,各组增殖抑制率逐渐增加(P < 0.05),提示芹菜素对乳腺癌T47D细胞系的增殖抑制作用具有浓度依赖性(表 1)。
表 1 芹菜素对乳腺癌T47D细胞系增殖的影响(x±s)Table 1. Effect of apigenin on the proliferation of breast cancer T47D cell line
2.2 芹菜素诱导乳腺癌T47D细胞p53依赖性凋亡
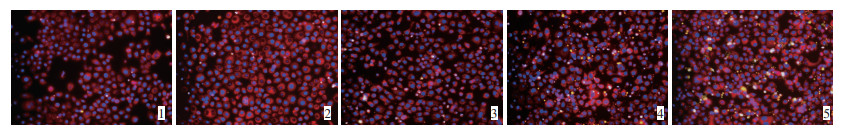
Hochest33342标记细胞核为蓝色荧光,Mito-Track Red标记线粒体为红色荧光,Yo-pro-1将凋亡细胞标记绿色荧光。见图 1。对照组无凋亡细胞,实验组T47D细胞的凋亡随芹菜素处理浓度的增加而明显增加,与对照组相比有显著性差异(P < 0.05)。流式细胞仪结果显示,随着芹菜素浓度的增高,各组凋亡率分别为(2.41±0.072)%、(10.87±0.028)%、(18.02± 0.056)%、(37.05±0.092)%和(78.38±0.082)%,与对照组相比,差异有统计学意义(P < 0.05)。
Western blot检测结果显示,随芹菜素浓度的增高,Bcl-2的表达减少,而p53、Bax的含量及Cas⁃ pase-3、PARP的剪切明显增加(图 2)。
2.3 芹菜素诱导G2/M期阻滞
流式细胞仪分析结果显示,芹菜素可将T47D细胞周期阻滞在G2/M期,且随着芹菜素浓度的升高,G2/M期所占比例依次增加,分别为(14.7±0.12)%、(21.1± 0.11)%、(25.1 ± 0.35)%、(28.9 ± 0.29)% 和(35.3 ± 0.25)%,与对照组相比,差异有统计学意义(P < 0.05)。Western blot结果显示,芹菜素处理后CyclinB1、Cdc2的含量表达减少,而p-Cdc2及周期调节蛋白p21的含量增加(图 3)。
3. 讨论
研究报道,芹菜素能够对多种肿瘤细胞产生增殖抑制作用[2-3]。本研究中流式细胞仪结果显示,芹菜素能够明显的诱导G2/M期阻滞。CyclinB1/Cdc2复合物的形成是细胞周期由G2期进入M期的关键因素,而p21能够与Cdc2结合而抑制其激酶的活性,从而抑制细胞周期由G2期进入M期[4]。Cdc2磷酸化后处于失活状态,当细胞周期进入G2/M期后p-Cdc2被去磷酸化而激活,进而Cdc2与CyclinB1结合成复合物。Western blot发现,芹菜素处理后Cdc2及CyclinB1的含量均明显降低,而p-Cdc2及周期调节蛋白p21却明显增高。
除周期阻滞外,芹菜素还能够诱导T47D细胞系凋亡。凋亡是细胞程序化死亡的过程,分为p53依赖性凋亡及非p53依赖性凋亡。p53是细胞内重要的抑癌基因,其基因突变是造成多种肿瘤发生的原因之一[5]。p53的过表达源于对DNA的损伤,其转录产物p53蛋白能够促进p21的表达,后者通过阻滞细胞周期而给予细胞充分的时间修复损伤的基因,从而维持细胞遗传的稳定性。若基因修复失败,p53会促进Bax的表达使细胞走向凋亡[6]。研究表明,Bax/Bcl-2比率的增加是细胞发生内源性凋亡的使动因素[7]。当Bax/Bcl-2比率增高后,会导致线粒体膜电位的改变,促进细胞色素c的释放,从而使细胞凋亡[8]。本研究发现,芹菜素能够促进p53的表达,且p53下游的p21及Bax的含量均明显增加,因而考虑芹菜素是通过诱导p53的表达进而产生周期阻滞及凋亡诱导作用。
总之,芹菜素作为一种天然化合物,能够通过诱导p53依赖性凋亡及G2/M期阻滞,有效的抑制乳腺癌T47D细胞系的增殖。因而,芹菜素为乳腺癌的治疗提供了新的策略,特别是芹菜素与临床标准化疗药物的联合应用在降低药物不良反应等方面具有较好的应用前景,并有待进一步研究。
-
表 1 芹菜素对乳腺癌T47D细胞系增殖的影响(x±s)
Table 1 Effect of apigenin on the proliferation of breast cancer T47D cell line

-
[1] Patel D, Shukla S, Gupta S. Apigenin and cancer chemoprevention: progress, potential and promise (review)[J]. Int J Oncol, 2007, 30 (1): 233-245.
[2] Shukla S, Gupta S. Apigenin suppresses insulin-like growth factor Ⅰ receptor signaling in human prostate cancer: an in vitro and in vivo study[J]. Mol Carcinog, 2009, 48(3): 243-252. DOI: 10.1002/mc.20475
[3] Ujiki MB, Ding XZ, Salabat MR, et al. Apigenin inhibits pancreatic cancer cell proliferation through G2/M cell cycle arrest[J]. Mol Cancer, 2006, 5: 76. DOI: 10.1186/1476-4598-5-76
[4] Choi EJ, Kim GH. Apigenin causes G(2)/M arrest associated with the modulation of p21(Cip1) and Cdc2 and activates p53-dependent apoptosis pathway in human breast cancer SK-BR-3 cells[J]. J Nutr Biochem, 2009, 20(4): 285-290. DOI: 10.1016/j.jnutbio.2008.03.005
[5] Shukla S, Gupta S. Apigenin-induced prostate cancer cell death is initiated by reactive oxygen species and p53 activation[J]. Free Radic Biol Med, 2008, 44(10): 1833-1845. DOI: 10.1016/j.freeradbiomed.2008.02.007
[6] Lee WT, Chang CW. Bax is upregulated by p53 signal pathway in the SPE B-induced apoptosis[J]. Mol Cell Biochem, 2010, 343 (1-2): 271-279. DOI: 10.1007/s11010-010-0522-6
[7] Choi EJ, Kim GH. Apigenin induces apoptosis through a Mitochondria/Caspase-Pathway in Human Breast Cancer MDA-MB-453 Cells[J]. J Clin Biochem Nutr, 2009, 44(3): 260-265. DOI: 10.3164/jcbn.08-230
[8] Zhao M, Guo T, Wang M, et al. The course of uncarinic acid E-induced apoptosis of HepG2 cells from damage to DNA and p53 activation to mitochondrial release of cytochrome c[J]. Biol Pharm Bull, 2006, 29(8): 1639-1644. DOI: 10.1248/bpb.29.1639



 下载:
下载: