Changes in Dendritic Cells of Peripheral Blood in 74 Lung Cancer Patients before and after GVAX Treatment and Their Clinical Significance
-
摘要:目的 探讨粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)基因修饰的肿瘤细胞疫苗治疗前后肺癌患者外周血中DC两个不同亚群(DC1,DC2)的比例、治疗前后比例变化与临床病理特征的相关性及对生存的影响。方法 对74例接受GM-CSF基因修饰的肿瘤细胞疫苗(GM- CSF modified tumor cell vaccine,GVAX)治疗的肺癌患者,采用流式细胞技术检测患者治疗前后外周血DC及淋巴细胞亚群的比例,分析治疗前后DC比例的变化、治疗前后DC比例与治疗前血清标志物及免疫细胞的关系、治疗前后DC比例对肺癌患者生存的影响。结果 接受GVAX疫苗治疗后外周血DC1与DC2比例无明显变化(PDC1=0.786,PDC2=0.779);神经烯醇化酶(NSE)水平升高组中的DC亚群比例高于NSE水平正常组;治疗后DC2比例与治疗前Treg呈负相关;对于早期肺癌患者,治疗后DC2比例低于均值者的生存时间比高于均值者的生存时间明显延长。结论 治疗后DC2比例可作为早期患者GVAX疫苗疗效及判断预后的免疫指标,其对预后的影响可能与患者外周血Treg比例有一定的相关性。
-
关键词:
- 肺癌 /
- 树突状细胞 /
- 调节性T细胞 /
- 粒-巨噬细胞集落刺激因子 /
- 预后
Abstract:Objective Dendritic cells (DC) can be divided into two subgroups based on the markers and functions: myeloid-DC (DC1) and plasmacytoid-DC (DC2). This study evaluated the clinical significance of the proportion of DC subgroups in the peripheral blood of lung cancer patients before and after GVAX vaccineation.Methods Seventy-four patients with lung cancer were enrolled in the study. Flow cytometry was used to detect the proportion of DCs and lymphocyte subgroups before and after GVAX vaccination. The correlation of DCs with serum markers and immune cells was tested. The Kaplan-Meier was used to analyze the correlations between DCs and survival of patients.Results There was no significant change in the proportion of DCs after GVAX vaccination. The proportion of DCs was higher in the group with elevated levels of neuron-specific enolase (NSE) than in normal controls. A negative correlation was observed between the proportion of DC2 post-GVAX vaccination and the proportion of Treg pre-GVAX vaccination. For patients with early lung cancer, those with a proportion of DC2 below the mean value after vaccination had better overall survival compared with those with a proportion of DC2 greater than the mean value.Conclusion A low proportion of DC2 after GVAX vaccination is a predictor of better prognosis for patients who received GVAX vaccination. DC2 proportion post-GVAX vaccination may have a correlation with the proportion of Treg in the peripheral blood pre-GVAX vaccination.-
Keywords:
- Lung cancer /
- Dendritic cells (DCs) /
- Regulatory T cell /
- GM-CSF /
- Prognosis
-
肺癌是当今世界各国常见的恶性肿瘤之一,居世界癌症死因的首位,被认为是目前对人类健康和生命威胁最大的恶性肿瘤之一[1]。在我国,肺癌的发病率迅速上升。近年来,GM- CSF基因修饰的肿瘤细胞疫苗(GM-CSF modified tumor cell vaccine,GVAX)作为一种新型的治疗技术被广泛应用于肺癌治疗,Ⅰ期临床试验证实GVAX治疗对改善肺癌预后有确切的疗效[2]。GVAX是将粒-单核细胞集落刺激因子基因转入肿瘤细胞后进行辐射处理制成的GM-CSF基因修饰的肿瘤细胞疫苗,其分泌的细胞因子GM-CSF能够刺激树突状细胞(dendritic cells,DC)等抗原递呈细胞的增殖、分化、活化、成熟和趋化,通过粒细胞、嗜酸性细胞、巨噬细胞等的再募集介导肿瘤破坏[3-4]。本研究组[5]前期研究已经证实GVAX治疗前后外周血Treg的变化能够预测肺癌患者预后,对于接受GVAX治疗的肺癌患者外周血中的DC及其亚群对肺癌患者预后的影响鲜见明确报道。本研究对经GVAX治疗的肺癌患者外周血DC亚群的变化与临床病理特征及预后关系进行分析,以探讨DC在评价GVAX治疗疗效中的重要意义。
1. 材料与方法
1.1 材料
选取2007年3月至2010年7月间天津医科大学附属肿瘤医院接受GVAX治疗的肺癌患者74例,其中男50例,女24例,年龄28~81岁,中位年龄59岁;吸烟37例,不吸烟37例;小细胞肺癌7例,非小细胞肺癌(包括鳞癌、腺癌、大细胞癌)67例;手术35例,未手术39例。KPS评分均为60~100分。根据第6版美国癌症联合委员会(AJCC)肺癌分期标准:早期(Ⅰ~ⅢA期)38例,晚期(ⅢB~Ⅳ期)36例。74例肺癌患者均接受GVAX疫苗治疗,治疗1个周期者52例(早期22例,晚期30例),多于1个周期者22例(早期8例,晚期14例)。全组除9例患者外(Ⅰ期5例,Ⅱ期1例,Ⅲ期1例,Ⅳ期2例),其余65例患者均接受过化疗治疗,化疗方案以紫杉醇+顺铂、长春瑞宾(诺维本)+顺铂为主,1~31个周期,GVAX治疗前3个月内74例患者均未接受过任何治疗。
1.2 方法
1.2.1 GVAX疫苗治疗方案
1)疫苗的制备:应用疫苗的肿瘤细胞是与患者病理类型相同的细胞系,每次注射灭活肿瘤细胞>1×107,并且GM-CSF分泌量>1 μg/106细胞/24 h。2)疫苗的注射:每次皮内注射GVAX疫苗1 mL,1次/w,6次为1个周期。注射部位为上臂内侧中上1/3,大腿内侧中上1/3,轮流注射。
1.2.2 淋巴细胞、T细胞亚群、NK细胞与DC细胞的检测方法
检测当天抽取清晨空腹外周静脉3 mL(EDTA抗凝)。检测方法:采用CD3/CD4(BD公司)、CD3/CD8(BD公司)、CD3/CD16+56/CD45(BD公司)、CD4-Per-CP/ CD25-PE /CD127-APC(Biolegend公司)、Lin1 FITC/ HLA-DR PerCP/CD11c PE和Lin1 FITC/HLA-DR PerCP/ CD123 PE(BD公司)三色荧光抗体。标本制备:将标记的3支流式管分别加入20 μL同型对照试剂及相对应的荧光抗体。取待测样本100 μL分别加入各管,室温避光孵育30 min后加溶血素(BD公司)1.5 mL,静置10 min,1 500 r/min离心5 min,弃上清,2 mL PBS洗涤2次;加1% 多聚甲醛0.5 mL,上流式细胞仪检测表型。Cell Quest软件分析数据。检测指标分别为淋巴细胞比例、CD4+ T细胞比例、CD8+T细胞比例、CD3-CD16+56+CD45+NK细胞比例、CD4+CD25+CD127-T细胞占CD4+T细胞的比例、Lin-HLA-DR+CD11c+DC1比例、Lin-HLA-DR+CD123c+DC2的比例。
1.2.3 随访
随访方式为电话及门诊随访,随访截止日期为2011年3月,随访时间为1~39个月,随访周期为3个月/次,全组患者均获得随访,中位随访时间为17个月。
1.3 统计学方法
应用SPSS 17.0软件进行统计学分析,计量资料采用x±s表示,治疗前后外周血DC细胞比例变化采用配对t检验,治疗前后DC比例及治疗前后比例变化与临床病理特征的相关性采用独立样本t检验及相关性分析,治疗前后DC比例及治疗前后比例变化对生存的影响采用Kaplan-Meier法。P < 0.05为差异有统计学意义。
2. 结果
2.1 GVAX治疗前后DC细胞分布
本组74例患者接受GVAX治疗前DC1为(2.098±2.508)%,治疗后为(2.032±2.172)%;治疗前DC2为(0.635±0.686)%,治疗后为(0.609±0.698)%。将GVAX治疗前后外周血DC1与DC2比例经配对t检验,结果显示治疗前后DC1和DC2变化均不明显,差异无统计学意义(PDC1=0.786,PDC2=0.779)。且按性别、年龄等患者的一般情况分组后统计,治疗前后DC亚群比例差异均无统计学意义(表 1)。
表 1 GVAX治疗前后肺癌患者外周血DC细胞分布x±s,% Table 1. Distribution of DCs before and after GVAX vaccination in the different groupsx±s, % 
2.2 治疗前后DC比例及其比例的变化与检测指标的相关性
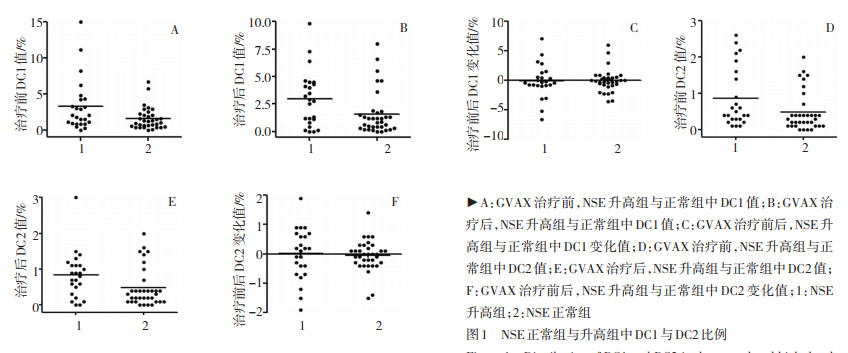
将治疗前后DC比例及其DC变化与检测的血常规及肿瘤标志物等指标进行相关性分析。结果显示,治疗前神经元烯醇化酶(neuron-specific enolase,NSE)与DC比例存在相关性,治疗前DC1、治疗前DC2,治疗后DC1、治疗后DC2在NSE升高组中的水平均高于NSE正常组(P < 0.05),但治疗前后DC的变化在NSE升高组和正常组中无显著性差异(图 1)。白细胞、血红蛋白、血小板、癌胚抗原与治疗前后DC比例及变化均无相关性(表 2)。
表 2 DC与GVAX治疗前实验室检测指标相关性Table 2. Correlation between DC and indices tested in the laboratory before GVAX treatment
2.3 DC亚群与GVAX治疗前免疫细胞比例的相关性
将治疗前DC亚群的比例与治疗前采用流式细胞术测得的免疫细胞比例进行相关性分析,结果显示无显著性差异(P>0.05)。将治疗后DC亚群的比例与治疗后测得的免疫细胞比例进行相关性分析,结果亦无显著性差异(P>0.05)。
2.4 治疗前后DC比例及其对预后的影响
2.4.1 总体生存率及生存期分析
74例接受GVAX治疗的肺癌患者总生存时间为1~37个月,早、晚期患者中位生存时间分别为26、18个月。1、2、3年生存率分别为67.2%、47.1%、44.7%,早期和晚期患者1、2、3年生存率分别为73.5%和60.5%、59.4%和30.8%、59.4%和23.1%。
2.4.2 DC1及DC2与肺癌患者预后的关系
将治疗前DC1比例按其均值2.099%分为高低两组,Ka⁃ plan-Meier分析两组中位OS分别为21、25个月;将治疗后DC1比例按其均值2.032%分为高低两组,中位OS分别为23、21个月,两组OS比较差异均无统计学意义(P>0.05,图 2)。
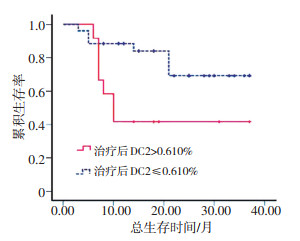
将治疗前DC2比例按其均值0.635%分为高低两组,中位OS分别为21、23个月;将治疗后DC2比例按其均值0.610%分为高低两组,中位OS均为23个月(因高于均值组仍有50%以上的患者生存,故此处以平均中位生存时间代替中位生存时间),Kaplan-Meier分析显示两组中OS差异无统计学意义(P>0.05)。
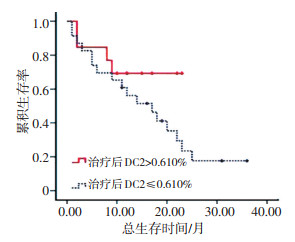
虽然治疗后DC2比例对总体OS影响,但经统计发现,在早期患者中,治疗后DC2比例>均值与≤均值两组OS分别为10、36个月,差异有统计学意义(P < 0.05,图 2)。而在晚期患者中,差异无统计学意义(图 3)。
3. 讨论
DC首先由Steinman等[6]于1973年从小鼠脾脏中分离出,分布于脑以外的全身组织和脏器,但数量少,仅占人外周血单核细胞的1%,因其具有许多分支状突起命名。根据其表面标记和功能,DC可分为髓系DC(myeloid-DC,mDC)和浆细胞DC(plasmacytoid-DC,pDC)两个大的亚群,前者与单核细胞、粒细胞有共同的祖细胞,能够引发Th1反应,也称为DC1,主要参与抗肿瘤免疫;pDC与T细胞、B细胞有共同的前体细胞,能够激发Th2型反应,也称为DC2,主要参与免疫耐受[7]。DC1是国内研究较多的肿瘤疫苗的主要效应细胞。
GVAX疫苗已用于多种肿瘤的治疗[2, 8-11],其安全性和生物活性也在这些临床应用中得到了体现[12-13],已被公认为是一种安全、有效的肿瘤疫苗。本研究首先对GVAX治疗前后DC比例进行比较分析,发现变化较小,差异无统计学意义,提示GVAX治疗对肺癌患者外周血DC比例影响较小。在分析治疗前后DC比例及治疗前后DC比例变化与检测指标相关性时,结果显示NSE升高组的治疗前后DC1及DC2水平普遍高于NSE正常组(P < 0.05),而DC变化在两组中比例相当。提示NSE可以影响外周血中DC的整体比例,而并不针对DC的某一亚群。NSE与DC间这种相关性的解释,鲜见文献报道。
虽然治疗前后DC两个亚群的变化均不显著,对患者预后评价的指导意义不大,但经统计学分析发现,对于早期患者,治疗后DC2比例低于均值者的生存时间比高于均值者的生存时间明显延长(P < 0.05),关于DC2对于早期患者预后的影响,本研究认为可能是通过调节性T细胞(regulatory T cell,Treg)间接发挥作用的。Treg是一类具有免疫调节或免疫抑制功能的T细胞亚群,由Sakaguchi等[14]于1995年首次报道。Curiel等[15]指出多种肿瘤包括肺癌、乳腺癌、肝癌、卵巢癌、胃癌、淋巴瘤等均发现这群细胞的存在,其数量因肿瘤的不同而异,而肿瘤局部Treg的数量与肿瘤的预后密切相关。Treg不仅能通过细胞间的直接接触抑制效应T细胞的功能,还能通过分泌细胞因子等多种方式发挥抑制作用[16]。有研究[16]显示,成熟pDC即DC2能够诱导CD4+CD25+Treg形成并产生免疫抑制功能。人外周血中分离的处于未成熟状态的pDC,经TLR9识别CpG ODN(A,B,C)活化成熟后,诱导初始CD4+CD25-细胞分化成CD4+CD25+Treg。该细胞特异性高表达Foxp3,分泌细胞因子IL-10、TGF-β,抑制幼稚CD4+T细胞的活化,从而产生强大的免疫抑制功能[17]。pDC在诱导CD4+CD25+ Treg产生的同时表达ICOS分子,分泌IL-10和TGF-β起到免疫抑制功能[18-19]。Cao等[20]研究认为肿瘤Treg可通过颗粒酶B和穿孔素抑制机体抗肿瘤免疫。pDC缺乏穿孔素但表达颗粒酶B,虽然其作用仍不明确,但可能与Treg的免疫抑制功能有关[21]。而Treg是否能够反过来诱导或促进pDC的表达目前尚不明确。
综上所述,本组肺癌患者肿瘤标志物NSE与DC表达有相关性,其具体机制还需要大量基础研究论证。治疗后DC2比例对预后的影响可能为临床医师评价肺癌GVAX治疗及肺癌患者预后提供了一个良好指标。GVAX治疗因其确切疗效,无严重不良反应,在肿瘤治疗中的应用将会越来越广泛,而且还可与其他治疗方法联合应用。接受该治疗后如何简便准确的评价患者预后仍是一个难题,寻求一个合适的实验室或临床病理指标将为临床医师选择治疗方案起到一定的指导作用。
-
表 1 GVAX治疗前后肺癌患者外周血DC细胞分布
x±s,% Table 1 Distribution of DCs before and after GVAX vaccination in the different groups
x±s, % 
表 2 DC与GVAX治疗前实验室检测指标相关性
Table 2 Correlation between DC and indices tested in the laboratory before GVAX treatment

-
[1] 邹小农. 中国肺癌流行病学[J]. 中华肿瘤防治杂志, 2007, 14(12): 881-883. DOI: 10.3969/j.issn.1673-5269.2007.12.001 [2] Nemunaitis J, Jahan T, Ross H, et al. Phase 1/2 trial of autologous tumor mixed with an allogeneic GVAX vaccine in advanced-stage non-small-cell lung cancer[J]. Cancer Gene Ther, 2006, 13(6): 555-562. DOI: 10.1038/sj.cgt.7700922
[3] Huang AY, Bruce AT, Pardoll DM, et al. In vivo cross-priming of MHC class I-restricted antigens requires TAP transporter[J]. Immunity, 1996, 4(4): 349-355. DOI: 10.1016/S1074-7613(00)80248-4
[4] Huang AY, Golumbek P, Ahmdzadeh M, et al. Role of bone marrow-derived cells in presenting MHC class I-restricted tumor antigens[J]. Science, 1994, 264(5161): 961-965. DOI: 10.1126/science.7513904
[5] 杜春娟, 于津浦, 李慧, 等. GM- CSF修饰肿瘤细胞疫苗治疗前后肺癌患者Treg的变化及其临床意义[J]. 中国肿瘤生物治疗, 2011.18(5): 473-479. DOI: 10.3872/j.issn.1007-385X.2011.05.002 [6] Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. morphology, quantitation, tissue distribution[J]. J Exp Med, 1973, 137(5): 1142-1162. DOI: 10.1084/jem.137.5.1142
[7] Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice[J]. J Immunol, 2007, 178(1): 5-25. http://www.ncbi.nlm.nih.gov/pubmed/17182535
[8] Hege KM, Jooss K, Pardoll D. GM-CSF gene-modifed cancer cell immunotherapies: of mice and men[J]. Int Rev Immunol, 2006, 25 (5-6): 321-352. DOI: 10.1080/08830180600992498
[9] Small EJ, Sacks N, Nemunaitis J, et al. Granulocyte-macrophage colony-stimulating factor-secreting allogeneic cellular immunotherapy for hormone-refractory prostate cancer[J]. Clin Cancer Res, 2007, 13(13): 3883-3891. DOI: 10.1158/1078-0432.CCR-06-2937
[10] Jaffee EM, Hruban RH, Biedrzycki B, et al. Novel allogeneic granulocyte-macrophage colony-stimulating factor-secreting tumor vaccine for pancreatic cancer: A phase I trial of safety and immune activation[J]. J Clin Oncol, 2001, 19(1): 145-156. DOI: 10.1200/JCO.2001.19.1.145
[11] Luiten RM, Kueter EW, Mooi W, Gallee MP, et al. Immunogenicity, including vitiligo, and feasibility of vaccination with autologous GM-CSF-transduced tumor cells in metastatic melanoma patients [J]. J Clin Oncol, 2005, 23(35): 8978-8991. DOI: 10.1200/JCO.2005.01.6816
[12] 康红刚, 王运良, 于津浦, 等. GM-CSF修饰的异体肿瘤细胞疫苗治疗晚期肿瘤的Ⅰ期临床试验[J]. 中国医药生物技术, 2008, 3(6)∶420-424. DOI: 10.3969/j.issn.1673-713X.2008.06.006 [13] Simons JW, Carducci MA, Mikhak B, et al. Phase I/Ⅱ trial of an allogeneic cellular immunotherapy in hormone-naïve prostate cancer [J]. Clin Cancer Res 2006, 12(11Pt1): 3394-3401. http://pdfs.semanticscholar.org/759e/3cd4a2b3cd993a06ccb91697563c92d9be14.pdf
[14] Sakaguchi S, Sakaguchi N, Asano M, et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha chains(CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune disease[J]. J Immunol, 1995, 155 (3): 1151-1164. http://www.ncbi.nlm.nih.gov/pubmed/7636184
[15] Curiel TJ, Coukos G, Zou L, et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival[J]. Nat Med, 2004, 10(9): 942-949. DOI: 10.1038/nm1093
[16] ZouW. Regulatory T cells, tumour immunity and immunotherapy [J]. Nat Rev Immunol, 2006, 6(4): 295-307. DOI: 10.1038/nri1806
[17] Moseman EA, Liang X, Dawson AJ, et al. Human plasmacytoid dendritic cells activated by CpG oligodeoxy nucleotides induce the generation of CD4+CD25+regulatory T cells[J]. J Immunol, 2004, 173 (7): 4433-4442. DOI: 10.4049/jimmunol.173.7.4433
[18] Simpson TR, Quezada SA, Allison JP. Regulation of CD4 T cell activation and effect or function by inducible costimulator(ICOS)[J]. Curr Opin Immunol, 2010, 22(3): 326-332. DOI: 10.1016/j.coi.2010.01.001
[19] Ito T, Hanabuchi S, Wang YH, et al. Two functional subsets of Foxp3+ regulatory T cells in human thymus and periphery[J]. Immunity, 2008, 28(6): 870-880. DOI: 10.1016/j.immuni.2008.03.018
[20] Cao X, Cai SF, Fehniger TA, et al. Granzyme B and perforin are important for regulatory T cell2 mediated suppression of tumor clearance[J]. Immunity, 2007, 27(4): 635-646. DOI: 10.1016/j.immuni.2007.08.014
[21] Gondek DC, Lu LF, Quezada SA, et al. Cutting edge: contact-mediated suppression by CD4 + CD25 + regulatory cells involves a granzyme B-dependent, perforin-independent mechanism[J]. J Immunol, 2005, 174(4): 1783-1786. DOI: 10.4049/jimmunol.174.4.1783



 下载:
下载: