-
摘要:目的 检测结直肠癌组织中Bmi-1、PTEN和E-Cadherin的表达,探讨三者表达的相关性及意义。方法 用Western blot检测Bmi-1在5对结直肠癌和癌旁活检组织中的表达,实时定量PCR法检测Bmi-1、PTEN和E-Cadherin mRNA在28对结直肠癌和癌旁活检组织的表达;用免疫组织化学法检测Bmi-1、PTEN和E-Cadherin在28例结直肠癌石蜡组织中的表达及其相关性。结果 Bmi-1蛋白在5例结直肠癌活检组织中的表达明显高于癌旁组织;Bmi-1 mRNA在89.3%(25/28)的癌组织中的表达高于癌旁组织;PTEN和E-Cadherin mRNA在82.1%(23/28)的癌组织中的表达低于癌旁组织;统计学分析发现Bmi-1和PTEN及E-Cad? herin的mRNA表达水平呈负相关;28例结直肠石蜡组织中,Bmi-1、PTEN和E-Cadherin蛋白的阳性率分别为92.9%(26/28)、46.4%(13/28)和82.1%(23/28),统计学分析发现Bmi-1和PTEN及E-Cadherin蛋白表达水平呈负相关。结论 本研究发现Bmi-1和PTEN及E-Cadherin之间呈负相关,从组织水平证实Bmi-1对PTEN及E-Cadherin的调控关系,为Bmi-1作为预测结直肠癌发生及转移的分子标志物及治疗新靶点提供了新的理论依据。
-
关键词:
- 结直肠癌 /
- Bmi-1 /
- PTEN /
- E-Cadherin
Abstract:Objective To determine the expression of f Bmi-1, PTEN, and E-cadherin in colorectal cancer, and analyze the correlation among Bmi-1, PTEN and E-cadherin.Methods Western blot analysis was performed to detect Bmi-1 expression in five colorectal cancer biopsies and matched adjacent noncancerous tissues. Real-time reverse transcription polymerase chain reaction (RT-PCR) was performed to determine the protein and mRNA levels of Bmi-1, PTEN, and E-cadherin in 28 colorectal cancer biopsies and matched adjacent non-cancerous tissues. The protein levels of Bmi-1, PTEN, and E-cadherin in 28 paraffin-embedded colorectal cancer tissues were detected via immunohistochemistry. Statistical analysis was performed to evaluate the association among Bmi-1, PTEN, and E-cadherin at both the mRNA level and the protein level.Results Bmi-1 was clearly upregulated in the 5 colorectal cancer biopsies and their matched adjacent non-cancerous tissues. Bmi-1 mRNA was upregulated in 89.3% (25/28) of colorectal cancer biopsies compared with the adjacent noncancerous tissues. PTEN and E-cadherin mRNA were downregulated in 82.1% (23/28) of colorectal cancer biopsies compared with adjacent noncancerous tissues. High Bmi-1 mRNA expression was significantly correlated with low levels of PTEN and E-cadherin mRNA. Immunohistochemistry and statistical analyses revealed that high Bmi-1 protein expression was significantly associated with low levels of PTEN and E-cadherin.Conclusion This study provided evidence of the negative regulation of PTEN and E-cadherin by Bmi-1 at the clinical tissue level. Bmi-1 is a biomarker for colorectal cancer progression and metastasis and may be used as a therapeutic target.-
Keywords:
- Colorectal cancer /
- Bmi-1 /
- PTEN /
- E-Cadherin
-
上皮细胞-间质细胞转化(epithelial-mesenchy⁃ mal transition,EMT)指上皮细胞在形态学上发生成纤维细胞或间质细胞表型的转变并获得迁移的能力,是肿瘤侵袭转移的早期关键步骤[1]。细胞在发生EMT时,上皮细胞分子标记物E-Cadherin、α-Catenin等表达下降,间质分子标志物Vimentin、Fibronectin等表达升高[2]。Bmi-1(B-cell-specific moloney leuke⁃ mia virus insert site-1)属于多梳基因家族抑制复合体1(polycomb repressive complex 1,PRC1)的成员,被公认为是一个癌基因[3]。研究表明,Bmi-1具有诱导细胞永生化,促进肿瘤的早期转化,维持及促进干细胞的自我更新等重要功能[4]。在前期研究中发现Bmi-1能够直接结合抑癌基因PTEN的启动子,抑制PTEN mRNA的表达,从而激活PI3K/AKT信号通路,进而上调Snail的表达、抑制E-Cadherin转录,从而诱导EMT现象的发生,增强肿瘤细胞的侵袭、转移能力[5]。本研究拟在结直肠癌组织中检测Bmi-1、PTEN和E-Cadherin的表达,并探讨三者之间的表达相关性,从临床标本的角度分析验证Bmi-1与PTEN以及E-Cadherin的调控关系。
1. 材料与方法
1.1 材料
1.1.1 标本来源
28例结直肠癌及癌旁组织(距癌边界15 cm)取自南方医院手术患者,均经病理证实为腺癌,标本置于液氮保存,用以抽提RNA及总蛋白,并取适量组织标本经4%中性甲醛固定、石蜡包埋和常规切片。符合伦理委员会认可。
1.1.2 主要试剂
Trizol购自Invitrogen公司,逆转录试剂盒及SYBR Premix ExTaqTM试剂盒购自TaKaRa公司;鼠抗人Bmi-1抗体购自Upstate公司;鼠抗人PTEN抗体购自Santa Cruz公司;鼠抗人E-Cadherin抗体购自BD公司;PVDF膜购自Millipore公司;免疫组化试剂盒SP-9000和DAB显色剂均购自北京中杉金桥公司。
1.2 方法
1.2.1 Western blot
检测Bmi-1的表达取30 μg组织蛋白用9%SDS-PAGE凝胶进行电泳分离,将凝胶中的蛋白用湿转法转印至0.45 cm的PVDF膜上。转膜结束后,将膜置于5%脱脂奶粉中封闭1 h,然后加入抗体鼠抗人的Bmi-1单克隆抗体(1:500),置于4 ℃冰箱孵育过夜。用1×TBST洗膜15 min 3次后,加入辣根过氧化物酶标记的二抗,于室温孵育45 min,再用1×TBST将未结合的抗体洗脱,加入ECL发光液显色后,将膜置于暗盒内曝光于X胶片上,胶片常规显影、定影。
1.2.2 实时定理PCR法检测结直肠癌组织中Bmi-1、PTEN和E-Cadherin的表达
1)RNA的制备:取新鲜结直肠癌及癌旁组织,在液氮中研磨后,参照说明书加入Trizol试剂提取组织总RNA,并测定RNA浓度。2)cDNA第一链的合成:按照逆转录试剂盒说明书进行操作,反应总体系为10 μL。其中RNA 1 μL,MMLV逆转录酶0.25 μL,5×逆转录缓冲液2 μL,dNTPs 2 μL,Random 6 Mers 0.5 μL,Ribonuclease inhibitor 0.25 μL,DEPC水4 μL,反应条件为:42 ℃反应10 min,95 ℃ 2 min。3)Real-time PCR:GAPDH上游引物为5'-ACA GTCAGCCG⁃ CATCTTCTT-3',下游引物为5'-GACAAGCTTCCC⁃ GTTCTCAG-3';Bmi-1上游引物为5'-CTGGTTGC CCATTGACAGC-3',下游引物为5'-CAGAAAATGA ATGCGAGCCA-3';PTEN上游引物为5'-AGCCG TTCGGAGGATTATTCG-3',下游引物为5'-CTTCTC CTCAGCAGCCAGAG-3';E-Cadherin上游引物为5'-GAACAGCACGTACACAGCCCT-3',下游引物为5'-GCAGAAGTGTCCCTGTTCCAG-3'。采用上述引物,应用Mx3000P定量PCR仪(Stratagene)进行Real-time PCR实验,反应条件为94 ℃ 30 s,55℃ 30 s,72℃ 30 s,共45个循环。以Folds=2-ΔΔCt计算目的基因的相对表达量,公式如下ΔΔCt=[Ct(BMI-1)-Ct(GAPDH)],以癌组织(T)中的相对表达量与正常组织(N)中的相对表达量相比(T/N)或正常组织(N)中的相对表达量与癌组织(T)中的相对表达量相比(N/T),评价Bmi-1、PTEN和E-Cadherin基因在癌组织的表达情况。实验重复3次,计算平均值。
1.2.3 免疫组化检测Bmi-1、PTEN和E-Cadherin在结直肠癌组织中的表达
采用S-P法,操作按照试剂盒说明进行。鼠抗人Bmi-1抗体按1:200稀释;鼠抗人PTEN抗体按1:200稀释;鼠抗人E-Cadherin抗体按1:1 000稀释;用0.01M的PBS取代一抗做阴性对照,苏木素复染。据染色强弱程度计分:阴性染色0分,弱阳性1分,中等强度2分,强染色3分。同样物镜下计数阳性细胞数,阳性细胞率 < 30%为1分,阳性细胞率30%~70%为2分,>70%为3分。两项得分相乘,0分和1分为(-),2分和3分为(+),4分和6分为(++),9分为(+++)。统计学分析时,(-)和(+)合计为阴性或弱阳性表达,(++)和(+++)合计为强阳性表达。
1.3 统计学分析
使用SPSS 10.0软件对所得数据进行分析。癌组织和癌旁组织中的表达比较采用t检验,各基因之间的相关性比较采用Spearman相关性分析。P < 0.05为差异有统计学意义。
2. 结果
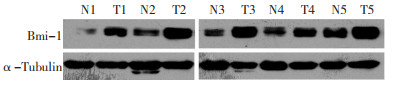
2.1 Bmi-1蛋白在结直肠癌组织中表达上调
提取5对结直肠癌及癌旁组织的总蛋白,经蛋白定量后进行Western blot检测。结果发现Bmi-1在5例癌组织中的表达水平均明显高于配对的癌旁组织(图 1)。
2.2 实时定理PCR法检测Bmi-1、PTEN和E-Cadherin mRNA的表达
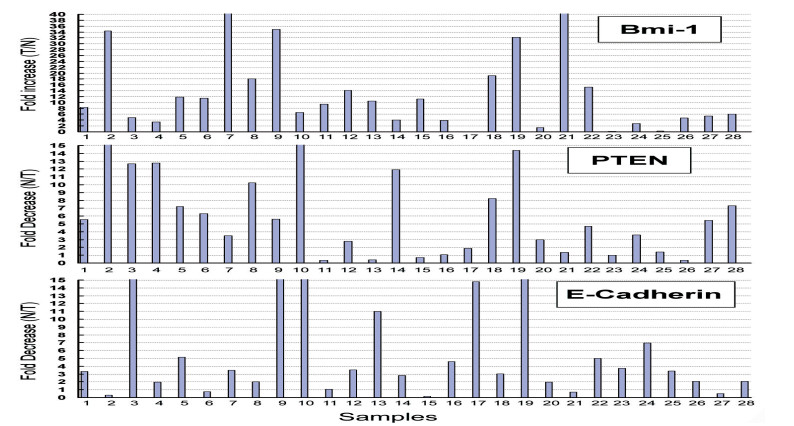
以肿瘤组织(T)和癌旁组织(N)中相对表达量的比值(T/N或N/T)分析Bmi-1、PTEN和E-Cadherin mRNA在肿瘤中的上调或下调倍数。结果如图 2所示,Bmi-1 mRNA在89.3%(25/28)的结直肠癌组织的表达高于配对的癌旁组织,且其升高倍数均在2倍以上;PTEN mRNA在82.1%(23/28)的结直肠癌组织中的表达低于癌旁组织,下降倍数为2倍以上的为22例;E-Cadherin mRNA在82.1%(23/28)的结直肠癌组织中的表达低于癌旁组织,下降倍数为2倍以上的为17例。
2.3 Bmi-1、PTEN和E-Cadherin mRNA在结直肠癌中的表达及相关性分析
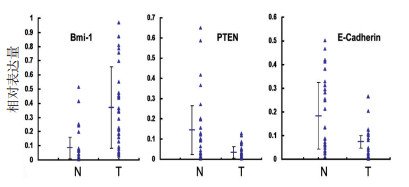
采用成对组织的t检验(paired samples test)分析发现,Bmi-1 mRNA在癌组织中的表达明显高于正常组织(P < 0.001),而PTEN和E-Cadherin mRNA在癌组织中的表达明显低于正常组织(P=0.001,图 3)。Spearman相关性分析发现,在本组28对结直肠癌组织及相应的癌旁组织中,Bmi-1和PTEN的mRNA表达呈负相关(r=-0.0464,P < 0.001);Bmi-1和PTEN的mRNA表达亦呈负相关(r=-0.0272,P=0.043);PTEN与E-Cadherin的mRNA表达水平无明显相关性(r= 0.159,P=0.243)。
2.4 Bmi-1、PTEN和E-Cadherin蛋白在结直肠癌石蜡组织中的表达及相关性分析
结果发现Bmi-1、PTEN和E-Cadherin蛋白的阳性率分别为92.9%(26/28)、46.4%(13/28)和82.1%(23/28),其中Bmi-1的强阳性表达率为60.7%(17/ 28),E-Cadherin的强阳性表达率为39.3%(11/28)。Spearman相关性分析发现与mRNA水平的表达相似,Bmi-1和PTEN及E-Cadherin蛋白表达水平呈负相关(P < 0.05),而PTEN和E-Cadherin的表达无显著相关性。
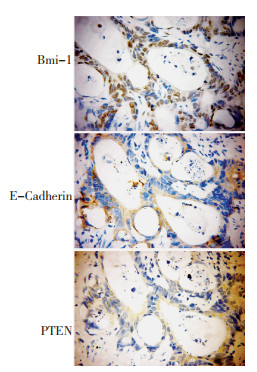
Bmi-1的表达主要位于细胞核内,在分化程度较低的癌组织中表达较强;E-Cadherin在分化程度较低的癌组织中呈弱表达或阴性;PTEN在同一癌组织中也呈弱表达或阴性表达(图 4)。
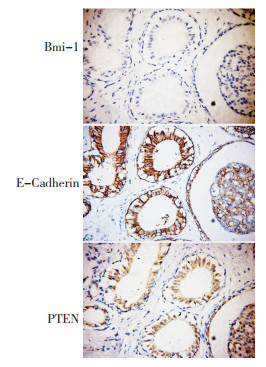
在分化程度较高的癌组织中,Bmi-1的表达较低;而E-Cadherin则呈高表达,且表达部位主要位于细胞膜;PTEN也呈强的核浆表达(图 5)。
3. 讨论
EMT机制的异常激活是很多上皮性肿瘤进展的重要步骤,EMT的调控基因或信号通路广泛参与肿瘤的形成及转移的过程[6]。E-Cadherin是维持细胞连接的重要分子,其表达下调是EMT以及肿瘤侵袭、转移的关键分子标志物。大量研究表明,E-Cadherin的表达丧失与肿瘤细胞的侵袭转移密切相关,在肿瘤浸润的前沿细胞中E-Cadherin表达比原位肿瘤内部细胞的表达降低更为明显,E-Cadherin外源性高表达于肿瘤细胞中可以抑制其增殖及侵袭能力,因此E-Cadherin往往被认为是一个抑癌基因[7]。转录抑制机制是E-Cadherin表达下调的一个关键程序,而几乎所有的EMT调控通路最后都归结于对E-Cad⁃ herin等粘附分子表达的调控[8]。
多梳基因(polycomb group genes,PcG)家族是果蝇发育时维持同源盒基因稳定表现的重要因子,具有高度保守性,在胚胎发育和肿瘤发生发展及干细胞更新的维持中起重要的作用[9-10]。癌基因Bmi-1是PcG家族的成员之一,在多种人类恶性肿瘤中表达上调,包括白血病、淋巴瘤、脑肿瘤、非小细胞肺癌、结肠癌、乳腺癌等,Bmi-1参与调控细胞增殖、凋亡、衰老以及干细胞自我更新,并且与多种肿瘤侵袭以及转移密切相关[11]。前期研究表明Bmi-1能诱导鼻咽上皮细胞发生EMT,并在肿瘤转移、侵袭过程扮演重要角色[5]。最近国外有研究报道,Bmi-1在结直肠癌组织表达上调,其表达水平与p16INK4a呈负相关,提示Bmi-1在结直肠癌发生发展中可能起重要作用[12]。本研究发现结直肠癌组织中Bmi-1的表达显著高于癌旁组织中的表达,且其表达水平在分化程度低的结直肠癌标本中明显高于分化程度低的标本,提示Bmi-1的表达异常可能参与结直肠癌的发生及进展过程。
E-Cadherin是EMT转变关键分子,下调肿瘤细胞E-Cadherin可使非侵袭性肿瘤转变为高侵袭性肿瘤。E-cadherin在多种肿瘤中表达下调,包括胃癌、肝癌、乳腺癌、前列腺癌、膀胱癌、食管癌等[13-14],在侵袭性结直肠癌组织中,E-cadherin整体表达水平下调,且其低表达与肿瘤转移呈正相关[13]。本研究发现在结直肠癌组织中,无论在转录水平还是蛋白水平,Bmi-1和E-Cadherin的表达均呈负相关,提示结直肠癌发生发展过程中,Bmi-1被激活可能是E-Cad⁃ herin表达下调的重要因素之一。
抑癌基因PTEN(phosphatase and tensin homolog deleted on chromosome 10)又名MMAC1(mutated in multiple advanced cancers),研究表明,在多种肿瘤中都存在PTEN基因杂合性缺失或突变,且突变种类达到上百种,这些突变导致PTEN功能失活或丧失[15]。然而,杂合性缺失和突变并非PTEN失活的唯一方式,翻译后水平的调控如磷酸化修饰在该基因的调控中亦起重要作用[16]。PTEN作为PI3K/AKT信号通路的负调控因子,可将PI(3,4,5)P3去磷酸化,发挥负调节作用,从而参与细胞周期调节、细胞增殖、凋亡以及细胞黏附。在结直肠癌中,PTEN的缺失与肝转移密切相关[17]。本研究结果显示,癌旁组织中PTEN的表达显著高于结直癌组织中的表达(P < 0.05),其表达水平在分化程度高的结直肠癌标本中表达较强,而在分化程度低的标本中表达较弱,提示PTEN的表达异常可能参与结直肠黏膜恶性转化过程。此外,前期研究已发现Bmi-1蛋白能够直接结合PTEN启动子并抑制其转录[5],而本研究发现Bmi-1与PTEN的在转录水平和蛋白水平均呈负相关,在组织水平证实了Bmi-1与PTEN之间的调控关系。
肿瘤的转移过程是多基因、多步骤参与的复杂过程,上游基因的改变可能是其下游基因改变的根本原因。E-Cadherin是一个重要的上皮分子标志物,E-Cadherin表达下调,有利于肿瘤的侵袭和转移;PTEN基因表达缺失通过抑制PI3K/AKT信号通路的活性使E-Cadherin的表达下调,进而促进肿瘤细胞侵袭转移,而Bmi-1基因可以直接结合PTEN的启动子抑制其转录。本研究在前期研究的基础上,从组织水平进一步证实了的Bmi-1、PTEN和E-Cadherin在EMT及肿瘤转移中相互调控关系。
-
-
[1] Mani SA, Yang J, Brooks M, et al. Mesenchyme Forkhead 1 (FOXC2) plays a key role in metastasis and is associated with aggressive basal-like breast cancers[J]. Proc Natl Acad Sci U S A, 2007, 104(24): 10069-10074. DOI: 10.1073/pnas.0703900104
[2] Micalizzi DS, Ford HL. Epithelial-mesenchymal transition in development and cancer[J]. Future Oncol, 2009, 5(8): 1129-1143. DOI: 10.2217/fon.09.94
[3] van Lohuizen M, Verbeek S, Scheijen B, et al. Identification of cooperating oncogenes in E mu-myc transgenic mice by provirus tagging[J]. Cell, 1991, 65(5): 737-752. DOI: 10.1016/0092-8674(91)90382-9
[4] Song LB, Zeng MS, Liao WT, et al. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells[J]. Cancer Res, 2006, 66(12): 6225-6232. DOI: 10.1158/0008-5472.CAN-06-0094
[5] Song LB, Li J, Liao WT, et al. The polycomb group protein Bmi-1 represses the tumor suppressor PTEN and induces epithelial-mesenchymal transition in human nasopharyngeal epithelial cells[J]. J Clin Invest, 2009, 119(12): 3626-3636. DOI: 10.1172/JCI39374
[6] Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer, 2002, 2(6): 442-454. DOI: 10.1038/nrc822
[7] Huber MA, Kraut N, Beug H. Molecular requirements for epithelial-mesenchymal transition during tumor progression[J]. Curr Opin Cell Biol, 2005, 17(5): 548-558. DOI: 10.1016/j.ceb.2005.08.001
[8] Batlle E, Sancho E, Franci C, et al. The transcription factor snail is a repressor of E-cadherin gene expression in epithelial tumour cells [J]. Nat Cell Biol, 2000, 2(2): 84-89. DOI: 10.1038/35000034
[9] Ringrose L, Paro R. Epigenetic regulation of cellular memory by the Polycomb and Trithorax group proteins[J]. Annu Rev Genet, 2004, 38: 413-443. DOI: 10.1146/annurev.genet.38.072902.091907
[10] Levine SS, King IF, Kingston RE. Division of labor in polycomb group repression[J]. Trends Biochem Sci, 2004, 29(9): 478-485. DOI: 10.1016/j.tibs.2004.07.007
[11] Jiang L, Li J, Song L. Bmi-1, stem cells and cancer[J]. Acta Biochim Biophys Sin (Shanghai), 2009, 41(7): 527-534. DOI: 10.1093/abbs/gmp040
[12] Kim JH, Yoon SY, Kim CN et al. The Bmi-1 oncoprotein is overexpressed in human colorectal cancer and correlates with the reduced p16INK4a/p14ARF proteins[J]. Cancer Lett, 2004, 203(2): 217-224. DOI: 10.1016/j.canlet.2003.07.009
[13] Tsanou E, Peschos D, Batistatou A, et al. The E-cadherin adhesion molecule and colorectal cancer. A global literature approach[J]. Anticancer Res, 2008, 28(6A): 3815-3826.
[14] Beavon IR. The E-cadherin-catenin complex in tumour metastasis: structure, function and regulation[J]. Eur J Cancer, 2000, 36(13 Spec No): 1607-1620.
[15] Li G, Robinson GW, Lesche R, et al. Conditional loss of PTEN leads to precocious development and neoplasia in the mammary gland[J]. Development, 2002, 129(17): 4159-4170. DOI: 10.1242/dev.129.17.4159
[16] Leslie NR, Downes CP. PTEN function: how normal cells control it and tumour cells lose it[J]. Biochem J, 2004, 382(Pt 1): 1-11.
[17] Sawai H, Yasuda A, Ochi N, et al. Loss of PTEN expression is associated with colorectal cancer liver metastasis and poor patient survival[J]. BMC Gastroenterol, 2008, 8: 56. DOI: 10.1186/1471-230X-8-56



 下载:
下载: