Effects of Lithium Chloride on the Proliferation of Human Endometrial Carcinoma Cell Line HEC-1A and Shh Expression
-
摘要:目的 研究Wnt、Shh在人子宫内膜癌细胞HEC-1A中的表达, 应用不同浓度糖原合成酶激酶-3的抑制剂氯化锂(LiCl)处理, 观察对人子宫内膜癌细胞HEC-1A体外增殖和Shh表达的影响。方法 体外培养人子宫内膜癌细胞HEC-1A, 不同浓度LiCl处理细胞6~48 h, 利用免疫细胞化学法测定HEC-1A细胞上Wnt、Shh表达; MTT比色法检测HEC-1A细胞增殖活性; RT-PCR检测核转录因子Gli-1的表达水平。结果 Wnt、Shh在HEC-1A细胞上有表达; 不同浓度LiCl处理后, Shh阳性细胞先出现增殖, 24 h时细胞量达到高峰, 随着时间延长, Shh细胞量减少, 高浓度LiCl组在48h时细胞减少最显著(P < 0.05);MTT检测细胞增殖结果显示LiCl对HEC-1A细胞的生长有抑制作用, 且呈浓度、时间依赖性。RT-PCR检测结果显示Gli-1基因的表达在24 h组水平最高, 与Shh的阳性细胞变化情况相符合。结论 Wnt信号可以调控Shh的表达, LiCl能抑制HEC-1A细胞的增殖, 并具有浓度、时间依赖趋势。Abstract:Objectives To study the expression of the wnt and sonic hedgehog homolog(Shh) proteins in the endometrial carcinoma cell line HEC-1A;and to study the growth of HEC-1A cells treated with lithium chloride, an inhibitor of glycogen synthase kinase-3.Methods The HEC-1A cells were cultivated in vitro.Immunofluorescence was used to determine the expression of wnt and Shh in the cells. 3-(4, 5 - Dimethylthiazol - 2 - yl) -2, 5-diphenyltetrazolium bromide(MTT) was used to investigate the proliferation of HEC-1A cells treated with different concentrations of lithium chloride.In addition, real-time polymerase chain reaction(RT - PCR) was used to determine the expression level of the nuclear transcription factor Gli-1 -Results Wnt and Shh were expressed in the HEC-1A cells.The amount of Shh initially increased, and then decreased.Lithium chloride inhibited the growth of HEC-1A cells in a concentration-dependent manner.The RT-PCR results showed that the highest expression level of Gli-1 was in the 24 h group, which corresponded to a change in the Shh level.Conclusion The wnt signaling pathway can regulate the Shh expression.Moreover, lithium chloride can inhibit the proli feration of HEC-1A cells in a concentration-time-dependent manner.
-
Keywords:
- Lithium chloride /
- Wnt /
- Shh /
- Endometrial carcinoma /
- Proliferation
-
子宫内膜癌(endomentrial carecuinonma)是女性最常见的生殖道恶性肿瘤之一, 在世界范围内其发病率和死亡率均有上升趋势。研究证实, 恶性肿瘤的发生发展是多基因、多步骤的复杂过程, 其中可能涉及不同的癌基因、抑癌基因、多种信号转导通路、细胞凋亡和增殖等。近年国内外研究表明, 一些与胚胎发育相关的信号通路如Wnt、Shh等与一些恶性肿瘤的发生发展有密切关系。Wnt首次被发现是从小鼠乳腺癌中克隆出, 不断有研究表明Wnt通过复杂的信号通路参与多种生物学效应, 包括调节细胞分化、增殖及生长等。Hedgehog信号通路在维持正常胚胎发育和成体组织形态学发生中具有重要作用。哺乳动物Hedgehog基因家族包括3个成员: Shh、Dhh和Ihh。大量的研究表明, 许多肿瘤均与Shh信号通路活性的改变有关, 如肺癌、肝癌、乳腺癌、大肠癌等均发现Shh信号通路的变化, 说明Shh信号通路在肿瘤的发生发展中发挥重要的作用。
本实验采用体外培养人子宫内膜癌细胞HEC-1A研究Wnt、Shh信号通路分子的表达, 应用糖原合成酶激酶-3的高选择性抑制剂氯化锂(LiCl)过表达Wnt信号, 观察对人子宫内膜癌细胞HEC-1A体外增殖和Shh表达的影响, 以期揭示Wnt、Shh和LiCl在子宫内膜癌细胞中的作用, 推断其与子宫内膜癌发生发展的关系, 为子宫内膜癌的临床治疗开辟新方向。
1. 材料与方法
1.1 材料
LiCl购自美国Sigma公司; 胎牛血清购自杭州四季青生物工程材料研究所; 改良型RPMI1640培养基购自塞默飞世尔生物化学制品有限公司; 免疫荧光试剂购自美国Sigma公司; MTT购自美国Amresco公司; RT-PCR试剂盒购自Fermentas公司。
1.2 方法
1.2.1 细胞培养
子宫内膜癌细胞HEC-1A在配有10%FBS、2 mmoL/L谷氨酰胺、100 U/mL青链霉素的改良型RPMI 1640培养液中培养, 置于37℃, 5%CO2饱和湿度的细胞培养箱中培养, 细胞铺满后可进行下一步实验。
1.2.2 细胞免疫荧光
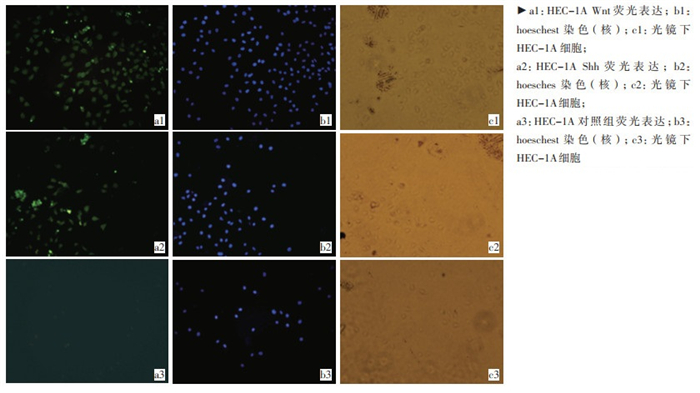
行常规细胞爬片; 捞片后用0.01 moL/L PBS清洗3次, 各3min; 4%多聚甲醛固定, 室温下孵育10~20 min; PBS清洗3次, 各3 min; 0.5%TritonX-100的PBS预透膜20 min; PBS清洗3次, 各3min; 含5%羊血清的封闭液孵育20~30min; 加入1%BSA稀释的一抗(抗山羊Wnt-2多克隆抗体, Santa Curz公司; 抗山羊Shh-2多克隆抗体, Santa Curz公司), 湿盒中4℃孵育过夜; PBS清洗3次, 各3 min; 加入1%BSA稀释的二抗(FITC标记的兔抗山羊二抗, 北京中杉京桥公司), 避光条件下室温孵育11h;PBS清洗3次, 各3 min; 5μg/mL Hoechst33342染色5 min; 注意避光, 抗淬灭缓冲甘油封片剂封片。对照组用PBS代替一抗, 其余步骤均相同。荧光倒置显微镜观察。
1.2.3 MTT检测细胞增殖检测
将细胞以2×104/mL的密度种在96孔板内; 细胞贴壁后各孔加入50μL不同浓度的LiCl溶液, 150μL新培养液; 该细胞增殖速度快, 48 h后即可达90%以上, 按6、12、24、48h处理; 每孔加入20μL, 5 mg/mL的MTT溶液培养4 h, 终止培养后, 小心吸去孔内培养液, 每孔加入200μL二甲基亚砜, 置摇床上低速振荡5 min, 使结晶物充分溶解。用酶联免疫检测仪OD490处测量各孔的OD值; 同时设置调零孔(培养基、MTT、二甲基亚砜), 对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜)。实验中设3个复孔, 重复3次。
1.2.4 RT-PCR检测
6孔板内细胞经不同浓度LiCl处理, 达到预定时间时, 收集各组细胞, 以每组细胞沉淀加入1 mL预冷的Trizol试剂提取总RNA, 按Fermentas两步法试剂盒提供的说明书进行RT-PCR操作。Gli-1上游引物为5'-AGAGAGAGGAGAAGCGT-GAGCCTGAATCT-3', 下游引物为5'-TCTCATTG-GAATGGGTCCGATTCTGGTGCT-3'。扩增程序为: 95℃首次变性3 min, 在下列条件下进行30个循环(95℃30s, 58℃30s, 72℃35s), 72℃10 min。PCR产物在1.2%琼脂糖凝胶上电泳, 5μg/mL, 溴化乙锭染色后用凝胶成像系统拍照。内参为β-actin。
1.3 统计学分析
采用Image-Pro Plus图像分析系统对免疫荧光阳性细胞进行测量分析; 采用SPSS 13.0统计软件分析数据, 实验数据以x±s表示, 统计方法采用方差分析、χ2检验等, P < 0.05为差异具有统计学意义。
2. 结果
2.1 Wnt、Shh在HEC-1A细胞培养过程中的表达
经免疫荧光化学染色, 发现Wnt和Shh在HEC-1A细胞培养过程均表达(图 1)。
2.2 IiCl对HEC-1 A细胞培养过程中Shh表达的影响
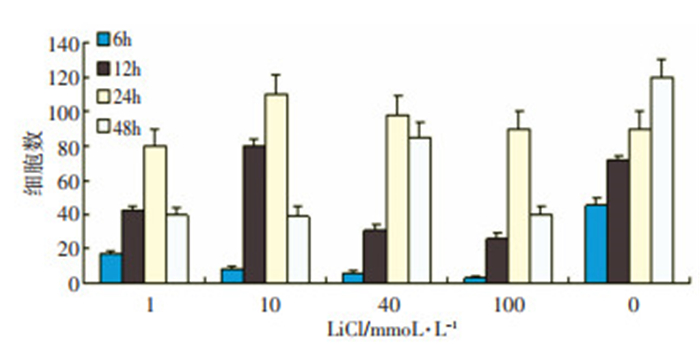
通过设置1、10、40、100 mmoL/L 4个IiCI实验组和1个空白对照组, 与HEC-1A细胞共培养48 h, 分别在6、12、24、48 h进行免疫荧光染色, 采用Image-Pro P1 us图像分析系统对免疫荧光阳性细胞进行测量分析。发现在相同LiCl浓度组内Shh的表达先呈增多趋势, 至24 h时表达量达高峰, 随着培养时间的延长, Shh阳性细胞量逐渐减少; 在相同时间组内, 6、12、48 h实验组Shh阳性细胞量与空白对照组比较, 差异有统计学意义(P < 0.05), 提示IiCl抑制Shh细胞的表达, 并具有浓度、时间依赖趋势。(表 1, 图 2)。
表 1 不同浓度LiCl处理后Shh阳性细胞的数量x±sTable 1. The number of Shh positive cells after treatment with different concentrations of LiCl
2.3 LiCl对HEC-1A细胞增殖的影响
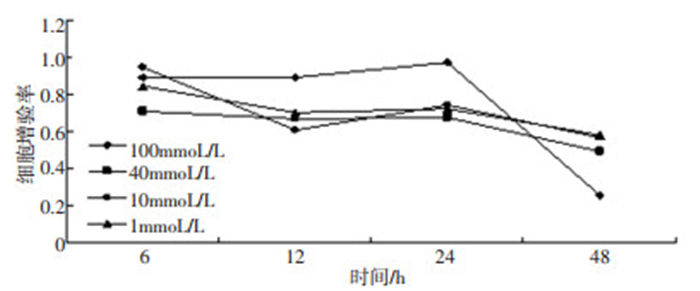
HEC-1A细胞分别与不同浓度的LiCl(1、10、40、100 mmoL/L)共培养48 h, MTT检测6、12、24、48 h OD值(细胞增殖率=实验组OD值均值/相对应对照组OD值均值), 结果显示各个实验组的OD值均低于空白对照组, LiCl对HEC-1A细胞具有生长抑制作用, 差异有统计学意义(P < 0.05, 表 2, 图 3)。
表 2 不同浓度LiCl处理组OD值比较x±sTable 2. Comparison of OD among the different treatment groups
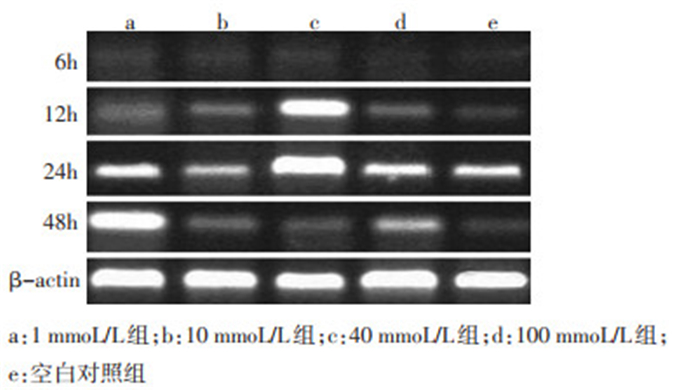
2.4 不同浓度LiCl处理HEC-1 A细胞后Gli-1的表达
采用RT-PCR方法, Gli-1的特异性引物扩增HEC-1 A细胞的cDNA。结果检测出各浓度LiCl处理后的细胞中均见Gli-1 (扩增长度416 bp)的表达(β-actin扩增长度129 bp)。(图 4)。
3. 讨论
子宫内膜癌是发生于子宫内膜的一组上皮性恶性肿瘤, 是最常见的女性生殖道恶性肿瘤之一, 在我国城市, 其死亡率呈逐年增长趋势, 已严重威胁女性的生命健康[1]。其发病机制尚不清楚, 但肿瘤细胞的增殖和凋亡异常是导致肿瘤发生的重要原因, 一些重要的信号转导通路对肿瘤细胞的作用研究已成为现今肿瘤学的热点。
Wnt信号转导通路是一条在进化上十分保守的信号途经, 是由一系列癌基因和抑癌基因编码的复杂的蛋白质作用网络, 在胚胎发育和肿瘤的发生发展过程中起关键性作用, 可调控细胞的生长、分化和增殖等[2]。大量研究表明, ,Wnt途经的异常参与人类多种肿瘤的发病过程, 而与肿瘤发生发展关系密切的是经典Wnt信号转导途经。经典Wnt信号转导途经是一个多环节、多作用位点的生长发育调控通路, 其所涉及的成员为Wnt蛋白、卷曲蛋白(frizzled protein, FZ)、E-钙黏蛋白(E-cadherin)、β连环蛋白(β-catenin)、散乱蛋白(Dishevelled, Dsh)、APC复合物(包括APC蛋白、GSK-3和Axin蛋白)等[3]。β-catenin是经典Wnt通路的关键调控因子。目前研究认为, β-catenin降解障碍是Wnt信号通路致瘤的关键因素, 胞浆内的游离型β-catenin聚集增多, 与转录因子家族TCF/LEF结合后进入胞核, 可激活下游靶基因CyclinD1、c-myc的转录导致肿瘤的发生。有研究[4]证明在乳腺癌组织中有异常Wnt通路, 并指出β-catenin的异常表达也促使了乳腺癌的发生和发展, 并证实CK1ε在肿瘤中对激活的β-catenin通路起到了一个关键的作用; 在肝癌标本中β-catenin的表达程度与患者淋巴结转移及肝内转移呈正相关, 而转移和侵袭是肝细胞癌的基本特征, 与经典Wnt途经密切相关。有研究者利用siRNA载体介导的RNA干扰技术靶向沉默β-catenin以阻断经典Wnt信号通路, 观察子宫内膜异位症裸鼠模型中异位子宫内膜组织因子的表达情况, 发现阻断经典Wnt通路后, 异位内膜组织因子表达明显受抑制, 表明Wnt/β-catenin通路可能促进子宫内膜的异位种植[5]。
糖原合成酶激酶-3(GSK-3)是Wnt信号通路中的关键性负性调节酶, 其通过促进β-catenin降解而抑制Wnt信号通路的激活。而锂作为人体非必需微量元素, 是GSK-3的非竞争性抑制剂。以往研究[6]发现LiCl可以抑制蛋白酶体活性, 而Wnt、Shh信号转导通路中的蛋白质通过泛素-蛋白酶体途经降解, 蛋白降解障碍与许多肿瘤的发生有关, 进一步研究证实[7, 8], LiCl可抑制多种肿瘤细胞的增殖, 而这种抑制作用可降低恶性肿瘤发生的风险, 并且这种增殖抑制作用呈剂量依赖关系。有研究[9]表明LiCl可以在体外诱导细胞凋亡, 抑制良性肿瘤细胞生长。本实验通过利用LiCl作用HEC-1A细胞后, 结果发现24 h内LiCl可刺激细胞的增殖, 随着培养时间的延长, 高浓度LiCl组细胞大量减少, 48h时细胞减少最显著, 与空白对照组相比, 差异有统计学意义(P < 0.05), 这与以往研究相一致, 因此可以表明LiCl能抑制子宫内膜癌细胞的增殖, 并且抑制作用具有时间、浓度依赖性。
Shh信号通路在胚胎发育中的细胞生长分化、组织器官形成及成体干细胞的维持等方面具有重要的作用, Shh信号通路与Wnt信号通路的相互作用及相互联系在胚胎发育及成体的生物学作用中已被证实。有研究[10]利用全基因组芯片检测及RT-PCR方法对宫颈癌、癌旁组织及正常宫颈组织中的Wit、Shh信号通路及关键基因进行分析, 发现Wny及Shh信号通路在癌组织及癌旁组织中激活, 两者的信号交互在宫颈癌发生发展中起着重要作用[10]。Gli-1作为转录因子, 在Shh通路下游中发挥了承上启下的作用, Gli-1的激活会使Shh信号通路持续激活, 最终可能导致各种发育缺陷和肿瘤, 但在成人的基因中却很少表达, 其异常表达可进一步激活如Bcl-2等致癌基因, 从而引发癌症[11]。Yu等[12]研究表明在正常子宫内膜组织中Shh、Gli-1的表达很弱, 但在子宫内膜癌中表达却显著增强, 进一步利用子宫内膜癌细胞HHUA过表达Shh, 可使细胞增殖增强41%, 而利用siRNA干扰Gli-1后, 细胞生长受到明显抑制。这表明Shh信号通路在子宫内膜癌细胞生长中具有重要的作用, 而Shh通路的异常激活可能会引起子宫内膜癌细胞的增殖, 揭示Shh将会是研究治疗子宫内膜癌的新的分子靶标。
本研究中RT-PCR结果显示Gli-1在HEC-1A细胞中有弱表达, 在24 h组表达最强; 同时也证明Shh在子宫内膜癌细胞中有表达。利用LiCl干预HEC-1A细胞后, 发现在细胞培养早期, LiCl激活Wnt信号通路可以诱导Shh阳性细胞表达减少; 而随着时间的延长, 高浓度IiCl可以刺激细胞的增殖, 同时使Shh表达增加, 但到48h时, 细胞迅速减少, Shh表达显著减少, 表明LiCl对HEC-1A细胞增殖具有抑制作用, Shh在HEC-1A细胞中亦具有重要的作用, 不同浓度LiCl可以引起Shh的变化, 而这一变化受时间和浓度的影响。其意义和分子机制尚不清楚, 但可以肯定的是Wnt、Shh和LiCl与子宫内膜癌的发生发展有重要的关系, 这有望成为子宫内膜癌治疗的新方向。
-
表 1 不同浓度LiCl处理后Shh阳性细胞的数量x±s
Table 1 The number of Shh positive cells after treatment with different concentrations of LiCl

表 2 不同浓度LiCl处理组OD值比较x±s
Table 2 Comparison of OD among the different treatment groups

-
[1] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008[J]. CA Cancer J Clin, 2008, 58(2): 71-96. DOI: 10.3322/CA.2007.0010
[2] Midori K, Junichiro F, Mitsuo N. Polyethylenimine-cationizedβ—catenin protein transduction activates the Wnt canonical signaling pathway more effectively than cationic lipid—based transduction[J]. Biotechnol J, 2010, 5(4): 454-465. http://so.med.wanfangdata.com.cn/ViewHTML/PeriodicalPaper_JJ0215608600.aspx
[3] Zeng X, Huang H, Tamai K, ct al. Initiation of Wnt signaling: control of Wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions[J]. Development, 2008, 135(2): 367-375. DOI: 10.1242/dev.013540
[4] Kim S Y. Dunn I F, Firestein R, et al. CK1epsilon is required for breast cancers dependent on beta—catenin activity[J]. PLos One, 2010, 5(2): c8979. DOI: 10.1371/journal.pone.0008979
[5] 郑婷婷, 刘义, 于岚. 等. 靶向siRNA阻断Wnt/β-catein信号通路对子宫内膜异位症裸鼠模型异位子宫内膜VEGF和MMP-9表达的影响[J]. 华中科技大学学报, 2011, 40(1): 22-27. https://www.cnki.com.cn/Article/CJFDTOTAL-TJYX201101005.htm [6] Waaler J, Machon O, Tumova L, et al. A. novel tankyrase inhibitor decreases canonical Wnt signaling in colon carcinoma cells and reduces tumor growth in conditional APC mutant mice[J]. Cancer Res, 2012, 5(22): 121-126. http://www.ncbi.nlm.nih.gov/pubmed/22440753
[7] 李辉, 张开基, 李万成. 氯化锂对A549肺细胞增殖及核因子-κB p65表达的影响[J]. 当代医学. 2010, 16(24): 17-18. [8] Ronchi A, Salaroli R, Rivetti S, et al. Lithium induces mortality in medulloblastoma cell lines[J]. Int J Oncol, 2010, 37(3): 745-752.
[9] Greeublatt DY, Ndiave M, Chen H. et al. Lithium inhibits carcinoid cell growth in vitro[J]. Am J Transl Res, 2010, 2(3): 248-253. http://europepmc.org/articles/PMC2892410/pdf/ajtr0002-0248.pdf
[10] 张甦, 邢建明, 钱(王争), 等. Hedgehog及Wnt信号通路交互作用与宫颈癌发生的关系[J]. 现代实用医学, 2009, 21(1): 16-20. https://www.cnki.com.cn/Article/CJFDTOTAL-NBYX200901009.htm [11] Olivier NS, Janet L, Morgan L, et al. GLI is regulated through Smoothened independent mechanisms in neoplastic pancreatic ducts and mediates PDAC cell survival and transformation[J]. Genes Dev, 2009, 23(1): 24. DOI: 10.1101/gad.1753809
[12] Yu Z. F, Tanri S, Tsucomu M, et al. Overexpression of Hedgehog Signaling Molecules and Its involvement in the Proliferation of Endometrial Carcinoma Cells[J]. Clin Cancer Res, 2007, 13(5): 1389-1398. DOI: 10.1158/1078-0432.CCR-06-1407



 下载:
下载: