Effects of Propranolol on Mouse Hemangioendothelioma Endothelial Cell Proliferation and Apoptosis
-
摘要:目的 通过β受体阻滞剂普萘洛尔作用于小鼠EOMA血管瘤细胞体外增殖及凋亡的实验研究, 初步探讨普萘洛尔治疗血管瘤的机制。方法 体外培养EOMA细胞, 使用不同浓度普萘洛尔分别作用于EOMA细胞24、36、48 h, 应用噻唑蓝(MTT)法检测细胞存活率、吖啶橙染色检测细胞凋亡情况, 观察普萘洛尔对EOMA细胞体外增殖和凋亡的影响。结果 作用24 h后, 随剂量增加, EOMA细胞存活率逐渐下降, 与对照组相比, 至药物浓度为75μmol/L时有显著差异(P < 0.05), 继续增加至800μmol/L时, 细胞存活率接近0, 同时吖啶橙染色示凋亡细胞逐渐增多, 与对照组相比, 至药物浓度75μmol/L时, 细胞凋亡率有显著差异(P < 0.05)。36 h组和48 h组变化趋势与24h组相似。结论 普萘洛尔在体外可有效抑制小鼠EOMA血管瘤细胞的增殖并促进其凋亡, 这一作用呈现明显的剂量-时间效应依赖性。Abstract:Objective To explore the primary mechanism ofpropranolol treatment on hemangioma.Methods Mouse hemangioendothelioma endothelial (EOMA) cells cultured in vitro were used as the cell models in our study. Cells were treated using propranolol at different concentrations (5 μmol/L to 800 μmol/L) for 24 h to 48 h. Cell proliferation was analyzed by MTT assay, and apoptosis was studied by acridine orange (AO) staining.Results After 24 h to 48 h treatment, significant differences of cell viability and apoptosis were noted (P < 0.05) at the concentration of 75 μmol/L compared with the control group (0 μmol/L). When the dose was increased, cell viability dropped, whereas apoptosis dramatically increased.Conclusion Propranolol can effectively inhibit the proliferation and induce the EOMA cell apoptosis in vitro.
-
Keywords:
- Hemangioma /
- EOMA cell /
- Propranolol /
- Proliferation /
- Apoptosis
-
最近法国Bordeaux儿童医院Léauté-Labrèze等[1]在美国《新英格兰医学杂志》报道应用普萘洛尔(propranolol)治疗婴儿血管瘤的重大发现。首例患儿为阻塞性、肥厚性心肌病合并严重鼻腔血管瘤,应用普萘洛尔治疗后,意外发现患者面部的血管瘤逐渐减小,最后几近完全消失。为初步探讨普萘洛尔治疗血管瘤机理,本研究采用MTT法检测细胞存活率,采用吖啶橙染色法检测细胞凋亡率。
1. 材料与方法
1.1 材料
普萘洛尔(propranolol P0884)购自Sigma公司。吖啶橙(AO)购自美国Amersco公司。胰酶和DMEM/F12培养基购于Gibco公司。
1.2 细胞培养方法
小鼠EOMA血管瘤细胞由重庆医科大学金先庆教授惠赠,用含10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的DMEM/F12(Gibco公司)培养基,在5% CO2,37 ℃恒温培养箱中培养,取对数生长期细胞进行实验。
1.3 MTT法检测细胞增殖/存活率
将1.0×105个/mL EOMA细胞接种于96孔板中,培养24 h后加入不同浓度普萘洛尔PBS溶液:5、15、25、50、75、100、200、400和800 μmol/L,作用时间分别为24、36、48 h。单纯PBS处理作为溶剂对照组。处理结束时,每孔加入5 mg/mL MTT溶液,5%CO2、37 ℃继续孵育4 h,弃上清液,每孔加入150μLDMSO,酶标仪(Therom)测定A570及A630值。
1.4 吖啶橙(AO)染色荧光显微观察细胞凋亡
于6孔板中接种1.0×105个/mL EOMA细胞,培养24 h后,分别加入浓度为0、75、400、800 μmol/L普萘洛尔溶液,作用24 h和48 h。弃上清液,加入l mL AO染液(PBS配制),室温避光染色1 min,弃染液,PBS洗涤3次,荧光显微镜下观察、计数。
1.5 统计学分析
所有实验重复3次,计数资料采用率进行描述。对率进行平方根反正弦变换后,用重复测量资料的方差分析法比较不同浓度不同时间点普萘洛尔的效应差异。以P <0.05为有统计学意义。数据录入采用excel2007,统计分析采用SPSS14.0软件。
2. 结果
2.1 MTT检测EOMA细胞增殖/存活率
MTT实验观察不同剂量普萘洛尔作用不同时间对EOMA细胞存活率的影响。普萘洛尔作用24 h后,随剂量增加,EOMA细胞存活率逐渐下降,与对照组相比至药物浓度为75 μ mol/L时细胞存活率为(70.23±4.05)%,有显著性差异(P <0.05),继续增加至800 μmol/L时,细胞存活率接近0,36 h组和48 h组变化趋势与24 h组相似(表 1)。
表 1 Propranolol对EOMA细胞存活率(%)Table 1. Effects of propranolol on cell viability in EOMA cells(%)
2.2 普萘洛尔诱导EOMA细胞凋亡的AO染色结果
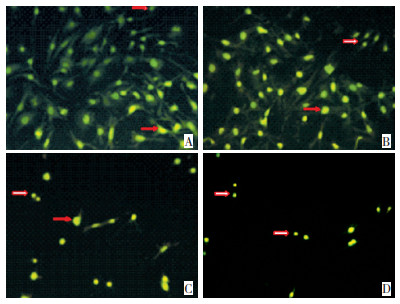
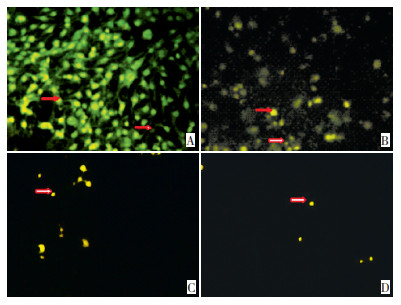
普萘洛尔作用细胞后,经AO染色,荧光照微镜下观察可见EOMA细胞数量明显减少,且细胞体积缩小、细胞核固缩,可见浓缩致密的暗绿色或黄绿色荧光,呈团状或串珠状,对照组为均匀一致的绿色荧光。75 μmol/L普萘洛尔作用细胞24 h后(图 1),细胞开始有明显变化,400、800 μmol/L时,细胞数量明显减少,体积缩小、核固缩明显,荧光减弱。75 μmol/L普萘洛尔作用细胞48 h后,细胞数量减少,荧光较弱,高浓度400和800 μmol/L时,细胞数量明显减少(图 2)。
普萘洛尔作用24 h时,从75 μmol/L组开始与对照组(0 μmol/L)相比有统计学差异(P < 0.05),随浓度增加细胞存活率逐渐下降。36 h和48 h趋势相似(表 2)。
表 2 普萘洛尔诱导EOMA细胞的凋亡率(%)Table 2. Effects of propranolol on induction of apoptosis in EOMA cells (%)
3. 讨论
普萘洛尔是常用的心血管药物,属β受体阻滞剂。β受体阻滞剂可与β受体相结合,干扰肾上腺素能神经递质或者拟肾上腺素β型作用。根据其对β受体的不同选择性,这些阻滞剂通常分为:1)非选择性β受体阻滞剂,如普萘洛尔;2)选择性β受体阻滞剂,如美托洛尔、阿替洛尔;3)兼有α1受体阻滞剂作用的β受体阻滞剂,如卡维地洛。β受体阻滞剂能抑制交感神经活性,有降低血压、抗心肌梗塞、抗心律失常、抑制心肌重塑的作用。因此,β受体阻滞剂常用于包括高血压、冠心病、心力衰竭等常见心血管疾病的治疗,是一种经典的心血管药物[2]。
近期,法国Léauté-Labrèze等[1]报道了普萘洛尔治疗血管瘤的新作用后,其作用机理再次引起同行们关注。广义的“血管瘤”指一大类疾病,是儿童时期最常见的“肿瘤”,主要包括血管瘤(真性)及血管畸形两大类[3],目前普萘洛尔治疗报道多集中于血管瘤(真性)[4-6],其与血管畸形的区别主要在于血管内皮细胞等的增殖状态,前者常有异常增殖,而后者增殖状态往往正常。这一区别提示普萘洛尔治疗血管瘤可能与细胞的增殖有关。
EOMA瘤是129P3/J小鼠来源的血管瘤[7],主要由异常增殖的血管内皮细胞构成瘤体,伴不同程度的管腔化,是目前常用的血管瘤实验动物及细胞培养模型。在本文研究中,数据显示普萘洛尔处理组细胞增殖状况明显低于对照组,同时细胞凋亡明显增加,提示普萘洛尔具有抑制EOMA细胞体外增殖,诱导其凋亡的作用。从实验数据看,这一作用呈明显的剂量-效应依赖性,作用24~48 h,中、低剂量组时间-效应依赖性不明显,高剂量组呈现一定的时间-效应依赖性。这一结果显示,普萘洛尔治疗血管瘤可能与其抑制血管内皮细胞的增殖,促进细胞凋亡有关。
近年,另有一些研究发现普萘洛尔能抑制胰腺癌、乳腺癌等肿瘤细胞的体外增殖,诱导其凋亡[8-9],这些作用的机制和普萘洛尔对血管内皮细胞作用的机制是否相同或相似,普萘洛尔在肿瘤治疗领域的应用尚有待进一步研究。
-
表 1 Propranolol对EOMA细胞存活率(%)
Table 1 Effects of propranolol on cell viability in EOMA cells(%)

表 2 普萘洛尔诱导EOMA细胞的凋亡率(%)
Table 2 Effects of propranolol on induction of apoptosis in EOMA cells (%)

-
[1] Léauté-Labrèze C, Dumas de la Roque E, Hubiche T, et aL Propanolol for severe hemangiomas of infancy[J]. N EngI J Med, 2008, 358 (24): 2649-2651. DOI: 10.1056/NEJMc0708819
[2] 施仲伟. β受体阻滞剂的临床应用价值[J]. 心血管病学进展, 2011, 32 (1): 9-12 DOI: 10.3969/j.issn.1004-3934.2011.01.004 [3] Webber EC, Rescorla FJ. Hemopneumothorax caused by vascularized bullae and a pulmonary hemangioma in an adolescent boy[J]. J Pediatr Surg. 2012, 47(4): e23-5. DOI: 10.1016/j.jpedsurg.2011.11.072
[4] Talaat AA, Elbasiouny MS, Elgendy DS, et al. Propranolol treatment of infantile hemangioma: clinical and radiologic evaluations[J]. J Pediatr Surg. 2012, 7(4): 707-714.
[5] Hsu TC, Wang JD, Chen CH, et al. Treatment with propranolol for infantile hemangioma in 13 Taiwanese newborns and young infants[J]. Pediatr Neonatol. 2012, 53(2): 125-132. DOI: 10.1016/j.pedneo.2012.01.010
[6] Gelmetti C, Frasin A, Restano L. Innovative therapeutics in pediatric dermatology[J]. Dermatol Clin. 2010, 28(3): 619-629. DOI: 10.1016/j.det.2010.03.005
[7] 许振起, 刘宇, 王依祥, 等. Avastin治疗小鼠血管内皮瘤的实验研究[J]. 北京大学学报(医学版), 2009, 41(1): 111-114. https://www.cnki.com.cn/Article/CJFDTOTAL-BYDB200901030.htm [8] 张东, 马清涌, 沙焕臣, 等, 肾上腺素能受体阻断剂诱导胰腺癌细胞株PC2凋亡的实验研究[J]. 西安交通大学学报(医学版), 2010, 31 (3): 269-273. https://www.cnki.com.cn/Article/CJFDTOTAL-XAYX201003004.htm [9] Barron TI, Connolly RM, Sharp L, et al. Beta blockers and breast cancer mortality: a populationbased study[J]. J Clin Oncol, 2011, 29(19): 2635-2644. DOI: 10.1200/JCO.2010.33.5422



 下载:
下载: