Inhibition of Livin Expression on Colon Cancer Line HT-29 Cells by Lentiviral Vector-Mediated RNA Interference and Its Impact on Biological Behaviors
-
摘要:目的 探讨慢病毒载体介导RNA干扰(RNAi)抑制大肠癌细胞系HT-29细胞Livin基因表达对其生物学行为的影响。方法 设计、合成靶向Livin的siRNA, 构建pGCSIL-GFP慢病毒载体, 采用Real-time PCR和Western blot方法观察对人大肠癌HT-29细胞Livin mRNA及蛋白质表达的抑制; 并通过台盼蓝拒染法、原位末端标记法(TUNEL)、流式细胞术及Matrigel穿膜侵袭实验检测细胞增殖、凋亡、细胞周期及细胞侵袭性的变化。结果 重组慢病毒Livin-RNAi-LV1能够有效抑制Livin的表达, 使Livin mRNA和蛋白表达水平明显降低(P < 0.01);Livin沉默能抑制HT-29细胞增殖(P < 0.05), 细胞凋亡增加(P < 0.01), 细胞周期重新分布, G0/G1期细胞比例升高(P < 0.05), S期细胞比例降低(P < 0.05), G2/M期细胞比例降低(P < 0.05) HT-29细胞体外侵袭能力也明显减弱(P < 0.01)。结论 利用慢病毒载体介导RNA干扰技术沉默Livin基因的表达可以抑制大肠癌HT-29细胞增殖, 促进细胞凋亡, 使细胞侵袭性减弱。Abstract:Objective To investigate the inhibition of Livin expression on colon cancer cell line HT-29 by lentiviral vector-mediated RNA interference (RNAi) and its impact on biological behaviors.Method Small-interference RNA (siRNA) molecules that target Livin gene were designed, and a pGCSIL-GFP lentiviral vector was created. The inhibitory expression of Livin was detected using Real-time PCR and Western blot. Trypan blue staining was used to detect changes in proliferation. In situ end labeling (TUNEL) and flow cytometry were used to detect changes in apoptosis and cell cycle distribution, respectively. Matrigel invasion assay was used to detect changes in cell invasion ability.Results Recombinant lentiviral Livin-RNAi-LV1 can efficiently inhibit Livin expression in mRNA and protein level (P < 0.01). Reduced Livin expression can inhibit cell proliferation (P < 0.05), promote cell apoptosis (P < 0.01), and re-distribute the cell cycle, leading to increased proportion of G0/G1 phase cells (P < 0.05) and reduced S phase cells (P < 0.05) and G2/M phase cells < 0.05). In vitro invasive ability was significantly damaged (P < 0.01).Conclusion The inhibition of Livin expression on HT-29 cell by Lentiviral vector-mediated RNA interference can inhibit proliferation, promote apoptosis, and reduce cell invasiveness; thus, it deserves further study.
-
Keywords:
- Lentiviral vector /
- RNA interference /
- Livin /
- Colorectal cancer /
- Apoptosis
-
Livin是凋亡抑制蛋白(inhibitors of apoptosis proteins,IAPs)家族中的新成员,又称ML-IAP/KIAP,特异性表达于人的胚胎组织、胎盘组织以及部分恶性肿瘤细胞,具有较强的抗凋亡能力[1]。多项研究证实Livin可能作为诱导肿瘤细胞凋亡的分子靶点,如利用RNA干扰技术分别在非小细胞肺癌、宫颈癌、肾癌等多种肿瘤中构建Livin特异的基因沉默体系阻断肿瘤细胞Livin基因表达,均增强了肿瘤细胞对凋亡诱导剂的敏感性[2-4]。本课题前期研究也发现Livin在Dukes'B期结直肠癌组织中高表达,并且其表达与肿瘤复发和/或转移、总生存不佳有关[5]。因此,本研究构建介导RNAi的重组慢病毒载体,在细胞系中稳定抑制Livin基因的表达,并进一步观察Livin基因抑制后大肠癌HT-29细胞生物学特性的改变。
1. 材料与方法
1.1 材料
1.1.1 细胞与试剂
人大肠癌HT-29细胞株购自上海中国科学院典型培养物保藏委员会细胞库,逆转录试剂盒Revert AidTMFirst Strand cDNA Synthesis Kit购自Fermentas公司,羊抗人Livin单克隆抗体购自美国Abcam公司,TUNEL原位检测试剂盒购自南京凯基生物公司,Matrigel基质胶购自BD公司。
1.1.2 RNAi重组慢病毒载体
根据GeneBank获得Livin转录本(NM_13931717.1),设计3个针对Livin基因的siRNA序列和阴性对照(negative control)siRNA,构建的目的慢病毒载体命名为pGCSIL-GFP;框架结构为U6-vshRNA-CMV-GFP(表 1),由上海吉凯基因化学技术有限公司构建及包装,慢病毒浓度为1×108TU/mL。
表 1 目的基因病毒载体构建框架Table 1. Designed sequences of siRNA and framework of lentiviral vector
1.2 方法
1.2.1 病毒感染
常规培养HT-29细胞,实验分5组,分别为空白对照组、阴性对照组及Liv⁃ in-RNAi-LV1、Livin-RNAi-LV2、Livin-RNAi-LV3组。
1.2.2 Real-time PCR检测病毒感染后Livin mRNA的表达
Livin引物序列上游引物为5'-GCTGGGCATATT CTGAGATTGG-3,下游引物为5'-CAGGCACTTGGCACT GTCTTTA-3';内参序列GAPDH上游引物为5'-TGCAC CACCAACTGCT TAGC-3',下游引物为5'-GGCATGGA CTGTGGTCATGAG-3',病毒感染96 h后收集细胞,按Trizol试剂说明书抽提各组总RNA,参照Fermentas公司的逆转录试剂盒说明书合成cDNA。采用SYBR Green Ⅰ法进行Real-time PCR扩增反应,最后行融解曲线分析。测定Ct值表示目的基因mRNA的表达量,2-ΔΔCt法计算mRNA的相对表达量,分析定量结果。
1.2.3 Western blot检测病毒感染后Livin蛋白的表达
病毒感染后96 h收集细胞,加入细胞裂解液提取总蛋白,经SDS-聚丙烯酰胺凝胶电泳分离蛋白,用电转法将蛋白转置硝酸纤维素膜上,依次加入封闭液、一抗、二抗进行免疫杂交,再经ECL化学发光试剂盒检测杂交信号,X光片压片曝光,将胶片进行扫描或拍照,用Quantity-one 4.6.2软件进行分析。
1.2.4 台盼蓝拒染法检测细胞增殖活力
病毒感染24 h后1、2、3、4、5、6、7 d收获细胞,每次各组取3孔细胞,台盼蓝染色,计数各孔活细胞数,取平均值,连续计数7 d。根据计数结果,绘制细胞生长曲线。
1.2.5 TUNEL检测细胞凋亡的情况
参考TUNNRL试剂盒进行实验,最后在显微镜下观察显色反应,阳性细胞胞核染成深棕色或棕褐色,随机计数5个高倍视野(×400),计算凋亡指数(AI)=凋亡细胞数(/ 凋亡细胞数+正常细胞数)×100%。
1.2.6 流式细胞术检测细胞周期及细胞凋亡
病毒感染72 h后收集细胞,调整细胞浓度约为1×106/mL,70%乙醇固定,碘化丙酊(PI)室温避光染色30 min。利用流式细胞仪检测细胞内DNA含量,获得各期细胞比例及细胞凋亡率。
1.2.7 Matrigel穿膜侵袭实验检测细胞侵袭能力
100 μL Matrigel铺于Transwell侵袭小室聚碳酯微孔膜(孔径8 μm)的上表面,无血清培养基制备单细胞悬液,细胞密度为5×105个/mL。上室内加入100 μL细胞悬液,下室加入含10%FBS的完全培养基。恒温孵箱中培养48 h后,显微镜下计算穿过膜至背面的细胞数,侵袭率=实验组穿膜细胞数/对照组穿膜细胞数×100%。
1.3 统计学分析
所有数据用统计学软件SPSS 12.0进行分析,计量资料用x±s描述,采用单因素方差分析进行显著性检验,P <0.05为差异具有统计学意义。
2. 结果
2.1 重组慢病毒感染HT-29细胞的效率
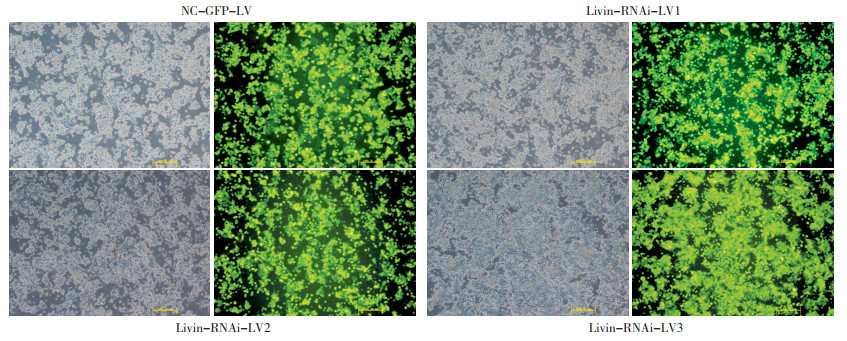
病毒感染3~4 d后,倒置荧光显微镜下根据携带绿色荧光细胞数占细胞总数的百分比,计算感染效率均>70%(图 1)。
2.2 Real-time PCR和Western blot检测分析
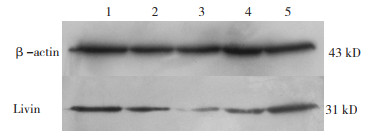
Real-time PCR结果显示Livin-RNAi-LV1组和Livin-RNAi-LV2组Livin mRNA的表达下调,下调分别为0.34±0.10和0.68±0.14,与阴性对照组和空白对照组相比有显著性差异(P <0.01,图 2,表 2)。West⁃ ern blot结果如下(图 3):与空白对照组和阴性对照组相比,实验组Livin-RNAi-LV1和Livin-RNAi-LV2感染的HT-29细胞的Livin蛋白表达均有下降,差异有统计学意义(P <0.05),而其中Livin-RNAi-LV1的抑制效果较好(P <0.01),这与Real-time PCR的结果基本相符。因此采用Livin-RNAi-LV1进行后续实验。
表 2 各组HT-29细胞Livin mRNA的相对表达水平Table 2. Relative expression of Livin mRNA in each group
2.3 细胞生长曲线
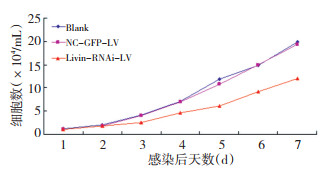
实验组从第3天开始细胞生长较对照组明显减慢(P <0.05),到第7天时细胞生长抑制率达到了39.5%,与空白对照组及阴性对照组相比差异均具有统计学意义(P <0.05)。而阴性对照组较空白对照组无显著性差异(P>0.05),说明空载慢病毒对于HT-29细胞的生长无明显影响(图 3)。
2.4 TUNEL检测细胞凋亡的情况
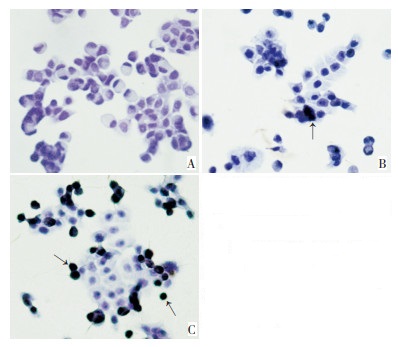
显微镜下可见实验组Livin-RNAi-LV1感染后HT-29细胞中有细胞核被染成棕黄色或棕褐色的凋亡细胞,而对照组偶见凋亡细胞(图 4)。实验组凋亡指数为(26.47±1.80)%,与空白对照组和阴性对照组相比差异有统计学意义(P <0.01,表 3)。
表 3 重组慢病毒感染后HT-29细胞凋亡指数Table 3. Apoptosis index in each group
2.5 流式细胞术(FCM)检测细胞周期及细胞凋亡
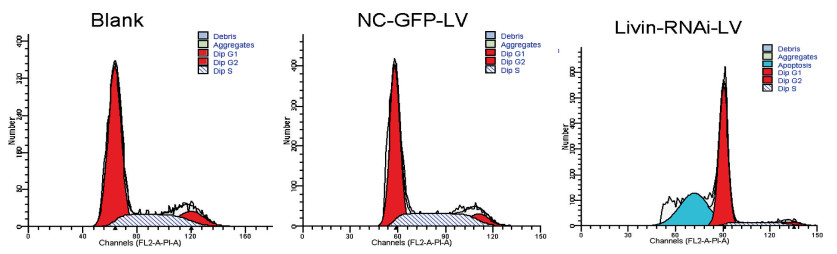
实验组细胞出现了明显的凋亡现象,可见典型的“亚二倍体凋亡峰”,凋亡率为38.43%,而空白对照组和阴性对照组细胞均未见明显凋亡现象(图 5)。同时,实验组细胞周期分布发生了明显的改变,G0/G1期细胞比例升高,S期细胞比例降低,G2/M期细胞比例降低,提示Livin基因沉默可使细胞周期重新分布,产生G0/G1期阻滞,降低S期和G2期细胞比例(表 4)。
表 4 流式细胞术检测重组慢病毒感染对细胞周期的影响%(x±s) Table 4. Cell cycle in each group by flow cytometry
2.6 Matrigel穿膜侵袭分析
显微镜下可见实验组Livin-RNAi-LV1感染后HT-29细胞穿膜细胞数为102.33±13.01,少于空白对照组(532.67±32.93,P <0.01)和阴性对照组(511.00± 21.07,P <0.01)(表 5)。
表 5 各组细胞体外侵袭能力Table 5. Difference in cell invasive ability among groups
3. 讨论
慢病毒载体(lentivirus vectors,LV)是以人类免疫缺陷型病毒(HIV)为基础,截去其复制相关基因序列,代之以治疗基因或基因治疗载体,对分裂细胞和非分裂细胞均具有感染能力,能够将肿瘤治疗基因安全高效地整合到人体内,使治疗基因长期、稳定、高效地表达,而不易诱发宿主免疫反应,利用慢病毒载体作为介导RNAi的工具,可以将慢病毒载体高效感染和整合的特性与RNAi特异性沉默同源基因表达的作用结合起来,较脂质体载体抑制效应更稳定,较质粒表达载体抑制作用更高效,是目前进行转基因和RNAi研究最好的工具之一。
本研究设计合成3对靶向Livin基因的siRNA,构建siRNA表达的重组慢病毒载体,利用病毒感染HT-29细胞,在细胞内转录生成shRNA,Dicer酶作用下产生siRNA,实现基因沉默的目的。通过Real-time PCR和Western blot检测结果发现Livin-RNAi-LV1和Liv⁃ in-RNAi-LV2感染HT-29细胞后Livin mRNA和蛋白的表达水平明显下降,其中Livin-RNAi-LV1的抑制效果较好达64.62%,而Livin-RNAi-LV3无沉默现象,出现这种差别的原因可能与siRNA设计的不同空间构象与靶基因的结合有关。因此,筛选Livin-RNAi-LV1为具有最佳干扰效率的重组慢病毒进行后续研究。
HT-29细胞Livin基因抑制后,随着培养时间的延长,细胞生长较对照组明显减慢(P <0.05),细胞生长曲线低平,细胞克隆形成率仅17.33%,克隆形成能力明显减弱,也反映了细胞增殖活力的下降。同时,TUNEL法和FCM检测均发现大肠癌HT-29细胞明显发生凋亡。其机制可能与Livin基因能够抑制肿瘤细胞增殖,当其表达抑制后,肿瘤细胞凋亡抑制因素减弱,诱导HT-29细胞自发凋亡,从而影响肿瘤的生长。
研究发现细胞周期调控异常与细胞恶变密切相关[6],细胞周期调节紊乱是恶性肿瘤细胞凋亡和增殖异常的重要原因,细胞周期的调控实际上就是对细胞周期调控点G0/G1、S和G2/M的调控,是以细胞周期蛋白的合成和降解为主的多因素参与过程[7]。本研究发现Livin-RNAi-LV1感染后的HT-29细胞周期的分布发生了明显的改变,G0/G1期细胞比例升高(P < 0.05),S期细胞比例降低(P <0.05),G2/M期细胞比例降低(P <0.05),这提示Livin基因沉默可使细胞周期重新分布,产生G0/G1期阻滞,从而降低S期和G2期细胞比例。同时,Livin抑制后的HT-29细胞增殖周期进展受阻,从而促进了细胞凋亡的进程。因此,认为Livin的表达可能具有细胞周期依赖性。本研究与王琳琳等[8]在黑色素瘤A375细胞中的研究相似,均认为Livin基因沉默后出现了G0/G1期阻滞。
侵袭性是恶性肿瘤浸润性生长和转移的条件,国内外关于Livin与肿瘤侵袭性的研究鲜见报道。Liu等[9]利用siRNA真核表达载体转染肝癌细胞株SMMC-7721,发现沉默Livin后明显减弱了SMMC-7721细胞的侵袭能力。本研究利用慢病毒载体介导RNAi沉默Livin基因后,发现实验组穿膜细胞数明显减少,提示大肠癌HT-29细胞的侵袭能力明显下降。Livin与大肠癌的侵袭性的相关机制尚需进一步研究。研究者发现Survivin与大肠癌侵袭性相关,Survivin被沉默后,使大肠癌SW480细胞阻滞在G2/M,影响微管、微丝的装配,可能引起细胞黏弹性系数下降,进而引起细胞侵袭能力下降,另外抑制Survivin表达可降低肿瘤血管生成因子VEGF的表达,进而抑制大肠癌SW480细胞的侵袭性[10]。Livin与Survivin有相似之处,是否也能通过此机制来抑制细胞的侵袭性有待深入研究。
总之,本研究发现慢病毒载体介导的RNAi技术能够高效而稳定地抑制大肠癌HT-29细胞中Livin基因的表达,且沉默Livin基因后的HT-29细胞增殖能力受到抑制,细胞凋亡增加,细胞周期重新分布,细胞侵袭性减弱,为大肠癌靶向Livin的基因治疗提供理论基础。
-
表 1 目的基因病毒载体构建框架
Table 1 Designed sequences of siRNA and framework of lentiviral vector

表 2 各组HT-29细胞Livin mRNA的相对表达水平
Table 2 Relative expression of Livin mRNA in each group

表 3 重组慢病毒感染后HT-29细胞凋亡指数
Table 3 Apoptosis index in each group

表 4 流式细胞术检测重组慢病毒感染对细胞周期的影响
%(x±s) Table 4 Cell cycle in each group by flow cytometry

表 5 各组细胞体外侵袭能力
Table 5 Difference in cell invasive ability among groups

-
[1] Lin J H, Deng G, Huang Q, et al. KIAP, a novel member of the inhibitor of apoptosis protein family[J]. Biochem Biophys Res Commun, 2000, 279(3): 820-831. DOI: 10.1006/bbrc.2000.4027
[2] Crnkovic-Mertens I, Muley T, Meister M, et al. The anti-apoptotic livin gene is an important determinant for the apoptotic resistance of non-small cell lung cancer cells[J]. Lung Cancer, 2006, 54 (2): 135-142. DOI: 10.1016/j.lungcan.2006.07.018
[3] Crnkovic-Mertens I, Semzow J, Hoppe-Seyler F, et al. Isoform-specific silencing of the Livin gene by RNA interference defines Livin beta as key mediator of apoptosis inhibition in HeLa cells[J]. J Mol Med, 2006, 84(3): 232-240. DOI: 10.1007/s00109-005-0021-5
[4] Crnkovic-Mertens I, Wagener N, Semzow J, et al. Targeted inhibition of Livin resensitizes renal cancer cells towards apoptosis[J]. Cell Mol Life Sci, 2007, 64(9): 1137-1144. DOI: 10.1007/s00018-007-6510-7
[5] 黎军和, 何文静, 何友兼. Survivin和Livin在Dukes'B期结直肠癌中的表达及其临床意义[J]. 癌症, 2007, 26(5): 547-551. [6] Pietenpol JA, Stewart ZA. Cell cycle checkpoint signaling: cell cycle arrest versus apoptosis[J]. Toxicology, 2002, 181-182: 475-481. DOI: 10.1016/S0300-483X(02)00460-2
[7] Obaya AJ, Sedivy JM. Regulation of cyclin-Cdk activity in mammalian cells[J]. Cell Mol Life Sci, 2002, 59(1): 126-142. DOI: 10.1007/s00018-002-8410-1
[8] 王琳琳, 郑洪, 唐薇薇, 等. livin基因沉默对人恶性黑素瘤A375细胞周期和凋亡的影响[J]. 肿瘤, 2009, 29(4): 345-349. https://www.cnki.com.cn/Article/CJFDTOTAL-ZZLL200904015.htm [9] Liu H, Wang S, Sun H, et al. Inhibition of tumorigenesis and invasion of hepatocellular carcinoma by siRNA-mediated silencing of the livin gene[J]. Mol Med Rep, 2010. 3(6): 903-907. http://www.spandidos-publications.com/mmr/3/6/903/download
[10] 何敬东, 杨康群, 张振书, 等. 生存素siRNA对结肠癌细胞凋亡增殖和侵袭性的影响[J]. 中国肿瘤临床, 2006, 33(23): 1329-1333. DOI: 10.3969/j.issn.1000-8179.2006.23.003



 下载:
下载: