Bioequivalence of Tegafur, Gimeracil, and Oteracil Potassium Tablets in Cancer Patients
-
摘要:目的 研究国产替吉奥片剂在恶性肿瘤患者体内的生物等效性。方法 采用多中心、开放、随机、双周期交叉试验设计, 29例恶性肿瘤患者分别口服替吉奥片剂或替吉奥胶囊(S-1), 2个周期间的清洗期为1周。多点采集血样, 采用液相色谱-质谱-质谱联用法测定替加氟、5-氟尿嘧啶(5-FU)、吉美嘧啶(CDHP)和奥替拉西(Oxo)的血药浓度, 采用Phoenix WinNonlin 6.1药动学软件进行药动学参数分析和计算。结果 受试者口服受试制剂和参比胶囊后, 血浆中替加氟Cmax分别为(2 080±601)ng·mL-1和(2 050±615)ng·mL-1, AUClast分别为(25 300±10 900)ng·h·mL-1和(24 600±11 600)ng·h·mL-1; 5-氟尿嘧啶Cmax分别为(161±73.5)ng·mL-1和(166±79.9)ng·mL-1, AUClast分别为(829±506)ng·h·mL-1和(824±415)ng·h·mL-1; 吉美嘧啶Cmax为(351±141)ng·mL-1和(334±143)ng·mL-1, AUClast(1 570±914)ng·h·mL-1和(1 550±868)ng·h·mL-1; 奥替拉西Cmax(68.4±62.4)ng·mL-1和(56.2±39.9)ng·mL-1, AUClast(243±185)ng·h·mL-1和(241±172)ng·h·mL-1。AUC和Cmax经对数转换后进行方差分析及90%置信区间判断, 替吉奥片与S-1胶囊Cmax几何均值比的90%置信区间为75%~133%, AUClast几何均值比的90%置信区间为80%~125%;Tmax无显著性差异(P < 0.01)。本试验剂量下替吉奥片剂和S-1胶囊耐受性良好, 无严重不良事件。结论 替吉奥片剂与S-1胶囊在人体内具有相似的体内过程和药代动力学特征。符合生物等效的相关要求, 可判断替吉奥片剂与S-1胶囊具有生物等效性。
-
关键词:
- 替吉奥片剂 /
- 替吉奥(S-1)胶囊 /
- 液相色谱-质谱-质谱联用 /
- 生物等效性 /
- 药代动力学
Abstract:Objective This study analyzes the bioequivalence of tegafur, gimeracil, and teracil potassium tablets in cancer patients.Methods Twenty-nine patients were given 60 mg single dose and reference formulations based on an open-randomized two-way crossover design.The plasma concentrations of tegafur(FT), 5-fluorouracil(5-FU), gimeracil(CDHP), and oxonic acid(Oxo)were determined by liquid chromatography/tandem mass spectrometry.Results The main pharmacokinetic parameters of the test and reference formulations include a maximum concentration(Cmax)and area under curvelast(AUClast)for FT were 2 080 ng/mL 601 ng/mL and 2 050 ng/mL 615 ng/ mL and 25 300 ngh/mL 10 900 ngh/mL and 24 600 ng? h/mL 11 600 ng·h/mL, respectively.The values of Cmaxand AUClastfor 5-FU were 161 ng/mL 73.5 ng/mL and 166 ng/mL 79.9 ng/mL and 1570 ng/mL 914 ng·h/mL and 1550 ng·h/mL 868 ngh/mL, respectively.The values of Cmax and AUClast for CDHP were 351 ng/mL 141 ng/mL and 334 ng/mL 143 ng/mL and 1 570 ng·h/mL 914 ng-h/mL and 1 550 ng·h/mL 868 ng-h/mL, respectively.The values of Cm and AUCta, for Oxo were 68.4 ng/mL 62.4 ng/mL and 56.2 ng/mL 39.9 ng/mL and 243 ng·h/mL 185 ngh/mL and 241 ng·h/mL 172 ng·h/mL, respectively.The 90%confidence interval(CI)of the geometric mean ratio of AUClast for the test and reference formulations was between 80%and 125%.The 90%CI of the geometric mean ratio of Cmaxwas between 75%and 133%.No significant differences were found for the Tmax between the groups(P < 0.01).Tolerance of the test and reference formulations was favorable under the test dose.No serious adverse events were observed.Conclusion The results demonstrate that the two formulations are bioequivalent by analysis of variance.-
Keywords:
- Tegafur /
- gimeracil /
- oteracil Potassium Tablets /
- S-1 /
- LC/MS/MS
-
国产替吉奥片剂属第二代氟尿嘧啶类口服抗癌药, 为抗癌药物替加氟与其他两种生化修饰剂吉美嘧啶和奥替拉西钾按1:0.4:1(摩尔比)组成的复方制剂[1], 其中替加氟作为氟尿嘧啶(5-FU)的前体药物进入体内后通过肝脏P450酶转化变成5-FU后进入血液循环, 起到抗癌作用, 加入吉美嘧啶特异性抑制肝脏二氢嘧啶脱氢酶(DPD)的活性, 减缓5-FU的降解, 能较长时间维持血药浓度, 提高疗效。奥替拉西钾能特异性抑制肠道黏膜细胞内乳清酸核糖转移酶(ORTC), 降低5-FU在肠组织内产生磷酸化, 而磷酸化的结果是导致胃肠道副作用的主要原因, 从而降低了替加氟的毒性[2]。进口替吉奥胶囊于1999年上市, 主要适应证为胃肠道恶性肿瘤, 已有报道[3-5]S-1在日本、欧洲和美国癌症患者体内的药代动力学研究报告, 但目前鲜见有关S-1在中国癌症患者体内的药代动力学研究报道。本品为片剂, 与替吉奥胶囊制剂不同, 前期研究证实, 其与S-1胶囊具有相同的给药途径和活性成分, 但鲜见其与S-1胶囊生物等效性的相关研究。本研究经由国家食品药品监督管理局(SFDA)批准(临床批件号2005 L04685)进行临床试验, 将替吉奥片剂与S-1胶囊进行生物利用度研究, 评价两个制剂的生物等效性, 并初步探讨其在中国癌症患者体内的药代动力学特性, 旨为临床用药提供参考依据。
1. 材料与方法
1.1 材料
1.1.1 药品与试剂
替吉奥片剂规格: 20 mg/片, 每片含替加氟20 mg、吉美嘧啶5.8 mg、奥替拉西钾19.6 mg, 由福州海王福药制药有限公司提供。替吉奥胶囊规格: 20 mg/粒, 每粒含替加氟20 mg、吉美嘧啶5.8 mg、奥替拉西钾19.6 mg, 由日本大鹏药品工业株式会社生产。
1.1.2 仪器
液相色谱输液泵: LC-30AD型液相色谱系统(包括LC-30AD输液泵、DGU-20A5型脱气机、SIL-30AC型自动进样器和CTO-30A型柱温箱)购自日本岛津公司。MS/MS系统: QTRAP 5500质谱系统, 配备电喷雾电离源(Turbo IonSpray)购自美国AB SCIEX公司。数据采集: Analyst 1.5.2软件购自美国Applied Biosystems公司。
1.1.3 受试对象
选择天津医科大学附属肿瘤医院及苏州大学附属第二医院2011年8月至2011年12月的29例恶性肿瘤患者作为受试对象, 其中男性12例, 女性17例; 包括乳腺癌8例, 直肠癌4例, 胃癌3例, 鼻咽癌2例, 胸腺癌2例, 肝癌、肺癌、结肠癌、甲状腺癌、子宫内膜癌、睾丸癌、左额颞胶质瘤、右颈部炎性纤维母细胞瘤、腹盆腔恶性肿瘤及右腋淋巴结转移癌伴骨肺继发恶性肿瘤各1例。受试者的年龄31~69岁, 平均年龄为(49.7±9.9)岁。受试者用药前体温、心率、呼吸、血压等生命体征均正常, 试验前肝功能、肾功能、血尿常规、心功能检查均符合试验要求。受试者2周内未使用氟尿嘧啶类抗肿瘤药物、氟尿嘧啶类抗真菌药物、氟胞嘧啶、索利夫定及其结构类似物如溴夫定等, 也无其他抗肿瘤伴随治疗。本试验严格遵守赫尔辛基宣言的有关伦理准则, 试验方案经本院伦理委员会批准进行。所有入选患者均签署知情同意书。
1.2 方法
1.2.1 试验方案
本试验采用多中心、开放、随机、双周期交叉试验设计, 2个周期间的清洗期为1周。根据已开展的临床试验使用剂量、中国人群体表面积情况确定本项研究使用剂量为单次60 mg。受试者口服替吉奥片剂或S-1胶囊60 mg (3片或3粒)随机分成两组, 1)TR组: 先服替吉奥片剂, 后服S-1胶囊; 2)RT组: 先服S-1胶囊, 后服替吉奥片剂。受试者于服药前(0h)和服药后0.5、1.0、1.5、2.0、3.0、4.0、6.0、8.0、12、24、48 h时间点采集静脉全血4mL, 置于肝素化离心试管中, 低温(4℃)3 000r/pm, 离心15 min分离血浆, 于(70℃)冰箱中冷冻。并在冷冻状态下运送至上海药物代谢研究中心, 于(70℃)冰箱中保存待测。经过7 d清洗期后, 受试者交叉服药, 所用方法相同。
1.2.2 血浆样品测定方法
本试验采用液相色谱-串联质谱法(LC/MS/MS)测定受试者服药后血浆中替吉奥、5-氟尿嘧啶、吉美嘧啶和奥替拉西的浓度。本研究分析方法学确证结果表明, 分析方法符合有关规范要求6, 可用于药物人体生物等效性试验。受试者血浆样品测定时, 每一分析批建立一条标准曲线, 同时分析低、中、高多样本的质控样品, 并穿插于受试者样品测试当中。根据当日标准曲线求算未知样品浓度和QC样品浓度, 至少67%的QC样品相对偏差在±15%之内, 且33%不是同一浓度的QC样品相对偏差可以超出±15%, 当日数据方可接受。当未知样品的浓度超出定量上限时, 将该未知样品稀释后进行测定。
1.3 统计学方法
药动学指标采用Pharsight公司Phoenix WinNonlin 6.1药动学软件, 非房室模型法(NCA)计算如下药动学参数: 血浆药物峰浓度(Cmax)、血药浓度-时间曲线下面积(AUClast)、血药浓度达峰时间(Tmax)和血浆药物半衰期消除值t1/2z。对主要药动学参数(AUC, Cmax)对数转换后进行方差分析, 计算替吉奥片剂与S-1胶囊AUC和Cmax几何均值比值及其90%置信区间(90%CI)。P < 0.01为差异无统计学意义。根据中华人民共和国药典药物制剂生物等效性试验指导原则规定, 若替吉奥片剂与S-1胶囊AUClast几何均值比的90%置信区间为80%~125%, Cmax几何均值比的90%置信区间为75%~133%, 则可认为替吉奥片与S-1胶囊具有生物等效性。对受试者人口学指标、血药浓度数据、药动学参数和安全性数据进行描述性统计分析。
2. 结果
2.1 药代动力学参数
患者口服替吉奥片剂和S-1胶囊后, 血浆中替加氟、5-氟尿嘧啶、吉美嘧啶和奥替拉西的主要药动学参数见表 1。
表 1 29例癌症患者口服替吉奥片剂或S-1胶囊后各成分的主要药动学参数Table 1. Main pharmacokinetic parameters of the drug ingredients after administration of tegafur, gimeracil, and oteracil potassium tablets and S-1 capsules in 29 cancer cases
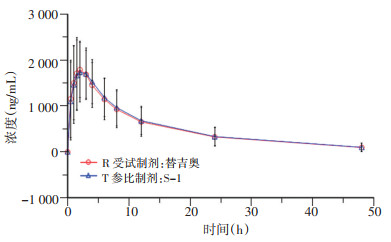
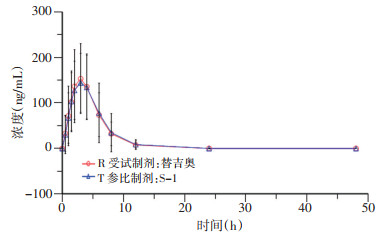
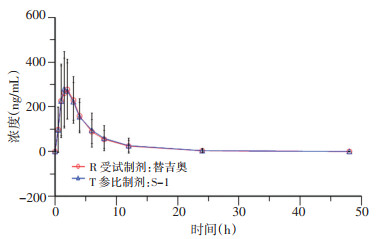
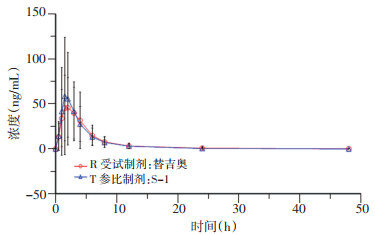
2.2 平均血药浓度-时间曲线
患者口服替吉奥片剂和S-1胶囊48 h内, 列出受试者给药后各时间点血浆中测定药物的平均血药浓度, 并绘制血药浓度-时间曲线(图 1~4), 替加氟、5-氟尿嘧啶、吉美嘧啶和奥替拉西在替吉奥片剂和S-1胶囊中的血药浓度曲线基本重叠, 均无明显差异。对主要药动学参数(AUC, Cmax)对数转换后, 计算替吉奥片剂与S-1胶囊中替加氟、5-氟尿嘧啶、吉美嘧啶和奥替拉西的相对生物利用度分别为102.8%、100.6%、101.3%、100.8%。
2.3 生物等效性评价
替吉奥片剂与S-1胶囊Cmax和AUC对数转换后的方差分析结果显示5-氟尿嘧啶的Cmax和AUC在给药周期间有显著性差异(P=0.597, P=0.640), 在制剂间和给药顺序间无显著性差异(P < 0.01)。给药周期间的差异不影响制剂的生物等效性评价。替加氟、吉美嘧啶和奥替拉西的Cmax和AUC在制剂间、给药顺序和周期间均无显著性差异(P < 0.0 1)。两制剂间各成分的Tmax无显著性差异(P < 0.01, 表 2)。
表 2 29例癌症患者口服替吉奥片剂或S-1胶囊后Cmax及AUClast几何均值比及90%置信区间Table 2. Comparison of the ratios between geometric means of Cmax and AUClast in 29 cases, and its 90% confidence interval following administration of tegafur, gimeracil, and oteracil potassium tablets and S-1 capsules in 29 cancer cases
替吉奥片剂与S-1胶囊AUClast几何均值比的90%置信区间为80%~125%, Cmax几何均值比的90%置信区间为75%~133%, 符合生物等效的相关要求[2], 可判断两个制剂具有生物等效性。
2.4 安全性评价
本试验发生10例不良事件, 主要表现为恶心呕吐(4例)、腹痛(3例)、呼吸道感染(2例), 便秘(1例), 但未发生严重不良事件。实验室检查方面, 替吉奥片剂表现出一定的骨髓抑制作用, Ⅰ度骨髓抑制(2例), Ⅱ度骨髓抑制(1例)。受试制剂和参比制剂在本试验剂量下耐受性良好。
3. 讨论
为满足国内临床需要, 降低用药成本, 国内开始进行国产替吉奥制剂的研究, 但多为胶囊制剂, 本品与替吉奥胶囊不同, 为片剂。经国家食品药品监督管理局批准已进入临床试验, 开展了替吉奥片剂人体药代动力学试验以及评价其有效性、安全性的研究。试验结果显示[7]: 口服替吉奥片剂后, 受试者耐受良好, 替加氟、5-氟尿嘧啶、吉美嘧啶和奥替拉西的主要药动学参数与国外报道基本一致。但目前未见有关其在中国癌症患者体内的药代动力学研究报道, 也尚未见其与S-1胶囊生物等效性的相关研究。
本试验采用液相色谱-串联质谱法(LC/M S/MS)测定受试者服药后血浆中替吉奥、5-氟尿嘧啶、吉美啼啶和奥替拉西的浓度。该方法具有快速、准确、灵敏度高的特点, 适合复方替吉奥片剂中替加氟、替加氟代谢产物5-氟尿嘧啶、吉美嘧啶和奥替拉西的人体药代动力学及生物等效性研究。
受试者单次口服替吉奥片60 mg, 按照平均每人体表面积1.56m2计算, 相当于38.46 mg·m-2, 在此剂量下, 替加氟Cmax为2 080 ng·mL-1, AUClast为25 300 ng·h·mL-1, 这与日本患者[3](给药剂量30 mg·-2, Cmax为1 268 ng·mL-1, AUC0-t为12 839 ng·h·mL-1)基本一致。但是高于荷兰患者[4](单次给药剂量为35 mg·m-2, Cmax为7.5μM, AUC0-t, 为3 710μM·min); 与欧美患者相比[5], 替加氟Cmax和AUClast亦较高。有报道[8]替加氟主要是由CYP2A6代谢, 这可能与CYP2A6表达量的种族差异有关[9], 与日本人相比, CYP2A6在白种人中表达较多。
5-氟尿嘧啶是替加氟的活性代谢产物, 受试者单次口服替吉奥片60 mg后的tmax为(2.9±0.76)h, 表明其在患者体内能够快速消除。吉美嘧啶为二氢嘧啶脱氧酶抑制剂, 主要作用是抑制5-氟尿嘧啶的降解, 延长5-氟尿嘧啶的作用时间, 受试者单次口服替吉奥片60 mg后, 经药代动力学参数计算, 吉美嘧啶的Cmax为351 ng·mL-1, AUClast为(1 570±914) ng·h·mL-1。奥替拉西能特异性抑制肠道黏膜细胞内乳清酸核糖转移酶, 降低5-氟尿嘧啶在肠道组织内磷酸化, 从而降低5-氟尿嘧啶引起的胃肠道毒性。有报道[10]空腹口服S-1可以提高奥替拉西生物利用度。吉美嘧啶及奥替拉西T1/2和Tmax均与5-氟尿嘧啶接近, 能够很好发挥增效减毒的协同作用。
本试验结果表明, 受试制剂与参比制剂各测定成分的Tmax无显著性差异。替吉奥片剂与S-1在人体内具有相似的体内过程和药代动力学特征。替吉奥片剂中替加氟、5-氟尿嘧啶、吉美嘧啶和奥替拉西的相对生物利用度分别为102.8%、100.6%、101.3%和100.8%。AUC和Cmax经对数转换后进行方差分析及90%置信区间(CI)判断: 受试制剂与参比制剂AUClast几何均值比的90%置信区间为80%~125%, Cmax几何均值比的90%置信区间为75%~133%, 符合生物等效的相关要求, 可判断两制剂具有生物等效性。
-
表 1 29例癌症患者口服替吉奥片剂或S-1胶囊后各成分的主要药动学参数
Table 1 Main pharmacokinetic parameters of the drug ingredients after administration of tegafur, gimeracil, and oteracil potassium tablets and S-1 capsules in 29 cancer cases

表 2 29例癌症患者口服替吉奥片剂或S-1胶囊后Cmax及AUClast几何均值比及90%置信区间
Table 2 Comparison of the ratios between geometric means of Cmax and AUClast in 29 cases, and its 90% confidence interval following administration of tegafur, gimeracil, and oteracil potassium tablets and S-1 capsules in 29 cancer cases

-
[1] Shirasaka T. Nakano K, Takechi T, et al. Antitumor activity of 1 M tegafur-0.4 M 5-chloro-2, 4-dihydroxypyridine-1 M potassium oxonate(S-1) against humancolon carcinoma orthotopically implanted into nude rats[J]. Cancer Res. 1996, 56(11): 2602-2606.
[2] Hirata K, Horikoshi N. Aiba K. et al. Pharmacokinetic study of S-1. a novel oral fluorouracil antitumor drug[J]. Clin Cancer Res, 1999, 5(8): 2000-2005.
[3] Hirata K, Horikoshi N, Aiba K, et al. Pharmacokinetic study of S-1, a novel oral fluorouracil antitumor dmg[J]. Clin Cancer Res, 1999, 5(8): 2000-2005.
[4] Peters GJ, Noordhuis P, Van Kuilenburg AB, et al. Pharmacokinetics of S-1, an oral formulation of ftorafur, oxonic acid and 5-chloro -2, 4-dihydroxypyridine(molarratio 1: 0.4: 1) in patients with solid tumorsr[J]. Cancer Chemother Pharmacol. 2003, 52(1): 1-12.
[5] Hoff PM, Saad ED, Ajani JA, et al. Phase Ⅰ study with pharmacokinetics of S-1 on an oral daily schedule for 28 days in patients with solid tumors[J]. Clin Cancer Res, 2003, 9(1): 134-142.
[6] Liu K, Zhong D, Zou H, et al. Determination of tegafur, 5-fluorouracil, gimeracil and oxonic acid in human plasma using liquid chromatography -tandem mass spectrometry[J]. J Pharm Biomed Anal, 2010, 52(4): 550-556. DOI: 10.1016/j.jpba.2010.01.026
[7] 朱仲玲, 薛津怀, 阎昭, 等. 肿瘤患者单次和多次口服替吉奥片的药动学研究[J]. 中国肿瘤临床. 2011, 38(10): 594-596. [8] Hirose T, Fujita K, Nishimura K, et al. Pharmacokinetics of S-1 and CYP2A6 genotype in Japanese patients with advanced cancer[J]. Oncol Rep, 2010, 24(2): 529-536.
[9] Kaida Y, Inui N, Suda T, et al. T The CYP2A6*4 allele is determinant of S-1 pharmacokinetics in Japanese patients with non-small-cell lung cancer[J]. Clin Pharmacol Ther, 2008, 83(4): 589-594.
[10] Mende B, Krauss J, Thyssen D, et al. Pharmacokinetic study of S-[J]. Int J Clin Pharmacol Ther. 2009, 47(1): 65-67.



 下载:
下载: