Effect of PUMA gene transfection in breast cancer cells (MCF-7) on enhancing the sensitivity of epirubicin-induced apoptosis
-
摘要:目的 探讨PUMA基因转染是否增强乳腺癌MCF-7细胞对表柔比星致凋亡的敏感性。方法 应用脂质体介导重组真核表达载体PUMA-pCDNA3和空载体pCDNA3质粒瞬时转染至乳腺癌MCF-7细胞中, G418筛选阳性细胞。将系列浓度(0.01~100μmol/L)的表柔比星分别作用于MCF-7、MCF-7/PUMA和MCF-7/pCDNA3细胞72 h, MTT法测定各组细胞的存活率并计算IC50, FCM、TUNEL法检测细胞凋亡情况, Western blotting检测各组细胞PUMA蛋白表达的变化。结果 MCF-7、MCF-7/PUMA和MCF-7/pCDNA3细胞的表柔比星IC50分别为(13±1.4)、(1.8±0.2)和(10.7±1.3)μmol/L, MCF-7/PUMA细胞对表柔比星作用的敏感性增加了7.2倍。表柔比星以剂量依赖方式诱导MCF-7细胞凋亡, 但对MCF-7/PUMA细胞所诱导的凋亡比MCF-7和MCF-7pCDNA3更明显。低浓度表柔比星(0.1μmol/L)轻微引起MCF-7/pCDNA3[(1.15±0.26)%]和MCF-7细胞凋亡[(0.9±0.24)%], 但能诱导MCF-7/PUMA细胞明显凋亡[(6.44±1.46)%]; 高浓度表柔比星(1μmol/L)诱导各组细胞凋亡, 但表柔比星MCF-7/PU MA细胞凋亡率[(35.47±9.36)%]明显高于MCF-7[(12.6±3.73)%]和MCF-7/pCDNA3细胞[(15.2±5.17)%], 差异均有统计学意义(P < 0.01);FCM和TUNEL方法检测显示相同的结果。PUMA蛋白在MCF-7/PUMA细胞中的表达明显高于MCF-7和MCF-7/pCD NA3细胞。结论 PUMA基因稳定转染明显地增强了乳腺癌MCF-7细胞增强表柔比星致凋亡作用的敏感性。Abstract:Objective To investigate if PUMA gene transfection could increase the sensitivity of breast cancer cells(MCF-7) on Epirubicin-induced apoptosis.Methods PUMA-pCDNA3, which contains full length PUMA cDNA or-pCDNA3, was transfected into the human breast cancer cell line MCF-7 by using lipofectamine.G418 selection was used to select positive cells.MCF-7, MCF-7/PUMA, and MCF-7/pCDNA3 cells were respectively treated with serial concentrations of Epirubicin(0.01 μmol/L to 100 μmol/L).MTT assay was performed to determine the cell survival rate in each group.IC50 of Epirubicin was then calculated.TUNEL and FCM were employed to investigate cell apoptosis.Western blot was performed to detect PUMA protein expression.Results The Epirubicin IC50 values of MCF-7, MCF-7/PUMA, and MCF-7/pCDNA3 cells were(13±1.4), (1.8±0.2), and(10.7±1.3) μmol/L, respectively.The sensitivity of MCF-7/PUMA cells had a 7.2-fold increase.The Epirubicin-induced apoptosis of MCF-7 cells behaved in a dose-dependent manner.The apoptosis of MCF-7/ PUMA cells was more prominent than that of MCF-7 and MCF-7/ pCDNA3 cells.At a low concentration(0.1 μmol/L), Epirubicin could only slightly induce MCF-7/ pCDNA3 cells [(1.15±0.26)%] and MCF-7 cells [(0.9±0.24)%], as well as the apoptosis in MCF-7/PUMA cells [(6.44±1.46)%].At a high concentration, Epirubicin(1.0 μmol/L) could induce apoptosis in all groups.The apoptotic rate was significantly higher in MCF-7/PUMA cells [(35.47±9.36)%] than in MCF-7/ pCDNA3 cells [(15.2±5.17)%] and in MCF-7 cells [(12.6±3.73)%], both P < 0.01).Resultsobtained from FCM and TUNELwere the same.PUMAprotein expression was significantly higher in MCF-7/PUMAcells than in MCF-7 and MCF-7/pCDNA3 cells.Conclusion PUMA gene transfection greatly enhances the sensitivity of MCF-7 cells during Epirubicin-induced apoptosis.
-
乳腺癌是女性最常见的恶性肿瘤之一, 近年其发病率呈明显上升的趋势[1]。目前普遍认为乳腺癌是基因环境交互作用的复杂疾病。乳腺癌传统的治疗方法是以手术切除、辅以放疗、化疗及内分泌治疗。随着人类对恶性肿瘤发病机制认识的不断深入和分子生物学技术的飞速发展, 基因治疗成为其生物学治疗的重要探索方向[2]。p53上调凋亡调控因子(p53up-regulatedmodulatorofapoptosis, PUMA)是近年来报道新发现的Bcl-2蛋白家族中的促凋亡成员, 有强大的促凋亡作用。研究表明PUMA在p53依赖和非依赖途径的细胞凋亡启动与肿瘤发生过程中发挥着重要的作用, 并且比p53的促凋亡作用更强大、稳定, 因此在近年肿瘤基因治疗的研究中受到广泛关注[3]。体外实验表明, 转染外源性PUMA基因可以诱导肿瘤细胞的快速凋亡和抑制集落形成, 并且PUMA基因转染明显增加体内外食管癌、头颈细胞癌、绒膜癌、肺癌细胞的化疗和放疗敏感性, 增加治疗效果[4-5]。本研究对PUMA基因转染是否增强乳腺癌MCF-7细胞对表柔比星致凋亡的敏感性进行分析。
1. 材料与方法
1.1 材料
1.1.1 细胞株与试剂
PUMA-pCDNA3和pCDNA3购自上海浩然生物技术有限公司; 鼠抗人PUMA多克隆抗体购自Cell Signals公司; G418、LipofectinamineTM2000购自Cibco公司; Western blotting、TUNEL、MTT和小量质粒快速抽提纯化试剂盒购自上海华舜公司; 蛋白质分子量标准购自中国科学院上海生物化学研究所。乳腺癌细胞株MCF-7购自中国科学院上海细胞所, 用含10%胎牛血清的1640培养液培养, 培养条件为37℃恒温、饱和湿度和5%CO2, 对数生长的细胞供实验使用。
1.1.2 细胞转染
将对数生长期MCF-7细胞按2×105/孔的密度悬于2 mL完全培养液中, 接种在6孔板, 37℃、5%CO2培养箱中过夜, 至细胞长至约60%~80%融合。用无血清和无抗生素的培养液冲洗每孔加入2μL目的基因质粒PUMA-pCDNA3或空载体质粒pCDNA3和8μL脂质体, 然后置于CO2培养箱中37℃培养5 h。再将培养液换成加入含20%FBS的DMEM培养液培养72 h, 然后换用G418培养液继续培养(含G4183 mg/mL)进行筛选, 3~5 d换液1次, 2周后从稳定表达的细胞克隆中挑选出多个单细胞克隆继续培养。将PUMA-pCDNA3和pCDNA3转染的细胞分别命名为MCF-7/PUMA和MCF-7/pCDNA3。
1.2 方法
1.2.1 MTT法检测PUMA/MCF-7对表柔比星细胞毒性的敏感性
将MCF-7、MCF-7/PUMA和MCF-7/pCDNA3细胞分别接种在96孔培养板(1×104/孔), 次日每孔更换含系列浓度表柔比星(0.01、0.1、0.5、1、5、10、20、50、100μmol/L)的培养液100μL。48 h后, 每孔加入10μL的MTT溶液(2.5 mg/mL), 继续孵育4 h, 去除培养液, 每孔加入100μL的DMSO(Sigma公司), 溶解已形成的结晶, 震摇5 min, 在波长570 nm处测定光密度值(0D)。设置空白对照: 与实验孔平行设置, 仅加培养液, 检测时以此为空白调零。实验进行3次, 结果取平均值。细胞存活率(%)=(实验组0D-空白对照0D)/(对照组0D-空白对照0D)×100%。
1.2.2 流式细胞术检测肿瘤细胞的凋亡
将MCF-7、MCF-7/PUMA和MCF-7/pCDNA3细胞各按1×106/孔接种于24孔培养板培养过夜, 第2天分别加入1μmol/L的表柔比星100μL常规培养72h, 然后按照说明书加入FITC和PI双染色, 上流式细胞仪检测。实验以不加表柔比星作为对照组。结果判断: 凋亡细胞对所有用于细胞活性鉴定的染料如PI有抗染性, 坏死细胞则不能; 细胞膜有损伤的细胞DNA可被PI着染产生红色荧光, 而细胞膜保持完好的细胞则不会有红色荧光产生。因此, 在细胞凋亡早期PI不会着染而没有红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上, 左下象限显示活细胞, 为(FITC-PI-); 右上象限是非活性细胞, 即坏死细胞, 为(FITC+/PI+); 而右下象限为凋亡细胞, 显现(FITC+/PI-)。
1.2.3 TUNEL法测定表柔比星诱导的肿瘤细胞的凋亡
离心重悬各组细胞, 接种细胞于内置盖玻片的3.5 cm培养皿(1×108/皿), 37℃温箱孵育24h后加入0.1μmol/L或1μmol/L的表柔比星10μL继续孵育72 h, 实验以不加表柔比星组作为对照。采用TUNEL试剂盒, 按试剂盒说明书操作, 计算每个高倍视野下凋亡细胞数, 每一个样本随机计数5个视野。
1.2.4 Western blotting检测肿瘤细胞PUMA蛋白的表达
提取经表柔比星或无表柔比星作用72h的细胞总蛋白进行Western blotting检测。SDS-PAGE上样量为15μg/L。SDS电泳: 恒流, 每块板20~40 mA, 电泳时间约2h。转膜: 恒流, 每张膜42 mA, 时间为3.5h。
1.3 统计学处理
所有数据结果应用SPSS 17.0统计软件处理。率的比较采用χ2检验。实验结果以x±s表示, 两个独立样本组间均数比较用t检验, 多组的组间比较用方差分析, P < 0.05为有显著性差异。
2. 结果
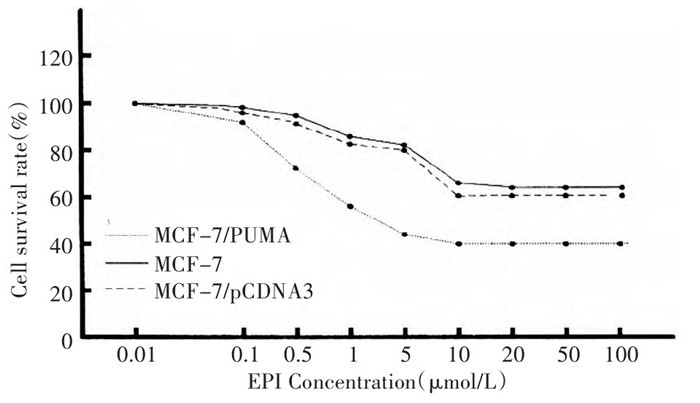
2.1 PUMA基因导入乳腺癌细胞增强对表柔比星致凋亡作用的敏感性
通过MTT法测定了乳腺癌细胞对表柔比星致凋亡作用的敏感性。结果发现, 表柔比星的浓度为0.01~100μmol/L时细胞存活率与表柔比星浓度之间均存在剂量依赖性, 随着表柔比星浓度增高, 细胞存活率逐渐下降; 与MCF-7和MCF-7/pCDNA3细胞相比, MCF-7/PUMA细胞存活率下降更为明显。利用Excel软件计算得出, MCF-7和MCF-7/pCDNA3细胞的IC50分别为(13±1.4)和(10.7±1.3)μmol/L。相比之下, MCF-7/PUMA比MCF-7细胞敏感7.2倍, 其IC50为(1.8±0.2)μmol/L(图 1)。由此可见, 乳腺癌细胞转染PUMA基因可增加对表柔比星致凋亡作用的敏感性。
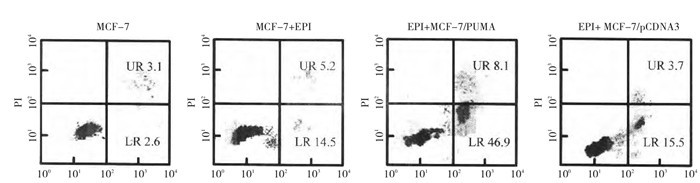
2.2 MCF-7/PUMA细胞凋亡的FCM检测结果
细胞经Annexin V-PI标记后于流式细胞仪上检测其凋亡情况。细胞凋亡率(图 2)提示: MCF-7细胞的凋亡率为(5.50±1.03)%, 作用于表柔比星(1μmol/L)后MCF-7细胞凋亡率为(18.1±2.13)%, 而表柔比星(EPI)作用后MCF-7/PUMA的细胞凋亡率为(52.18±10.2)%, 明显高于MCF-7组(P < 0.01)和MCF-7/PUMA组(P < 0.05)。表柔比星作用于MCF-7/pCDNA3后的细胞凋亡率为(18.55±4.32)%, 与MCF-7/表柔比星细胞(18.1±2.13)%相比无显著性差异(P > 0.05), 提示PUMA转染增强表柔比星的促细胞凋亡作用。
2.3 MCF-7/PUMA细胞凋亡的TUNEL检测结果
0.1μmol/L的表柔比星作用72h, MCF-7/PUMA细胞的凋亡率为(6.44±1.46)%, MCF-7细胞和MCF-7/pCDNA3细胞凋亡率为(0.9±0.24)%和(1.15±0.26)%。1μmol/L的表柔比星作用72 h后, 各组细胞中均可见凋亡细胞, MCF-7和MCF-7/pCDNA3细胞的凋亡率为(12.6±3.73)%和(15.2±5.17)%, MCF-7/PUMA细胞的凋亡率为(35.47±9.36)%, 差异均有统计学意义(P < 0.05)。
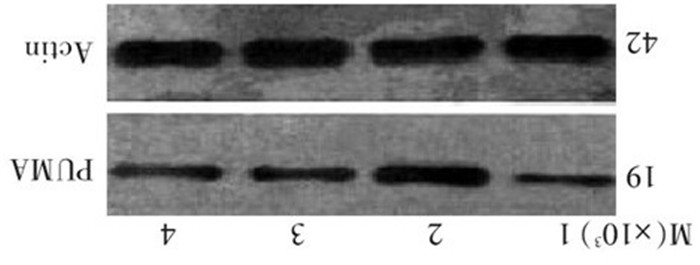
2.4 PUMA转染和表柔比星作用致乳腺癌细胞PUMA蛋白表达的改变
PUMA转染是否与表柔比星诱导的凋亡有关, 本研究分析了PUMA蛋白的变化。MCF-7细胞含有少量内源性PUMA蛋白表达, 经表柔比星作用后PUMA蛋白表达增加; MCF-7/PUMA细胞被表柔比星作用后, PUMA表达增加更明显; 而MCF-7/pCDNA3细胞表柔比星作用后, PUMA的蛋白表达与MCF-7/表柔比星组相似(图 3)。
3. 讨论
乳腺癌的发病率居女性恶性肿瘤的首位, 随着人们生活水平的提高, 其发病率也随之上升并呈低龄趋势, 已成为女性健康的第一杀手。目前主要治疗为术后辅以蒽环类药物化疗为主。表阿霉素是一种蒽环类化合物, 是临床上广谱抗肿瘤抗生素, 主要作用是直接嵌入DNA碱基对之间, 干扰转录过程, 阻止m RNA的形成, 从而达到对肿瘤细胞的杀伤作用[6]。然而, 在大多数肿瘤的化学药物治疗中, 含蒽环类化疗方案很多已耐药或达到心脏毒性累积剂量。乳腺癌的生成是肿瘤细胞增殖及凋亡平衡失调的结果, 细胞周期失控导致细胞过度增殖, 但更重要的是细胞凋亡受阻, 直接导致了衰老、受损及异常细胞的生命延长。因此, 寻找到一种能够增加化疗药物敏感性的药物成为目前研究的热点。增强蒽环类药-表柔比星化疗敏感性的方法较多, 除了传统的化疗药物联合外, 表柔比星联合基因治疗也是增强表柔比星敏感性的新方法, 并取得了明显的疗效。PUMA作为p53下游的凋亡促进基因, 在许多肿瘤细胞中表达缺失或低表达[7, 8, 9, 10], 增加细胞内PUMA表达能显著促进肿瘤细胞凋亡, 并且能显著增强肿瘤细胞对放化疗的敏感性, 提示PUMA可以作为化疗增敏剂用于肿瘤治疗。
本研究观察PUMA基因转染是否增强MCF-7细胞对表柔比星的治疗敏感性。结果发现, 将系列浓度的表柔比星作用于MCF-7/PUMA细胞, PUMA能明显地增强MCF-7细胞对表柔比星的治疗敏感性, 降低IC50平均值。进一步分析了表柔比星是否通过诱导细胞凋亡而发挥作用, 结果表明, 0.1μmol/L的表柔比星仅能诱导转染PUMA的细胞发生凋亡, 而不能诱导MCF-7细胞和载体对照细胞的凋亡; 高浓度的表柔比星(1μmol/L)能诱导全部细胞系的细胞凋亡, 但凋亡率在转染PUMA的细胞中明显高于不转染PUMA的MCF-7细胞和转染空载体的MCF-7细胞。结果提示, PUMA能增强表柔比星诱导MCF-7的凋亡作用。细胞内PUMA蛋白表达检测发现, MCF-7细胞仅含有少量内源性PUMA表达, 经表柔比星作用后PUMA蛋白表达增加, 转染PUMA基因的细胞作用表柔比星后, PUMA蛋白表达增加更明显, 所以表柔比星化疗敏感性的增强是通过增加PUMA表达实现的。因此, 开发相应能导致PUMA激活的DNA元件、转录因子及其他无毒性的小分子物质, 利用这些物质激活PUMA在肿瘤细胞内强表达是增强表柔比星化疗敏感性的可行措施, 也是乳腺癌治疗的新方向。
-
-
[1] 李媛媛, 张斌, 赵洪猛, 等. PXD101对人乳腺癌细胞MCF-7增殖及凋亡影响的机制探讨[J]. 中国肿瘤临床, 2012, 39(5): 249-253. DOI: 10.3969/j.issn.1000-8179.2012.05.003 [2] 马斌林, 耿中利, 阿力比亚提. 艾尼, 等. pcDNA3.0-PTEN质粒转染15dPGJ2对乳腺癌MCF-7细胞体外培养的影响[J]. 新疆医科大学学报, 2009, 32(7): 833-838. DOI: 10.3969/j.issn.1009-5551.2009.07.001 [3] Wang R, Wang X, Li B, et al. Tumor-specific adenovirus-mediated PUMA gene transfer using the survivin promoter enhances radiosensitivity of breast cancer cells in vitro and in vivo[J]. Breast Cancer Res Treat, 2009, 117(1): 45-54. DOI: 10.1007/s10549-008-0163-6
[4] Sun QH, Sakaida T, Yue W, et al. Chemosensitization of head andneck cancer cells by PUMA[J]. Mol Cancer Ther, 2007, 6(12): 3180-3188. DOI: 10.1158/1535-7163.MCT-07-0265
[5] Chen Y, Qian H, Wang H, et al. Ad-PUMA sensitizesdrug-resistant choriocarcinoma cells to chemotherapeutic agents[J]. Gynecol Oncol, 2007, 107(3): 505-512. DOI: 10.1016/j.ygyno.2007.08.007
[6] 孙燕, 周继昌, 主编. 临床肿瘤内科手册[M]. 第3版. 北京: 人民卫生出版社, 1996: 348-353. [7] 李昆, 李世正, 张蕴莉, 等. 槲皮素对人乳腺癌细胞MDA-MB-435S增殖及侵袭力的影响[J]. 肿瘤防治研究, 2009, 36(7): 549-551. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLFY200907004.htm [8] 宋俊颖, 张丽娜, 郑红, 等. 凋亡抑制基因AVEN mRNA在乳腺癌中的表达差异[J]. 中国肿瘤临床, 2012, 39(4): 197-200. DOI: 10.3969/j.issn.1000-8179.2012.04.005 [9] 刘锋, 孙根, 何川, 等. siRNA沉默c-FLIP基因表达与表柔比星联合应用对MCF-7细胞凋亡的影响[J]. 实用肿瘤学杂志, 2010, 24(4): 337-340. [10] 周云海, 周士福. 乳腺癌COX-2表达与紫杉醇脂质体联合表柔比星新辅助化疗疗效关系的研究[J]. 临床肿瘤学杂志, 2010, 15(5): 435-437. https://www.cnki.com.cn/Article/CJFDTOTAL-LCZL201005014.htm



 下载:
下载: