Role of serum lactate dehydrogenase in prognosis of primary liver cancer in patients undergoing transarterial chemoembolization
-
摘要:目的 探讨行TACE治疗肝癌患者血清乳酸脱氢酶水平与预后的关系。方法 分析山东省肿瘤医院2005年2月至2009年2月行肝动脉化疗栓塞术(transarterial chemoembolization, TACE)治疗的145例中晚期肝癌患者临床资料和实验室数据, 分别于术前和术后1个月内监测乳酸脱氢酶的水平。结果 据术前血清乳酸脱氢酶浓度, 将患者分为两组, 对照组(LDH≤450 U/L)86例和观察组(LDH > 450 U/L)59例。对照组平均疾病进展时间(TTP)和总生存期(OS)分别为14.2个月和19.3个月, 观察组患者TTP和OS分别为9.1个月和11.2个月, 两组患者TTP和OS差异有统计学意义(P < 0.05)。治疗后64例患者LDH值下降, 其TTP和OS分别为11.3和18.8个月, 而术后81例患者LDH水平升高, 其TTP和OS分别为9.1和9.8个月, 两组患者TTP和OS差异有统计学意义(P < 0.05)。结论 初诊患者血清乳酸脱氢酶活性检测能够预测行TACE肝癌患者的临床疗效, 术前高LDH水平患者可能在TACE和抑制肿瘤血管生成的综合治疗方法中受益, 可提高TTP和OS。Abstract:Objective This study aims to investigate the relationship between serum lactate dehydrogenase(LDH) levels and prognosis in the course of transarterial chemoembolization(TACE) of primary liver cancer(PLC).Methods Clinical and laboratory data of 145 consecutive patients undergoing trans-arterial chemo-embolization of unresectable PLC from February 2005 to February 2009 were analyzed.LDH values were obtained from the patients a month before the procedure.Results The patients were divided into two groups according to the concentration of the LDH serum registered before TACE(first: LDH < 450, U/L 86 patients; second: LDH > 450, U/L 59 patients).The patients were also classified according to the variation in the LDH serum levels before and after treatment(increased: 81 patients versus decreased: 64 patients).The median time to progression(TTP) was 14.2 months for patients with LDH values below 450 U/L, whereas median TTP was 9.1 months for patients with LDH values above the cut-off(P=0.000).The median overall survival(OS) was 19.3 months and 11.2 months(P=0.000).Median TTP was 11.3 months and median OS was 18.8 months for patients with decreased LDH values after treatment, whereas median TTP was 9.1 months and median OS was 9.8 months for patients with increased LDH levels(TTP: P=0.001;OS: P=0.004).Conclusions LDH is able to predict the clinical outcome for HCC patients undergoing TACE.High LDH pretreatment levels may be suitable candidates for clinical exploration in a multimodality treatment approach with TACE and anti-VEGF inhibitors to improve TTP and OS.
-
原发性肝癌(primary liver cancer, PLC)是最常见恶性肿瘤之一, 手术是首选的根治手段, 但多数患者确诊时已达到中晚期, 失去了手术治疗的机会[1]。TACE成为不适合手术切除的肝癌的首选治疗方法, 其近期疗效显著, 远期疗效并不理想, 治疗失败机制目前尚不完全清楚[2]。其主要原因可能是TACE治疗后肿瘤局部缺血、缺氧, 刺激肿瘤细胞形成新的血管来抵抗缺氧, 结果促进肿瘤进展。最近以索拉非尼为代表抑制肿瘤血管生成分子靶向药物, 为肝癌治疗带来新突破[3], 然而治疗时选择患者标准和治疗方式阻碍患者临床结果, 尚无有效预测疗效和预后的生物指标。乳酸脱氢酶(lactate dehydrogenase, LDH)是体内糖酵解和糖异生过程中的重要酶系之一, 广泛存在于人体组织中, LDH5主要分布在肝脏。当肿瘤细胞发生缺氧或坏死时, LDH活性上调, 使肿瘤细胞在缺氧条件下糖酵解作用加强, 减少对氧气依赖。缺氧、LDH水平和缺氧诱导因子1(HIF-1)三者之间的联系非常紧密, HIF-1α亚基受缺氧调控并调节HIF-1生物活性, 参与糖的能量代谢和血管生成等生物学效应[4]; 肿瘤微环境缺氧激活HIF依赖的几个下调基因表达, 编码血管内皮生长因子、促红细胞生成素和参与葡萄糖代谢酶等的合成。本研究通过检测肝癌患者TACE前后血清中LDH水平的变化, 探讨其在评估肝癌患者预后中的作用。
1. 材料与方法
1.1 一般资料
分析2005年2月至2009年2月山东省肿瘤医院收治行TACE治疗的145例原发性肝癌患者, 其中男性134例, 女性11例, 平均年龄49(23~75)岁。经临床、影像学及甲胎蛋白(AFP)检测确诊, 其中28例经穿刺活检病理证实。根据TACE术前患者血清LDH水平将其分为两组, 对照组86例LDH≤450 U/L, 观察组59例LDH > 450 U/L。根据术后血清LDH水平的变化, 将患者进行分为LDH升高组和LDH下降组。
1.2 治疗方法
1.2.1 TACE方法
所有患者采用Seldinger技术行股动脉穿刺插管至肝固有动脉或其分支, 造影明确肿瘤供血动脉后超选择插管至肿瘤供血动脉造影, 了解肿瘤数目、染色程度, 通过肿瘤供血动脉缓慢灌注, 化疗药物表柔比星、替加氟注射液、羟基喜树碱和超液态碘油15~20 m L视病灶情况而定, 混悬液药物和碘油剂量根据肝动脉显示肿瘤大小及血管富乏程度而定。少数患者加用明胶海绵栓塞, 栓塞致肿瘤无染色为止。
1.2.2 检测方法
分别于治疗前后1个月内采集患者空腹静脉血3 m L, 分离血清进行测定。LDH检测采用贝克曼DXC800型全自动生化分析仪和广州标佳科技有限公司提供的配套试剂进行测定, 所有操作均按说明书严格执行。
1.2.3 随访
根据m RECIST[5]标准, 术后1个月结合增强CT扫描确定碘油沉积情况和病灶活性情况, 根据甲胎蛋白(AFP)等对近期疗效进行评估和比较。近期疗效分为: 1)完全缓解(CR): 所有目标病灶消失或功能活性消失, 且血清学AFP检测为正常; 2)部分缓解(PR): 目标病灶长径总和缩小≥30%, CT显示中央凝固性坏死或空洞形成; 3)无变化或稳定(SD): 基线病灶长径总和有所缩小但未PR, 中央未见有坏死; 4)进展(PD): 肝内新发病灶或原位新发病灶增长之长径总和≥20%或出现肝外新发病灶和进展(PD)。以CR+PR计算客观有效率(RR), 以CR+PR+SD计算疾病控制率(DCR)。
1.3 统计分析
使用SPSS 16.0软件进行统计学分析。分类变量采用卡方检验。采用Kaplan-Meier法对TTP和OS进行分析, 用Log-rank法进行差异性检验。总生存期(OS)为确诊手术日期至死亡或末次随访日期时间间隔。疾病进展时间(TTP)为手术日期至进展或最后随访日期之间的时间间隔。P < 0.05为差异有统计学意义。
2. 结果
2.1 一般情况
全部患者随访1~28个月, 无患者失访。TACE术后有64例(44%)血清LDH水平降低, 81例(56%)LDH水平升高。两组患者一般资料相比, 差异无统计学意义(P > 0.05, 表 1)。
表 1 两组患者一般临床资料比较Table 1. Comparison of clinical variables between the two groups of patients
2.2 近期疗效
LDH≤450U/L组RR为52.3%, LDH > 450U/L组RR为45.8%, 组间比较差异无统计学意义(χ2=0.603, P=0.437);LDH≤450U/L组DCR为75.6%, LDH > 450U/L组为67.8%, 组间比较差异无统计学意义(χ2=1.062, P=0.303)。术后LDH下降组RR为48.4%, LDH升高组为44.4%, 组间比较差异无统计学意义(χ2=0.229, P=0.632);术后LDH下降组DCR为81.2%, LDH升高组为67.9%, 组间比较差异无统计学意义(χ2=3.294, P=0.070, 表 2、3)。
表 2 LDH≤450U/L和LDH>450U/L两组患者疗效分析Table 2. Objective response evaluated with mRECIST criteria between groups of patients: LDH major or minor of 450 U/L 表 3 TACE术后LDH升高和下降的两组患者疗效分析Table 3. Objective response evaluated with mRECIST criteria between groups of patients: LDH decreased or increased after treatment
表 3 TACE术后LDH升高和下降的两组患者疗效分析Table 3. Objective response evaluated with mRECIST criteria between groups of patients: LDH decreased or increased after treatment
2.3 生存情况
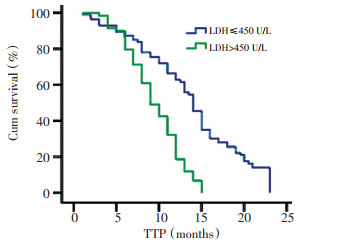
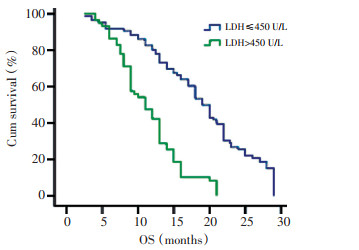
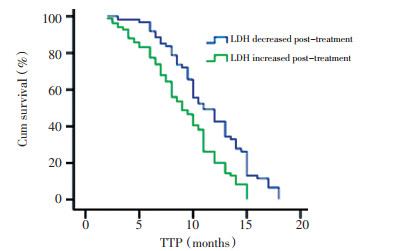
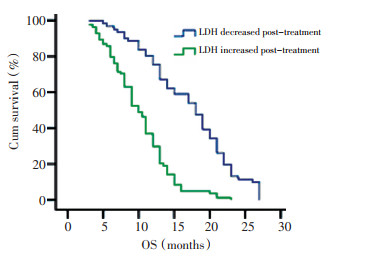
LDH≤450 U/L平均疾病进展时间(TTP)和OS分别为14.2、19.3个月, 而LDH > 450 U/L患者TTP和OS分别为9.1、11.2个月, 差异有统计学意义(P均 < 0.05, 图 1、2)。治疗后LDH值下降患者的平均TTP和中位OS分别11.3、18.8个月, 而治疗后LDH值升高患者的TTP为9.1个月, OS为9.8个月(TTP: P=0.001, OS: P=0.004, 图 3、4)。
3. 讨论
血清LDH是一项简便、价廉的检测项目, 在肿瘤患者的影像学检查未出现改变之前, 其作为细胞代谢敏感指标, 活性变化可提示缺氧、无氧酵解及恶性转化。LDH广泛存在于机体的各种组织中, 任何组织损伤都会导致LDH活性升高, 大多数肿瘤患者的糖酵解高于正常组织, 其代谢比较旺盛, 细胞坏死加快, 细胞膜的通透性增加等因素均可使癌组织酶释放人血, 导致血清LDH活性升高。LDH共有5种同工酶, 由H亚基和M亚基按不同比例组成, LDH5主要分布在肝脏, HCC时肝细胞无氧酵解增强, 表现为LDH5带活性增强[6, 7]。文献报道肝癌患者血清LDH总活力明显升高, 最高可达正常值6倍[8]。
大多数肝癌患者往往伴有慢性肝脏疾病, 这些因素严重影响患者临床治疗疗效, 因此有必要在治疗前对患者分层, 使不同的患者获得合适治疗策略。目前虽然存在许多分期系统, 但同一分期患者由于具有异质性, 其治疗方法也应不同。本研究中, 血清LDH水平可预测行TACE治疗肝癌患者TTP和OS。相关数据亦表明, LDH水平可以预测同一分期患者预后。
正常情况下, 血清乳酸脱氢酶的水平较低, 但在肿瘤等病理状态下出现细胞代谢紊乱时, 其释放入血致使含量大大增加, 故可反映肿瘤负荷大小, 对肿瘤性疾病的疗效、预后判断有重要价值。有研究表明不同类型肿瘤患者血清高LDH水平与不良预后相关。其中大肠癌患者中, 高LDH水平与淋巴结和远处转移关系密切, 是预后的危险因素[9, 10]。胃癌患者血清LDH高度表达, 尤其LDH-5亚型表达与病情进展关系比较密切[11]。高LDH与肿瘤缺氧和血管生成等机制关系比较密切。2项关于抑制血管和淋巴管生成酪氨酸激酶抑制剂瓦他拉尼(vatalanib, PTK/ZK)Ⅲ期临床研究表明LDH水平与肿瘤血管生成之间可能存在联系, 作为治疗晚期大肠癌一线和二线药物, 临床研究显示高血清LDH患者使用PTK/ZK能提高中位PFS, 从而表明, 肿瘤血管生成是高LDH水平患者预后不良重要因素[12, 13]。肝癌患者的VEGF可能通过促进血管生成等方式促进肿瘤生成, VEGF升高与肿瘤分级和生存期缩短明显相关[14], 术后使用索拉非尼等酪氨酸激酶抑制剂阻断肿瘤细胞增殖和血管形成, 从而抑制TACE后残存肿瘤生长及肿瘤侧枝循环的形成, 延长患者生存期。治疗前后血清LDH水平变化可能与肝癌患者预后相关。研究结果表明, 血清LDH水平变化受治疗方式的影响。Kohles等[15]研究表明治疗前血清LDH水平能预测接受TACE肝癌患者预后, 与本研究结果符合。
LDH检测方法简单, 易重复, 对治疗前LDH > 450U/L的患者应采用TACE联合血管抑制剂综合治疗, 而LDH≤450U/L者可寻求新的较温和的治疗方案, 能使中晚期肝癌患者取得更高的TTP和OS。经过分析确认后, 乳酸脱氢酶应被列入预测肝癌患者预后的临床变量, 可据其制定最合适治疗策略, 为实现原发性肝癌的个体化治疗提供参考。
-
表 1 两组患者一般临床资料比较
Table 1 Comparison of clinical variables between the two groups of patients

表 2 LDH≤450U/L和LDH>450U/L两组患者疗效分析
Table 2 Objective response evaluated with mRECIST criteria between groups of patients: LDH major or minor of 450 U/L

表 3 TACE术后LDH升高和下降的两组患者疗效分析
Table 3 Objective response evaluated with mRECIST criteria between groups of patients: LDH decreased or increased after treatment

-
[1] Montalto G, Cervello M, Giannitrapani L, et al. Epidemiology, riskfactors and natural history of hepatocellular carcinoma[J]. Ann N YAcad Sci, 2002, 96(3): 13-20.
[2] O'Suilleabhain CB, Poon RT, Yong JL, et al. Factors predictive of 5-year survival after transarterial chemoembolization for inopera ble hepatocellular carcinoma[J]. Br J Surg, 2003, 90(3): 325-331. DOI: 10.1002/bjs.4045
[3] Llovet JM, Di Bisceglie AM, Bruix J, et al. Design and Endpoints ofClinical Trials in Hepatocellular Carcinoma[J]. J Nat Cancer Inst, 2008, 100(10): 698-711. DOI: 10.1093/jnci/djn134
[4] Scartozzi M, Svegliati Baroni G, Faloppi L, et al. Trans-arterialchemo-embolization(TACE), with either lipiodol(traditionalTACE)or drug-eluting microspheres(precision TACE, pTACE)in the treatment of hepatocellular carcinoma: efficacy and safety re sults from alarge mono-institutional analysis[J]. J Exp Clin CancerRes, 2010, 29: 164. DOI: 10.1186/1756-9966-29-164
[5] Lencioni R, Llovet JM. Modified RECIST(mRECIST)assessmentfor hepatocellular carcinoma[J]. Semin Liver Dis, 2010, 30(1): 52-60. DOI: 10.1055/s-0030-1247132
[6] 雷鸣, 黄吉敢, 胡超杰. 原发性肝癌患者血清酶类指标变化的临床价值[J]. 现代肿瘤医学, 2010, 18(4): 765-766. DOI: 10.3969/j.issn.1672-4992.2010.04.48 [7] 赵斌, 赵经川, 李昭宇. AFP联合三项血清酶对原发性肝癌的诊断评价[J]. 宁夏医学杂志, 2010, 32(1): 20-21. DOI: 10.3969/j.issn.1001-5949.2010.01.008 [8] 张碧莲. 乳酸脱氢酶对恶性肿瘤的诊断意义[J]. 国际检验医学杂志, 2010, 6(10): 1172-1173. DOI: 10.3969/j.issn.1673-4130.2010.10.060 [9] Koukourakis MI, Giatromanolaki A, Sivridis E, et al. Prognosticand predictive role of lactate dehydrogenase 5 expression in colorec tal cancer patients treated with PTK787/ZK 222584(Vatalanib)an tiangiogenic therapy[J]. Clin Cancer Res 2011, 17(14): 4892-900.
[10] Wu XZ, Ma F, Wang XL. Serological diagnostic factors for livermetastasis in patients with colorectal cancer[J]. World J Gastroenter ol, 2010, 16(32): 4084-4088. DOI: 10.3748/wjg.v16.i32.4084
[11] Kolev Y, Uetake H, Takagi Y, et al. Lactate dehydrogenase-5(LDH-5)expression in human gastric cancer: association with hy poxia-inducible factor(HIF-1alpha)pathway, angiogenic factorsproduction and poor prognosis[J]. Ann Surg Oncol, 2008, 15(8): 2336-2344. DOI: 10.1245/s10434-008-9955-5
[12] Van Cutsem E, Bajetta E, Valle J, et al. Randomized, placebo-con trolled, phase Ⅲ study of oxaliplatin, fluorouracil, and leucovorinwith or without PTK787/ZK 222584 in patients with previouslytreated metastatic colorectal adenocarcinoma[J]. J Clin Oncol, 2011, 29(15): 2004-2010. DOI: 10.1200/JCO.2010.29.5436
[13] Hecht JR, Trarbach T, Hainsworth JD, et al. randomized, place bo-controlled, phase iii study of first-line oxaliplatin-based che motherapy plus PTK787/ZK222584, an oral vascular endothelialgrowth factor receptor inhibitor, in patients with metastatic colorectaladenocarcinoma[J]. J Clin Oncol, 2011, 29(15): 1997-2003. DOI: 10.1200/JCO.2010.29.4496
[14] Poon RT, Ho JW, Tong CS, et al. Prognostic significance of serumvascular endothelial growth factor and endostatin in patients withhepatocellular carcinoma[J]. Br J Surg, 2004, 91(10): 1354-1360. DOI: 10.1002/bjs.4594
[15] Kohles N, Nagel D, Jungst D, et al. Prognostic relevance of oncologi cal serum biomarkers in liver cancer patients undergoing chemoem bolization therapy[J]. Tumour Biol, 2012, 33(1): 33-40. DOI: 10.1007/s13277-011-0237-7



 下载:
下载: