In vitro application of anti-CD47 monoclonal antibody for targeted therapy of ovarian cancer
-
摘要:目的 探讨抗CD47单克隆抗体在体外对巨噬细胞吞噬卵巢癌细胞作用的影响。方法 收集天津医科大学附属肿瘤医院2011年6月至2011年12月手术切除的卵巢组织样本45例(包含卵巢癌组织样本39例, 正常卵巢组织样本6例), 获得的组织细胞通过流式细胞术分析CD47的表达水平, 通过细胞功能学实验观察抗CD47单克隆抗体在体外对小鼠巨噬细胞吞噬卵巢癌细胞的靶向治疗作用。结果 流式细胞术分析显示, 卵巢癌细胞系SKOV-3细胞和卵巢癌组织细胞中CD47表达水平均明显高于正常人卵巢上皮细胞, 差异具有统计学意义(P < 0.01), 且与疾病的分化程度相关(P < 0.05)。细胞功能学实验结果显示, 抗CD47单克隆抗体在体外可促进巨噬细胞对卵巢癌细胞的吞噬作用, 各实验组(1μg/mL、5μg/mL、10μg/mL、20μg/mL)分别较空白对照组吞噬指数显著增加, 并且随抗体浓度的增加吞噬指数呈浓度依赖性, 差异均具有统计学意义(P < 0.01)。统计学分析显示, 10μg/mL浓度组吞噬指数达到峰值, 同20μg/mL浓度组吞噬指数无显著性差异(P > 0.05)。结论 CD47高表达于卵巢癌组织细胞, 且与组织分化程度相关。抗CD47单克隆抗体在体外可促进巨噬细胞对卵巢癌肿瘤细胞的吞噬作用, 为卵巢癌的靶向治疗提供了实验依据。Abstract:Objective CD47 is highly expressed on human ovarian cancer cell surface and is a ligand for signal-regulatory protein alpha(SIRPα).The CD47-SIRPα pathway has been found to negatively regulate macrophage phagocytosis.We hypothesize that this pathway enables ovarian cancer cells to escape during tumor immunosurveillance.CD47 is highly expressed in various malignant diseases.This study aimed to explore whether CD47 can serve as a potential therapeutic target for ovarian cancer.Methods Tissue samples were obtained from 39 epithelial ovarian cancer patients.Six patients underwent other operations during which normal ovarian tissue samples were obtained.The expression of CD47 in the ovary cancer cell line SKOV-3 in normal ovarian tissues and ovarian cancer cells were analyzed by quantitative fluorescence-activated cell sorting.Macrophages and CFSE-labeled SKOV-3 cells were co-cultured with the indicated antibodies through in vitro phagocytosis assay, and phagocytic index was calculated.Results Flow cytometry showed that the expression levels of CD47 in the ovarian cancer cell line SKOV-3 and ovarian cancer cells were significantly higher than in normal ovarian epithelial cells(P < 0.01).This result is associated with the grade of differentiation of the disease(P < 0.05).Blocking a monoclonal antibody against CD47 promotes in vitro phagocytosis of ovarian cancer cells by macrophages.The phagocytic index of the experimental groups(1, 5, 10, and 20 μg/ml) increased significantly(P < 0.01) compared with the control group.The occurrence was found to be concentration-dependent(P < 0.01).Statistical analysis showed that the maximum phagocytic index was found in the 10 μg/ml concentration group; the same was observed in the 20 μg/ml group.However, no significant difference was found between the two groups(P > 0.05).Conclusion CD47 is expressed in epithelial ovarian cancer cells at a higher level compared with normal ovarian cells.The level of expression is associated with tissue differentiation grade.Our study indicates that the anti-CD47 monoclonal antibody can significantly promote in vitro phagocytosis, indicating that the anti-CD47 monoclonal antibody might be a potential target in targeted cancer therapy.
-
Keywords:
- ovarian cancer /
- targeting therapy /
- macrophage /
- CD47 /
- monoclonal antibody
-
卵巢癌是女性生殖器官常见的肿瘤之一, 其发病率居第3位, 但死亡率却高居首位。尽管在现有的治疗中, 经过肿瘤细胞减灭术和化疗等治疗手段在短期中得到有效缓解, 但80%~85%患者会出现耐药及复发, 最终导致临床治疗的失败[1-2]。而其治疗的最大障碍是肿瘤细胞耐药性的产生, 深入研究卵巢癌肿瘤细胞的生物学行为及发现新的靶向药物对卵巢癌的治疗具有重要意义。CD47是抑制性受体信号调节蛋白α(SIRPα)的胞外配体, 二者结合通过产生抑制性信号降低巨噬细胞的吞噬活性, 从而产生肿瘤的免疫逃逸。既往在白血病、乳腺癌、膀胱癌、非霍奇金淋巴瘤等恶性肿瘤的研究中发现CD47呈高表达状态, 应用抗CD47单克隆抗体能够特异性的作用于肿瘤细胞促进巨噬细胞的吞噬作用。然而, 应用抗CD47单克隆抗体对卵巢癌是否具有靶向治疗作用目前尚处于初步研究, 因此本研究从体外实验为卵巢癌的靶向治疗提供实验依据。
1. 材料与方法
1.1 材料
收集天津医科大学附属肿瘤医院2011年6月至2011年12月手术切除的卵巢组织标本45例, 均经病理检查确诊, 其中卵巢癌组织39例, 正常卵巢组织6例。按卵巢癌组织分化程度: 高分化8例, 中分化8例, 低分化23例; 按FIGO标本临床分期: Ⅰ~Ⅱ期7例, Ⅲ~Ⅳ期32例。所有病例经患者知情同意, 签署知情同意书。
昆明品系小鼠、人卵巢癌细胞系SKOV-3均由天津市肿瘤防治重点实验室提供。鼠抗人CD47单克隆抗体、鼠抗人HLA单克隆抗体、鼠Ig G1同型对照抗体(BD Pharmingen, 美国), CFSE(e Bioscience, 美国), 胶原酶Ⅱ、透明质酸酶(Sigma, 美国), 红细胞裂解液(Stem cell, 加拿大), 胎牛血清(Hyclone, 美国), DMEM培养基(Gibco, 美国), 24孔板(Costar, 美国)。荧光倒置显微镜及照相系统(Nikon, 日本), 流式细胞仪(BD ARIRⅡ, 美国)。
1.2 方法
1.2.1 细胞获得/培养
人卵巢组织细胞的获得: 临床手术取得的正常卵巢组织和卵巢癌组织于超净台中, 将组织剪成碎片后加入300 U/m L的胶原酶Ⅱ和透明质酸酶, 于℃水浴箱中消化~, 经PBS缓冲液冲洗、通过70μm滤器获得单细胞悬液备流式分析用。小鼠巨噬细胞的获得/培养: 脱颈处死6~8周龄昆明品系小鼠, 经75%酒精浸泡后向腹腔注入无血清DMEM培养液, 静置5~7 min后无菌条件下切开小鼠腹腔, 用注射器抽取腹腔液经离心洗涤后显微镜下计数, 调整细胞密度至5×104个/m L接种于含完全培养基的24孔板内, 置于37℃、5%CO2培养箱中培养2 h后备实验用。
1.2.2 流式细胞术检测CD47的表达
将上述获得的卵巢组织单细胞细胞悬液经PBS-EDTA缓冲液(PBE)清洗去除上清, 用100μL PBE重悬细胞制成两份标本。一份标本(空白管)不加抗体用作空白对照; 另一份标本(样品管)加入鼠抗人CD47-FITC单克隆抗体5μL, 混匀, 4℃孵育30 min; PBE清洗1次, 重悬于0.5 m L PBE中用于流式分析检测(计数105个细胞用于分析)。
1.2.3 细胞功能实验
制备人卵巢癌细胞系SKOV-3单细胞悬液, 将显示绿色荧光的CFSE(1μm/m L, 严格按照说明书避光操作)标记于SKOV-3细胞上, 调整细胞密度至2×105个/m L接种于上述备实验用的巨噬细胞中。加入功能实验用鼠抗人CD47单克隆抗体、鼠抗人HLA单克隆抗体、鼠Ig G1同型对照抗体于孵箱中与小鼠巨噬细胞共培养2 h, 吸弃上清液, PBS清洗2次, 于荧光显微镜下计数被吞噬的肿瘤细胞。结果判断: 吞噬指数=被吞噬的CFSE标记的卵巢癌细胞/100个巨噬细胞。
1.3 统计学方法
应用SPSS 17.0软件进行统计分析。计量资料以均数±标准差(x±s)表示, 两样本均数的比较采用t检验, 多样本均数采用方差分析。检验水准α=0.05。
2. 结果
2.1 不同卵巢组织细胞中CD47的表达水平及其与临床病理参数的关系
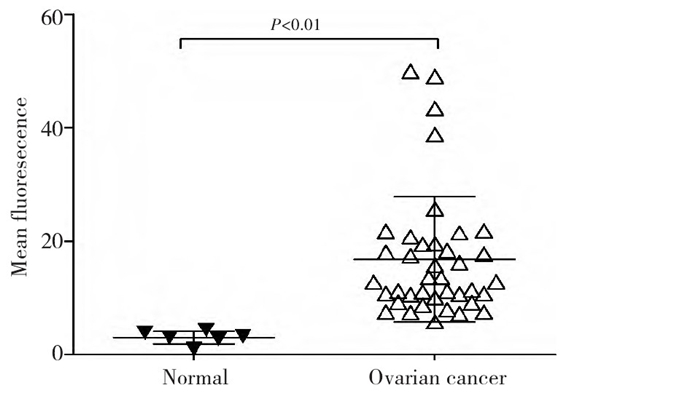
流式细胞仪结果分析显示, 正常人卵巢上皮细胞中CD47呈低表达, 卵巢癌组织细胞和SKOV-3中CD47呈高表达, 均高于正常人卵巢上皮细胞, 差异具有统计学意义(P < 0.01, 表 1, 图 1)。分析CD47表达水平与临床病理参数的关系可见其与患者的年龄、病理类型、临床分期无统计学意义, 与分化程度相关, 差异具有统计学意义(P=0.046, 表 2)。
表 1 不同卵巢细胞中CD47表达水平的差异Table 1. Expression of CD47 in different kinds of ovarian cells 表 2 卵巢癌组织细胞CD47表达水平与临床病理参数的关系Table 2. Relationship of the expression of CD47 in ovarian cancer cells with clinicopathologic features
表 2 卵巢癌组织细胞CD47表达水平与临床病理参数的关系Table 2. Relationship of the expression of CD47 in ovarian cancer cells with clinicopathologic features
2.2 抗CD47单克隆抗体对巨噬细胞的促进吞噬作用
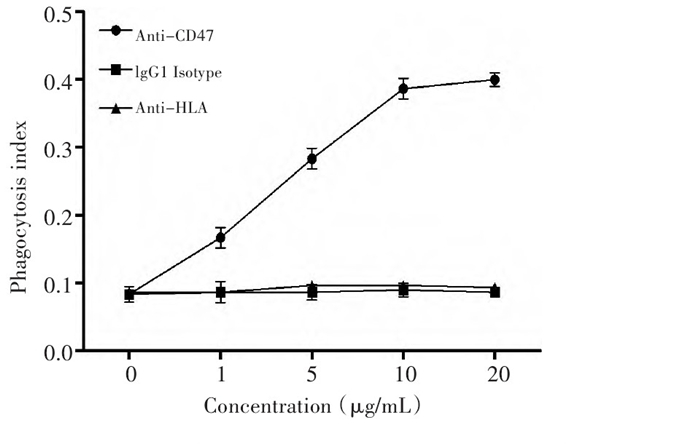
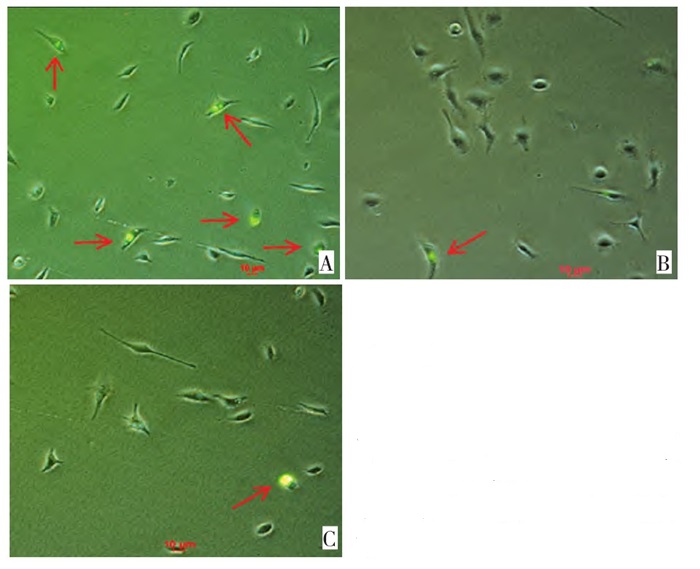
小鼠巨噬细胞与卵巢癌肿瘤细胞共培养的体外实验表明, 抗CD47单克隆抗体可明显促进巨噬细胞对卵巢癌肿瘤细胞的吞噬作用, 同抗体本身的作用及HLA抗体机制介导的免疫作用无关。随着所用抗体浓度的改变, 其吞噬指数呈明显的剂量依赖关系(图 2)。5μg/m L抗CD47组巨噬细胞的吞噬指数(0.28±0.02)较对照组增加, 明显强于1μg/m L抗CD47组0.17±0.02, 差异具有统计学意义(P < 0.01)。同样, 10μg/m L抗CD47组巨噬细胞的吞噬指数(0.39±0.02)较对照组增加, 明显强于5μg/m L抗CD47组, 差异具有统计学意义(P < 0.01)。20μg/m L抗CD47组巨噬细胞的吞噬指数(0.40±0.01)较对照组增加, 与10μg/m L抗CD47组对巨噬细胞的促吞噬作用比较无显著性差异(P=0.235)。荧光显微镜下清晰的看出CFSE标记的卵巢癌细胞系SKOV-3细胞被小鼠巨噬细胞吞噬(图 3)。
3. 讨论
CD47又称整合素相关蛋白, 广泛表达于机体各类细胞表面, 是抑制性受体人信号调节蛋白α(signal-regulatory protein alpha, SIRPα)的胞外配体, 而SIRPα主要表达于巨噬细胞、树突状细胞和神经细胞表面, CD47与SIRPα结合引起SIRPα中酪氨酸磷酸化, 传导抑制性信号即“别吃我”信号而降低巨噬细胞的吞噬活性, 从而对固有免疫系统产生抑制作用[3-5]。本研究结果不但证实CD47在卵巢癌组织细胞呈现高表达状态, 与已研究的结果相一致[6], 并且进一步证实其与卵巢癌的分化程度相关。流式细胞仪结果分析显示, 在卵巢癌组织细胞和SKOV-3细胞中的表达, 均高于正常人卵巢上皮细胞, 差异具有统计学意义(P < 0.01), 并且同卵巢癌的分化程度相关(P < 0.05), 提示CD47的表达水平与肿瘤的恶性程度具有相关性。然而统计分析表明CD47的表达水平同卵巢癌的临床分期无显著关系(P > 0.05), 可能与本实验样本量尚不充足有关, 后续需扩大样本量行进一步分析。而进一步体外细胞功能学实验结果表明, 应用抗CD47单克隆抗体在荧光显微镜下可清晰的看出经CFSE标记的卵巢癌细胞系SKOV-3肿瘤细胞被小鼠巨噬细胞吞噬。通过计算吞噬指数, 与对照组相比, 实验组应用抗CD47单克隆抗体后巨噬细胞的吞噬作用得到显著增强, 差异具有统计学意义(P < 0.01)。并且随着所用抗体浓度的改变, 其吞噬指数呈明显的剂量依赖关系, 即抗体浓度越高, 吞噬指数越大, 吞噬功能越强, 当抗体浓度为10μg/m L时吞噬功能达到峰值, 这可能与抗体浓度达到饱和的状态有关。
因此, 本研究结果证实CD47与卵巢癌肿瘤细胞的抗巨噬细胞吞噬作用有着显著的关系, 应用抗CD47单克隆抗体能够显著增强巨噬细胞的吞噬作用, 同抗体本身的作用及HLA抗体机制介导的免疫作用无关(P < 0.01), 由此可见在卵巢癌中肿瘤细胞逃避机体免疫系统的杀伤也是通过CD47-SIRPα这一通路的介导实现的。既往在白血病[7]、膀胱癌[8]、乳腺癌[9]、非霍奇金淋巴瘤[10]等恶性肿瘤的研究中表明CD47的高表达状态同疾病的预后呈负相关, 而应用抗CD47单克隆抗体能够特异性的作用于肿瘤细胞促进巨噬细胞的吞噬作用从而获得了可喜的成果。应用抗CD47单克隆抗体可明显增强巨噬细胞对人白血病干细胞的吞噬作用[7, 11-12]; 在膀胱癌的体外实验中, 应用CD47单克隆抗体可明显促进巨噬细胞的吞噬活性[8]; 在移植人非霍奇金淋巴瘤的免疫缺陷小鼠上, 应用抗CD47单克隆抗体可显著降低淋巴瘤的负荷并延长总的存活期, 而联合应用利妥昔单抗治疗时甚至能够使淋巴瘤消失而获得治愈[10, 13]。由此可见应用CD47单克隆抗体在肿瘤的靶向治疗中显示了强大的治疗作用, 为肿瘤治疗的发展带来了新的曙光[14-15]。
本研究于体外实验证实, 应用抗CD47单克隆抗体可显著增强巨噬细胞对卵巢癌肿瘤细胞的吞噬作用, 而在体内实验中应用抗CD47单克隆抗体是否能够同样取得显著的效果尚需要进一步的研究证实。因此本研究结果为后续的实验研究提供了的实验依据和基础。
期待抗CD47单克隆抗体的应用给卵巢癌的治疗带来新的转折点, 为卵巢癌的靶向治疗提供新的探索方向。
-
表 1 不同卵巢细胞中CD47表达水平的差异
Table 1 Expression of CD47 in different kinds of ovarian cells

表 2 卵巢癌组织细胞CD47表达水平与临床病理参数的关系
Table 2 Relationship of the expression of CD47 in ovarian cancer cells with clinicopathologic features

-
[1] Kobayashi E, Ueda Y, Matsuzaki S, et al. Biomarkers for screening, diagnosis, and monitoring of ovarian cancer[J]. Cancer EpidemiolBiomarkers Prev, 2012, 21(11): 1902-1912.
[2] Chan A, Gilks B, Kwon J, et al. New insights into the pathogenesisof ovarian carcinoma: time to rethink ovarian cancer screening[J]. Obstet Gynecol, 2012, 120(4): 935-940. DOI: 10.1097/AOG.0b013e318269b8b1
[3] Matozaki T, Murata Y, Okazawa H, et al. Functions and molecularmechanisms of the CD47-SIRPalpha signalling pathway[J]. TrendsCell Biol, 2009, 19(2): 72-80.
[4] Zhao XW, van Beek EM, Schornagel K, et al. CD47-signal regula tory protein-alpha(SIRPalpha)interactions form a barrier for anti body-mediated tumor cell destruction[J]. Proc Natl Acad Sci U SA, 2011, 108(45): 18342-18347. DOI: 10.1073/pnas.1106550108
[5] Olsson M, Nilsson A, Oldenborg PA. Target cell CD47 regulatesmacrophage activation and erythrophagocytosis[J]. Transfus ClinBiol, 2006, 13(1-2): 39-43.
[6] Campbell IG, Freemont PS, Foulkes W, et al. An ovarian tumormarker with homology to vaccinia virus contains an IgV-like re gion and multiple transmembrane domains[J]. Cancer Res, 1992, 52(19): 5416-5420.
[7] Majeti R, Chao MP, Alizadeh AA, et al. CD47 is an adverse prog nostic factor and therapeutic antibody target on human acute my eloid leukemia stem cells[J]. Cell, 2009, 138(2): 286-299. DOI: 10.1016/j.cell.2009.05.045
[8] Chan KS, Espinosa I, Chao M, et al. Identification, molecular char acterization, clinical prognosis, and therapeutic targeting of humanbladder tumor-initiating cells[J]. Proc Natl Acad Sci U S A, 2009, 106(33): 14016-14021. DOI: 10.1073/pnas.0906549106
[9] Nagahara M, Mimori K, Kataoka A, et al. Correlated expression ofCD47 and SIRPA in bone marrow and in peripheral blood predictsrecurrence in breast cancer patients[J]. Clin Cancer Res, 2010, 16(18): 4625-4635. DOI: 10.1158/1078-0432.CCR-10-0349
[10] Chao MP, Alizadeh AA, Tang C, et al. Anti-CD47 antibody syner gizes with rituximab to promote phagocytosis and eradicatenon-Hodgkin lymphoma[J]. Cell, 2010, 142(5): 699-713.
[11] Chao MP, Alizadeh AA, Tang C, et al. Therapeutic antibody target ing of CD47 eliminates human acute lymphoblastic leukemia[J]. Cancer Res, 2011, 71(4): 1374-1384. DOI: 10.1158/0008-5472.CAN-10-2238
[12] Majeti R. Monoclonal antibody therapy directed against human acutemyeloid leukemia stem cells[J]. Oncogene, 2011, 30(9): 1009-1019. DOI: 10.1038/onc.2010.511
[13] Chao MP, Tang C, Pachynski RK, et al. Extranodal disseminationof non-Hodgkin lymphoma requires CD47 and is inhibited by an ti-CD47 antibody therapy[J]. Blood, 2011, 118(18): 4890-4901. DOI: 10.1182/blood-2011-02-338020
[14] Chao MP, Weissman IL, Majeti R. The CD47-SIRPalpha pathwayin cancer immune evasion and potential therapeutic implications[J]. Curr Opin Immunol, 2012, 24(2): 225-232. DOI: 10.1016/j.coi.2012.01.010
[15] Kim D, Wang J, Willingham SB, et al. Anti-CD47 antibodies pro mote phagocytosis and inhibit the growth of human myeloma cells[J]. Leukemia, 2012, 26(12): 2538-2545. DOI: 10.1038/leu.2012.141



 下载:
下载: