Clinicopathologic characteristics and prognostic factors of 63 gastric cancer patients with metachronous ovarian metastasis
-
摘要:目的 探讨胃癌异时性卵巢转移患者的临床病理特征及影响预后的因素。方法 收集1999年1月至2011年12月中国医学科学院肿瘤医院收治的63例胃癌术后异时性卵巢转移患者的临床病理资料, 采用Log rank检验分析生存情况, 单因素分析可能影响预后的因素, 多因素分析采用Cox回归模型。结果 本组胃癌术后卵巢转移发生率为3.4%(63/1 856), 平均年龄45岁, 65.1%(41/63)为绝经前患者, 卵巢转移与原发癌间隔时间平均为16个月; 原发胃癌以低分化癌为主, 87.3%(55/63)侵犯浆膜, N2~3淋巴结转移者占68.3%(43/63);85.7%(54/63)为双侧卵巢转移, 73.0%(46/63)同时合并腹膜转移, 31.7%(20/63)行转移病灶完全切除。全组中位生存期13.6个月, 1、2、3年生存率分别为52.5%、22.0%和9.8%, 5年生存率为0。单因素分析结果显示, 腹膜种植转移、脉管瘤栓、病灶切除范围以及辅以化疗的综合治疗模式为影响患者预后的相关因素(均P < 0.05)。多因素分析结果显示, 腹膜种植转移是影响胃癌卵巢转移患者预后的独立危险因素(P < 0.01)。结论 有效防治腹膜种植转移是改善胃癌卵巢转移患者预后的关键。Abstract:Objective This work aimed to explore the clinicopathologic characteristics and prognostic factors of gastric cancer patients with metachronous ovarian metastasis.Methods The clinicopathologic data of 63 post-operative gastric cancer patients with the complication of metachronous ovarian metastasis were collected.The patients were admitted to the Cancer Institute and Hospital, Chinese Academy of Medical Science and Peking Union Medical College, Beijing from January 1999 to December 2011.Log-rank test was conducted for survival analyses.Univariate analysis was used for possible prognostic factors affecting the survivals.Cox regression model was used for multivariate analysis.Results The incidence of ovarian metastasis was 3.4% with a mean age of 45 years.Among all patients, 65.1% were pre-menopausal.The mean time interval between ovarian metastasis and primary cancer was 16 months.Low-differentiated carcinoma ranked first in the primary gastric cancers.The majority of lesions occurred in the serous membrane(87.3%).The metastatic sites included N2-3 lymph node(68.3%), bilateral ovaries(85.7%), and peritoneal membrane(73%).Total resection of metastasized sites was performed(31.7%).The overall median survival was 13.6 months, whereas the overall 1-, 2-, and 3-year survival rates were 52.5%, 22.0%, and 9.8%, respectively.The 5-year survival rate was zero.Univariate analysis showed that the patient's prognosis was correlated with peritoneal seeding metastasis, vascular tumor embolus, range of lesion excision, and mode of comprehensive treatment with adjuvant chemotherapy(P < 0.05).Multivariate analysis indicated that peritoneal seeding metastasis was an independent prognostic factor for gastric cancer patients with ovarian metastasis(P < 0.01).Conclusion Effective control of peritoneal seeding-induced metastasis is important in improving the prognosis of the gastric cancer patients with ovarian metastasis.
-
Keywords:
- gastric neoplasms /
- ovary /
- metastasis /
- prognosis
-
胃癌是最常见的恶性肿瘤之一, 虽然近年来诊疗水平有明显提高, 但仍有约50%的患者在根治术后出现复发及远处转移。卵巢是许多恶性肿瘤常见的转移部位, 女性胃癌患者术后卵巢转移发生率为2.7%~6.7%[1-2], 但尸检结果卵巢转移率为33%~41%[3-4]。目前针对胃癌卵巢转移尚缺乏有效的治疗方法, 且相关报道不多, 尤其是胃癌术后异时性卵巢转移的研究较少。本研究通过回顾性分析本院收治的胃癌卵巢转移患者的临床资料, 进一步探讨其临床病理特点、治疗方法及预后。
1. 材料与方法
1.1 一般资料
1999年1月至2011年12月中国医学科学院肿瘤医院共收治根治性手术治疗的女性胃癌患者1 856例, 其中经二次手术病理证实的异时性卵巢转移63例, 平均年龄45(21~70)岁, 其中9例原发胃癌在外院手术切除, 病理资料为借阅外院组织标本的会诊结果, 其余54例均为本院手术标本的病理诊断。本组原发胃癌病灶位于胃窦40例, 胃体18例, 贲门胃底5例。卵巢转移瘤单侧9例, 双侧54例, 常见临床表现为下腹部疼痛、腹部包块、阴道不规则流血等。
1.2 诊疗方法
主要诊断方法包括胃镜、B超、CT、核磁共振等, 肿瘤标志物检查包括CEA、CA199、CA724、CA125。本组患者均接受胃癌及卵巢转移癌手术治疗, 原发癌行远端胃大部切除43例, 近端胃大部切除4例, 全胃切除16例; 卵巢转移瘤根据病变范围行病灶完全切除20例, 因腹膜广泛转移行姑息切除43例; 其中单侧切除9例, 双侧切除54例, 合并子宫切除21例, 合并局限性腹膜转移灶切除3例。辅助治疗包括卵巢转移癌术后化疗。化疗药物主要为氟尿嘧啶、奥沙利铂/顺铂、亚叶酸钙、多烯紫杉醇等。
1.3 随访
本组病例均获得随访, 主要通过门诊复查、电话、随访信等方式。记录的生存时间从确诊卵巢转移开始至死亡时间或末次随访时间。
1.4 统计学方法
所有数据应用SPSS 17.0软件统计包进行统计学分析。生存率根据Kaplan-Meier法计算, Log rank检验分析组间生存率的差异; 采用Cox回归模型进行多因素预后分析。P < 0.05为差异有统计学意义。
2. 结果
2.1 临床及病理特征
本研究1 856例手术切除的女性胃癌患者中63例发生异时性卵巢转移, 发生率3.4%。转移时间距胃癌术后间隔2个月至20年, 平均时间16个月。本组年龄≤50岁者46例(73.0%), 41例(65.1%)为绝经前患者。卵巢转移患者均通过原发癌术后出现相应症状或常规复查时经影像学检查明确诊断。本组18例卵巢转移病灶影像结果表现为囊性或囊实性病变, 其中6例(9.5%)在胃癌术后早期常规复查行B超/CT时误将卵巢转移诊断为生理性增大。本组有39例患者行相关血清肿瘤标志物检查, 其中CEA阳性率18.0%(7/39), CA199阳性率38.5%(15/39), CA724阳性率23.1%(9/39), CA125阳性率61.5%(24/39), 前三项中任意一项与CA125同时升高者20例占51.3%, 标志物检查均为阴性者11例占28.2%。
病理结果显示, 原发胃癌以低分化癌为主, 占84.1%(53/63), 其中55例(87.3%)侵犯浆膜, N2~3淋巴结转移者占68.3%(43/63)。卵巢转移灶病理类型: 印戒细胞癌38例, 管状腺癌21例, 黏液腺癌4例; 单侧转移9例, 双侧转移54例; 肿瘤直径2~20 cm, 平均直径8.4 cm, 直径 > 10 cm者19例; 脉管瘤栓28例, 46例占73.0%, 合并腹膜种植转移。
2.2 随访结果
随访日期自1999年1月至2012年10月, 总体中位生存期13.6个月, 死亡49例, 全组1、2、3年生存率分别为52.5%、22.0%和9.8%, 5年生存率为0。
2.3 影响预后因素分析
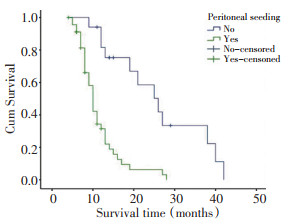
单因素生存分析结果表明, 腹膜种植、转移病灶脉管瘤栓、病灶切除范围以及辅以化疗的治疗模式为影响患者预后的相关因素(均P < 0.05), 年龄、月经史、胃癌淋巴结转移、转移病灶与原发病灶间隔时间、转移灶大小、转移部位以及转移灶病理组织学类型均与预后无明显相关性(表 1)。Cox回归模型多因素分析结果显示, 腹膜种植转移是影响胃癌卵巢转移患者预后的独立危险因素, 无腹膜种植的胃癌卵巢转移患者与伴有腹膜种植转移的患者相比, 生存期明显延长(P < 0.01, 表 2, 图 1)。
表 1 影响胃癌卵巢转移患者预后的单因素分析Table 1. Univariate analyses of prognostic factors for patients with ovary metastasis of gastric carcinoma 表 2 影响胃癌卵巢转移患者预后的多因素分析Table 2. Multi-factorial analyses of prognostic factors for patients with ovarian metastasis of gastric carcinoma
表 2 影响胃癌卵巢转移患者预后的多因素分析Table 2. Multi-factorial analyses of prognostic factors for patients with ovarian metastasis of gastric carcinoma
3. 讨论
来源于胃癌的卵巢转移瘤又被称为Krukenberg瘤, 是1896年由德国病理学家Friedrich Ernst Krukenberg首先报道而得名。胃癌卵巢转移的发生率报道均不同, 本研究12年来经病理证实的异时性卵巢转移发生率为3.4%。由于本研究未纳入同时性转移及非手术病例, 因此卵巢转移实际发生率应高于本统计结果。
卵巢转移的发生机制尚未明确, 一般认为有淋巴结转移、血行转移和种植转移三种可能途径。研究认为卵巢网状淋巴组织丰富, 癌细胞可经腹膜后淋巴结转移到腰部淋巴结并逆行转移到卵巢, 被认为是最有可能的转移方式[5]。Kim等[2]对690例女性胃癌患者进行多因素分析显示卵巢转移发生率与胃癌淋巴结转移程度密切相关, 有6枚以上淋巴结转移的患者更易发生卵巢转移。本组病例中原发肿瘤转移淋巴结为N2~3者占68.3%, 显著高于淋巴结转移N0~1者。Yamanishi等[6]通过免疫组织化学染色方法发现57.0%的卵巢转移癌有淋巴管受侵, 进一步证明了卵巢经淋巴途径转移的理论。血行转移的观点近来得到越来越多的支持, 绝经前功能活跃的卵巢由于高激素水平及丰富血供, 为转移瘤提供了更适宜生长的环境, 因此, 绝经前的年轻患者更易发生卵巢转移[7]。当胃癌侵犯浆膜时, 癌细胞可脱落至腹腔, 通过排卵时形成的裂孔进入卵巢, 从而形成种植性转移。种植性转移通常伴随腹膜广泛播散, 导致预后不良[8]。本组患者主要是通过这种途径转移至卵巢, 合并腹膜种植播散者占73.0%, 这也是导致本组患者预后较差的主要原因。实际上, 由于原发胃癌多为进展期, 因此多种转移途径有可能并存。
研究发现转移性肿瘤往往较大, 平均直径9 cm左右, 而原发性卵巢癌通常较小[9]。本组患者中肿瘤平均直径8.4 cm, 超过10 cm者占30.2%(19/63), 这表明早期发现卵巢转移并不容易。Koyama等[10]认为B超、CT、MR等检查可早期发现无症状转移病灶, 对于实性、分叶状及对比强化的卵巢内病变应警惕有转移可能。然而, 本组病例中近28.6%(18/63)患者B超及CT检查提示肿瘤为囊性或囊实性, 且有6例在转移早期被误诊为卵巢生理性增大, 从而未能进行及早治疗。因此, 不管是囊性或实性改变, 若卵巢异常增大应引起重视。Yada-Hashimoto等[4]认为CA125在短期内快速升高可作为判断卵巢肿瘤的辅助检查指标, 并有助于早期发现Krukenberg瘤。本组患者中多数在胃癌术后复查时仅做CEA、CA199或CA724等消化道肿瘤标志物检查, 其中39例在发现卵巢病变时才同时检查CA125, 结果显示CA125升高者占61.5%, 高于其他任何一种标志物的阳性率, 这表明CA125检查确实有助于发现Krukenberg瘤。因此建议外科医生对于女性胃癌患者术后复查时应常规检测CA125。
胃癌卵巢转移属于Ⅳ期, 预后极差, 以前多主张采用化疗而非手术治疗, 而其预后差的主要原因之一是常伴发腹、盆腔肿瘤广泛种植转移[11-12]。近年来随着诊疗技术的进步以及术后随访检查制度的完善, 使得部分患者在卵巢转移初期即被发现并可通过切除肿瘤延长生存期。Jun等[13]的一组数据显示, 胃癌卵巢转移患者二次手术后平均生存期为18.8个月, 其中转移病灶完全切除患者的生存期达23.7个月, 早期确诊和彻底切除转移病灶认为可提高患者生存率。Cheong等[14]研究分析34例卵巢转移的临床资料, 结果显示转移病灶能够完全切除的患者, 其预后明显优于术后有肿瘤残存的患者。本组单因素分析显示, 病灶完全切除患者的中位生存期较姑息性病灶切除者明显延长, 与预后有一定相关性, 但多因素分析显示病灶切除范围并不是影响预后的独立危险因素。
本组患者中位生存期为13.6个月, 1、2、3年生存率分别为52.5%、22.0%和9.8%, 预后较差, 主要原因是多数患者同时合并腹腔种植转移, 仅有32%的患者能够做到病灶完全切除, 多因素分析显示, 腹膜种植转移是影响本组患者预后唯一的独立危险因素。多数研究[7, 9, 11-12]认为肿瘤转移范围及能否根治性切除是影响预后的主要因素, 这表明若患者同时出现腹膜广泛种植转移, 则外科手术将不能改善其预后。Jacquet等[15]研究发现CT对于术前诊断腹膜种植转移的准确率仅为50%。近年来腹腔镜探查已普遍用于评估进展期肿瘤的可切除性, 结合影像学检查, 可以较为准确地甄选适合手术切除的卵巢转移患者[12, 16]。目前针对腹腔播散转移尚缺乏有效的治疗方法, 对于结直肠癌患者行细胞减灭术的报道较多, 并证明可有效延长生存期, 而胃癌患者行细胞减灭术的研究较少, Bozzetti等[17]的一组数据显示, 其中位生存期仅为8~11个月, 手术死亡率为2%~7.1%。近年, 有研究显示, 腹腔热灌注化疗可防治腹膜种植转移, 同时联合肿瘤细胞减灭术可提高某些腹膜转移患者的生存率[18]。
总之, 对于女性绝经前胃癌患者术后应警惕卵巢复发转移, 在影像学检查的同时应将CA125作为常规术后复查的指标, 做到早发现、早治疗。此外, 预防和有效治疗腹膜广泛种植转移是提高患者生存率的关键。
-
表 1 影响胃癌卵巢转移患者预后的单因素分析
Table 1 Univariate analyses of prognostic factors for patients with ovary metastasis of gastric carcinoma

表 2 影响胃癌卵巢转移患者预后的多因素分析
Table 2 Multi-factorial analyses of prognostic factors for patients with ovarian metastasis of gastric carcinoma

-
[1] Kobayashi O, Sugiyama Y, Cho H, et al. Clinical and pathologicalstudy of gastric cancer with ovarian metastasis[J]. Int J Clin Oncol, 2003, 8(2): 67-71. DOI: 10.1007/s101470300012
[2] Kim NK, Kim HK, Park BJ, et al. Risk factors for ovarian metastasis following curative resection of gastric adenocarcinoma[J]. Cancer, 1999, 85(7): 1490-1499.
[3] Wang J, Shi YK, Wu LY, et al. Prognostic factors for ovarian metastases from primary gastric cancer[J]. Int J Gynecol Cancer, 2008, 18(4): 825-832. DOI: 10.1111/j.1525-1438.2007.01078.x
[4] Yada-Hashimoto N, Yamamoto T, Kamiura SS, et al. Metastaticovarian tumors: a review of 64 cases[J]. Gynecol Oncol, 2003, 89(2): 314-317. DOI: 10.1016/S0090-8258(03)00075-1
[5] Al-Agha OM, Nicastri AD. An in-depth look at Krukenberg tumor: an overview[J]. Arch Pathol Lab Med, 2006, 130(11): 1725-1730. DOI: 10.5858/2006-130-1725-AILAKT
[6] Yamanishi Y, Koshiyama M, Ohnaka M, et al. Pathways of metastases from primary organs to the ovaries[J]. Obstet Gynecol Int, 2011, 612817.
[7] Yook JH, Oh ST, Kim BS. Clinical prognostic factors for ovarian metastasis in women with gastric cancer[J]. Hepatogastroenterology, 2007, 54(75): 955-959.
[8] Sodek KL, Murphy KJ, Brown TJ, et al. Cell-cell and cell-matrix dynamics in intraperitoneal cancer metastasis[J]. Cancer Metastasis Rev, 2012, 31(1-2): 397-414. DOI: 10.1007/s10555-012-9351-2
[9] Kobayashi O, Sugiyama Y, Cho H, et al. Clinical and pathologicalstudy of gastric cancer with ovarian metastasis[J]. Int J Clin Oncol, 2003, 8(2): 67-71. DOI: 10.1007/s101470300012
[10] Koyama T, Mikami Y, Saga T, et al. Secondary ovarian tumors: spectrum of CT and MR features with pathologic correlation[J]. Abdom Imaging, 2007, 32(6): 784-795. DOI: 10.1007/s00261-007-9186-4
[11] Sharma K, Rathi AK, Sood G, et al. Metastatic ovarian tumour inpatient of carcinoma stomach[J]. Trop Gastroenterol, 2008, 29(2): 112-113.
[12] Jiang R, Tang J, Cheng X, et al. Surgical treatment for patients with different origins of Krukenberg tumors: outcomes and prognosticfactors[J]. Eur J Surg Oncol, 2009, 35(1): 92-97. DOI: 10.1016/j.ejso.2008.05.006
[13] Jun SY, Park JK. Metachronous ovarian metastases following resection of the primary gastric cancer[J]. J Gastric Cancer, 2011, 11(1): 31-37. DOI: 10.5230/jgc.2011.11.1.31
[14] Cheong JH, Hyung WJ, Chen J, et al. Surgical management and outcome of metachronous Krukenberg tumors from gastric cancer[J]. JSurg Oncol, 2004, 87(1): 39-45.
[15] Jacquet P, Jelinek JS, Steves MA, et al. Evaluation of computed tomography in patients with peritoneal carcinomatosis[J]. Cancer, 1993, 72(5): 1631-1636. DOI: 10.1002/1097-0142(19930901)72:5<1631::AID-CNCR2820720523>3.0.CO;2-I
[16] Shim JH, Yoo HM, Lee HH, et al. Use of laparoscopy as an alternative to computed tomography (CT) and positron emission tomography (PET) scans for the detection of recurrence in patients with gastric cancer: a pilot study[J]. Surg Endosc, 2011, 25(10): 3338-3344. DOI: 10.1007/s00464-011-1722-1
[17] Bozzetti F, Yu W, Baratti D, et al. Locoregional treatment of peritoneal carcinomatosis from gastric cancer[J]. J Surg Oncol, 2008, 98(4): 273-276. DOI: 10.1002/jso.21052
[18] Glehen O, Gilly FN, Boutitie F, et al. Toward curative treatment of peritoneal carcinomatosis from nonovarian origin by cytoreductivesurgerycombined with perioperative intraperitoneal chemotherapy: a multi-institutional study of 1, 290 patients[J]. Cancer, 2010, 116(24): 5608-5618. DOI: 10.1002/cncr.25356



 下载:
下载: