Treatment outcomes of different radiotherapies for postoperative gliomas: three-dimensional conformal radiotherapy versus conventional radiotherapy
-
摘要:目的 对比分析脑胶质瘤术后常规放疗和三维适形放疗的远期疗效, 以探索更好的术后放疗方法。方法 对2001年1月至2010年12月在本院接受放疗的83例脑胶质瘤患者进行回顾性分析。采用Kaplan-Meier法计算无进展生存率和总生存率, 并应用Log-rank检验进行比较; 应用卡方检验比较两组的一般情况、不良反应发生情况等指标差异。结果 所有83例患者3年总生存率和无进展生存率分别为76.3%和72.2%, 术后三维适形放射治疗组及常规放射治疗组3年总生存率、无进展生存率分别为82.5%、78.2%和66.9%、64.1% (P=0.015、0.018)。分层分析显示三维适形放射治疗主要提高了手术未完全切除肿瘤患者以及病理分级为Ⅲ~Ⅳ级患者的无进展生存率和总生存率。结论 与术后常规放疗相比, 术后三维适形放疗提高了脑胶质瘤的无进展生存率和总生存率, 并可以减少放射性不良反应的发生。Abstract:Objective We aimed to compare the efficacy and side effects of three-dimensional conformal radiotherapy (3DCRT) and conventional radiotherapy for treating postoperative gliomas.Methods We retrospectively analyzed the data of 83 cases of postoperative gliomas that received radiotherapy from January 2001 to December 2010 in our hospital.The Kaplan–Meier method was used to calculate the tumor-free survival and overall survival (OS) rate.The log-rank test was conducted to determine significance.The chi-squared test was used to compare the differences among the clinical characteristics and toxicity.Results The OS and progression-free survival (PFS) rates for 3 years of all 83 cases were 76.3% and 72.2%, respectively.The OS and PFS for 3 years were 82.5% and 78.2% for 3DCRT, as well as 66.9% and 64.1% for conventional radiotherapy.Stratified analysis showed that 3DCRT mainly improved the OS and PFS rates of residual glioma and higher-grade (pathological grades Ⅲ~Ⅳ) gliomas.Conclusion Higher OS and PFS rates, lower incidence of herniation, and more delayed radiation-induced brain injury were achieved with 3DCRT than with conventional radiotherapy.
-
Keywords:
- glioma /
- radiotherapy /
- 3DCRT
-
脑胶质瘤是最常见的颅内肿瘤, 其浸润性生长的特性决定了手术不易完全切除, 需结合术后放射治疗。但术后常规放射治疗因受到正常脑组织耐受剂量的限制, 很难达到较高的剂量以控制复发, 且有可能导致比较严重的放射治疗后不良反应。三维适形放射治疗可使高剂量分布区的形状在三维方向上与病变的形状一致, 大大提高了放射野/瘤体符合度, 可更好的保护正常组织及器官, 提高了放射治疗的治疗增益比。本文对广西壮族自治区肿瘤医院2001年1月至2010年12月10年期间收治的83例进行术后放射治疗的胶质瘤患者进行回顾性分析, 报告如下。
1. 材料与方法
1.1 一般资料
2001年1月至2010年12月, 88例患者经手术后病理确诊为脑胶质瘤, 其中5例患者被本研究剔除(4例仅行γ刀治疗, 1例照射剂量不足20 Gy)。在其他入组的83例患者中, 男56例, 女27例, 中位年龄37 (10~77) 岁, 按照2007年WHO中枢神经系统分类方法, 其中Ⅰ~Ⅱ、Ⅲ~Ⅳ级分别为47、36例(包含两种不同病理分级成分的, 归入较高级别)。83例患者中手术完全切除肿瘤的有37例, 手术未能完全切除肿瘤的有46例。两组之间资料均衡性比较, 如表 1所示, 两组的性别、年龄、治疗前KPS评分、术后放疗开始时间、手术是否完全切除肿瘤、病理分级以及治疗过程中使用降颅压的药物情况差异均无统计学意义。
表 1 一般情况Table 1. Patient data
1.2 治疗方法
1.2.1 放疗
术后常规放射治疗组, 当病变广泛累及两侧大脑时选用左右平行对穿野, 当肿瘤位于大脑一侧时选用两侧野加用楔形板技术, 以保护对侧脑组织, 照射范围为手术前肿瘤增强区域外扩1~2cm (Ⅰ~Ⅱ级) 或2~3 cm (Ⅲ~Ⅳ级), 剂量范围是52~68Gy; 术后三维适形放疗采用CT模拟定位, 由两名以上(至少一名副主任医师以上) 医师负责靶区勾画, 以影像学所见的残存肿瘤为GTV (放疗前常规复查CT和/或MRI, CT增强扫描和/或MRI T1W1强扫描所显示的病变区域), 脑胶质瘤Ⅰ~Ⅱ级和脑胶质瘤Ⅲ~Ⅳ级分别外扩1~2 cm和2~3 cm为CTV, CTV照射剂量范围为50~64 Gy, GTV照射范围为60~76 Gy。
1.2.2 化疗
仅有8例患者进行手术后辅助化疗, 其中使用替莫唑胺单药方案化疗5例, VM-26加司莫司丁方案化疗2例, BCNU单药方案化疗1例。
1.3 统计学方法
末次随访时间为2012年4月, 总生存时间为手术时间到末次随访时间或死亡时间, 无进展生存时间为手术时间到末次随访时间或首次复发时间, 全组患者中位随访时间39个月, 失访4例, 随访率为95.2%, 失访病例作为截尾资料, 随访满3年者49例。统计软件为SPSS 13.0软件包, 采用Kaplan-Meier法计算无进展生存率和总生存率, 并应用Log-rank检验进行比较; 应用卡方检验比较两组的计数资料如两组的一般情况、不良反应发生情况。
2. 结果
2.1 治疗结果
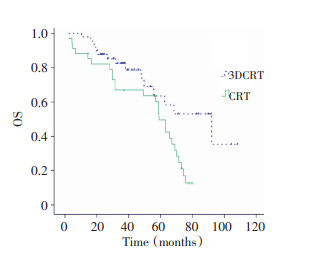
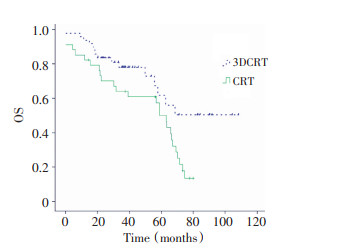
所有83例患者3年总生存率和无进展生存率分别为76.3%和72.2%, 术后三维适形放射治疗组及常规放射治疗组3年总生存率、无进展生存率分别为82.5%、78.2%和66.9%、64.1% (P=0.015、0.018)。术后三维适形放射治疗组的3年无进展生存率和总生存率均高于术后常规放射治疗组(图 1, 2)。分层分析显示, 三维适形放射治疗主要提高了手术未完全切除肿瘤患者以及病理分级为Ⅲ~Ⅳ级的无进展生存率和总生存率(表 2~3)。
表 2 术后放疗方式对手术是否完全切除肿瘤患者无进展生存率及总生存率的影响Table 2. Influence of radiotherapy method on PFS and OS of excision range 表 3 术后放疗方式对不同病理分级患者无进展生存率及总生存率的影响Table 3. Influence of radiotherapy method on PFS and OS of pathological
表 3 术后放疗方式对不同病理分级患者无进展生存率及总生存率的影响Table 3. Influence of radiotherapy method on PFS and OS of pathological
2.2 放射性损伤比较
在放疗过程中, 术后三维适形放射治疗组有38.8%患者颅内高压症状加重, 高于术后常规放射治疗组50%的比例, 但无统计学意义(P=0.316), 术后常规放射治疗组有3例患者在治疗过程中出现脑疝症状, 必须停止放射治疗, 而术后三维适形放射治疗组未出现此种情况(P=0.034)。在随后的影像学随访中, 术后三维适形放射治疗组仅1例患者出现放射性脑损伤表现, 明显低于术后常规放射治疗组5例(P=0.029, 表 4)。
表 4 放射性损伤发生情况Table 4. Radiation-induced brain injury
3. 讨论
手术是脑胶质瘤的主要治疗方法, 但由于脑胶质瘤侵袭性生长的生物学特性, 正常脑组织无明确的分界, 并且由于脑功能区域的限制、手术难以彻底切除、单纯手术疗效差、局部复发是治疗失败的主要原因[1]。术后放射治疗可以提高脑胶质瘤的治疗效果, 已经达成共识[2-5], 但是由于常规放射治疗剂量分布的缺陷, 往往使得靶区区域达不到理想的照射剂量, 且容易产生较为严重的放射性损伤如加重已经存在的颅内高压症状, 甚至导致脑疝的形成。三维适形放射治疗在脑胶质瘤的术后放疗中应用逐渐增多, 取得了较好的效果[6-8]。本研究采用术后三维适形放射治疗和常规放射治疗同期对照的方式, 来探讨两组间存在的差异。
本研究显示, 术后三维适形放射治疗提高了手术未能完全切除肿瘤患者的3年无进展生存率和总生存率, 考虑主要是因为对于尚有明显肿瘤残留的患者, 由于手术过程中破坏了局部循环通路, 使得局部乏氧, 尤其是位于中心区域的肿瘤细胞更是如此, 需要高照射剂量才能控制。在本研究中, 两组资料的术后照射剂量相近(对于手术未能完全切除肿瘤的患者, 术后常规照射的剂量范围是54~68 Gy, 中位值为60 Gy, 其中照射剂量 > 60 Gy的为12例, 术后三维适形放射治疗的剂量范围为46~76 Gy, 中位值为60 Gy, 其中照射剂量 > 60 Gy的为22例, 两者构成比例虽然相近, 但是常规放射治疗照射野单一固定, 照射野边缘有低剂量区域, 使得肿瘤得不到很好的控制。三维适形放射治疗采用多野照射技术, 高剂量区域很好的覆盖了靶区, 使得靶区95%的体积能够得到处方剂量, 靶区剂量分布均匀, 且照射剂量在靶区外陡然跌落, 在提高靶区剂量的同时, 也很好保护了正常的脑组织, 考虑到三维适形放射治疗在剂量分布上的优势, 提高了手术未能完全切除肿瘤患者的3年无进展生存率和总生存率。而对于手术完全切除肿瘤的患者来说, 本组资料显示术后三维适形放射治疗获益不大。有资料显示, 50 Gy的照射剂量对于亚临床病灶已经足够[3], 本组资料术后常规照射大部分患者均达到了60 Gy, 即便是处于相对低剂量区域, 也达到了杀灭亚临床病灶的剂量要求, 因此对于此部分患者, 术后三维适形放射治疗在剂量学分布上的优势未能很好的在肿瘤的生存率上体现出来。
本研究显示, 术后三维适形放射治疗与常规放射治疗相比较, 主要是提高了病理分级Ⅲ~Ⅳ级脑胶质瘤的3年无进展生存率和总生存率, 并未提高病理分级Ⅰ~Ⅱ级脑胶质瘤的3年无进展生存率和总生存率。笔者认为这有可能主要和本组病例靶区勾画方式有关。在勾画靶区时, 本研究并没有将所有的水肿区域包含入CTV内, 而是将不同的病例加以区别对待。对于手术未能完全切除肿瘤的病例, 以影像学所见的残存肿瘤为GTV, 脑胶质瘤Ⅰ~Ⅱ级和脑胶质瘤Ⅲ及Ⅳ级分别外扩1~2 cm和2~3 cm为CTV; 对于手术完全切除肿瘤的病例, 脑胶质瘤Ⅱ级和脑胶质瘤Ⅲ及Ⅳ均以手术前肿瘤增强区为基础分别外扩1~2 cm和2~3 cm。但是由于部分脑胶质瘤往往由不同恶性程度肿瘤成分构成, 在未进行连续切片病理检查的情况下, 有可能将部分高分级的肿瘤归入到低分级组, 如果在勾画这部分肿瘤的CTV时仍然按照1~2 cm的标准进行外扩, 有可能遗漏部分亚临床病灶。正是因为三维适形放射治疗照射剂量在靶区以外陡然跌落的特点, 使得被遗漏的亚临床病灶照射剂量不足, 成为肿瘤复发的根源。其次, 在CT及MR图像上, 脑胶质瘤Ⅱ级与脑胶质瘤Ⅲ及Ⅳ级影像表现截然不同, 对于脑胶质瘤Ⅲ及Ⅳ级, 肿瘤及水肿区比较容易被鉴别。而对于脑胶质瘤Ⅰ~Ⅱ级, 肿瘤界线不清, 增强不明显, 不易区分原始肿瘤, 而且水肿区域就是肿瘤区[9-10]。基于上述本研究勾画靶区的方法, 对于脑胶质瘤Ⅰ~Ⅱ级, 有可能遗漏部分处于水肿区域的肿瘤细胞, 使之处于低剂量照射范围内; 对于脑胶质瘤Ⅲ~Ⅳ级, 则不存在以上问题。上述原因导致术后三维适形放射治疗未能提高病理分级Ⅰ~Ⅱ级的3年无进展生存率和总生存率。
在放射性损伤方面, 本研究显示不论术后三维适形放射治疗或常规放射治疗, 均可以导致颅内高压症状的加重, 尽管常规放射治疗的比例更高, 但两者无统计学意义; 在常规放射治疗中, 有3例患者在放射治疗期间出现脑疝的临床表现而导致治疗终止, 有5例患者在放疗后随访过程中影像学提示放射性脑损伤, 均比术后三维适形放射治疗明显增高, 提示术后常规放射治疗更容易导致比较严重放射治疗急性不良反应以及慢性放射性脑损伤。此结果均得到了其他文献资料的证实[11-13]。
综上所述, 与术后常规放射治疗相比术后三维适形放射治疗明显提高了脑胶质瘤的无进展生存率和总生存率, 降低了脑疝及晚期放射性脑损伤的不良发生率。
-
表 1 一般情况
Table 1 Patient data

表 2 术后放疗方式对手术是否完全切除肿瘤患者无进展生存率及总生存率的影响
Table 2 Influence of radiotherapy method on PFS and OS of excision range

表 3 术后放疗方式对不同病理分级患者无进展生存率及总生存率的影响
Table 3 Influence of radiotherapy method on PFS and OS of pathological

表 4 放射性损伤发生情况
Table 4 Radiation-induced brain injury

-
[1] Jansen EP, Dewit LG, Van Herk M, et al. Target volumes in radiotherapy for high-grade malignant glioma of the brain[J]. Radiother Oncol, 2000, 56 (2): 151-156. DOI: 10.1016/S0167-8140(00)00216-4
[2] 刘泰福, 主编. 现代放射肿瘤学[M]. 上海: 复旦大学出版社, 2001: 465-483. [3] 殷蔚伯, 余子豪, 徐国镇, 主编. 肿瘤放射治疗学[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 2007: 1123-1124. [4] 郭福榕, 李慧灵, 刘秀英, 等. 脑恶性胶质瘤x射线立体定向和三维适形放射治疗[J]. 中华放射肿瘤杂志, 2002, 11 (4): 242-244. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHFZ200204010.htm [5] Leibel SA, Scott CB, Loeffler JS, et al. Contemporary approaches tothe treatment of malignant gliomas with radiation therapy[J]. SeminOncol, 1994, 21 (2): 198-219.
[6] Tanaka M, Ino Y, Nakagawa K. High-dose conformal radiothera py for supratentorial malignant glioma: a historical comparison[J]. Lancet Oncol, 2005, 6 (12): 953-960. DOI: 10.1016/S1470-2045(05)70395-8
[7] Lee SW, Franss BA, Marsh LH, et al. Patterns of failure followinghigh-dose 3D conformal radiotherapy for high-grade astrocyto mas: a quantitative dosimetric study[J]. Int J Radiat Oncol Bid Phys, 1999, 43 (1): 79—88.
[8] 史建军, 邵讯帆, 莫志文, 等. 24例恶性脑胶质瘤术后三维适形放射治疗分析[J]. 肿瘤学杂志, 2005, 11 (5): 377-378. https://www.cnki.com.cn/Article/CJFDTOTAL-XHON200505021.htm [9] Giraud G, Kantor G, Loiseau H, et al. Target definition in the tho rax and central nervous system[J]. Semin Radiat Oncol, 2005, 15 (3): 146-156. DOI: 10.1016/j.semradonc.2005.01.001
[10] Kantor G, Loiseau H, Vital A, et al. Volume tumoral mac roscopique (GTV) et volume-cible anatomoclinique (CTV) des tu meurs gliales de l'adulte[J]. Cancer Radiother, 2001, 5 (5): 571-580. DOI: 10.1016/S1278-3218(01)00107-X
[11] 傅志超, 程惠华, 赖红斌, 等. 125例胶质瘤术后三维适形放疗临床研究的初步结果[J]. 中华放射医学与防护杂志, 2007, 27 (2): 164-167. https://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZHYX200909003086.htm [12] 王孝深, 胡超苏, 何霞云, 等. 恶性胶质瘤常规放疗与三维适形放疗的疗效比较[J]. 肿瘤, 2008, 28 (12): 1069-1073. https://www.cnki.com.cn/Article/CJFDTOTAL-ZZLL200812016.htm [13] Narayana A, Yamada J, Berry S, et al. Intensity-modulated radio therapy in high-grade gliomas: clinical and dosimetric results[J]. IntJ Radiat Oncol Biol Phys, 2006, 64 (3): 892-897. DOI: 10.1016/j.ijrobp.2005.05.067



 下载:
下载: