Cyclophilin A-targeted cyclosporin A inhibits cell proliferation in multiple myeloma
-
摘要:目的 亲环素A(cyclophilinA,CyPA)在多种肿瘤组织中高表达,在肿瘤形成发展中扮演重要的角色。本研究对CyPA在多发性骨髓瘤(multiple myeloma,MM)患者骨髓标本中的表达及其对MM细胞增殖、凋亡能力的影响进行研究,探讨其与MM发生、进展的相关性。方法 采用ELISA法检测骨髓标本及细胞培养上清中CyPA水平。不同浓度环孢素A(cyclosporin A,CsA)刺激MM细胞,CCK-8法检测细胞增殖能力、Western blot法检测PARP蛋白裂解评价细胞凋亡水平。结果 单克隆免疫球蛋白血症、冒烟型骨髓瘤、MM患者骨髓中CyPA浓度逐渐升高,至MM达最高值,患者治疗后CyPA浓度明显下降。CsA处理MM细胞后,CyPA分泌减少,随时间延长细胞增殖能力呈浓度依赖性逐渐减弱,PARP蛋白裂解增加、细胞凋亡增多。结论 随MM恶性程度增加,骨髓中CyPA浓度显著升高,经治疗缓解后CyPA浓度显著下降,CyPA介导的细胞增殖在MM致癌机制中可能起关键作用。CsA作为CyPA作用的抑制剂,具有促进细胞凋亡、阻碍细胞增殖的作用,无免疫抑制作用的CsA衍生物可能是潜在的MM有效治疗手段。Abstract:Objective Cyclophilin A (CyPA), a member of the cyclophilin family, is highly expressed in a variety of malignancies and plays an important role in tumorigenesis. In this study, bone marrow expression of CyPA in patients with multiple myeloma (MM) and the effects of CyPA on the proliferation and apoptosis of myeloma cells are studied.Methods ELISA assay was used to detect the CyPA levels in bone marrow specimens and cell culture supernatant. CCK-8 assay and Western blot were used to detect cell proliferation and apoptosis upon cyclosporin A (CsA) stimulation.Results Compared with the early-stage monoclonal gammopathies of undetermined significance (MGUS) and smoldering myeloma (SMM), the level of bone marrow CyPA was significantly increased in patients with MM and decreased after treatment. Upon CsA stimulation, CyPA secretion was inhibited in the supernatant of myeloma cells, accompanied by suppressed cellular proliferation and promoted apoptosis.Conclusion CyPA expression in bone marrow increases significantly with the increase of the malignant degree of MM, indicating that cellular proliferation mediated by CyPA may play a key role in the carcinogenesis of MM. CsA as an inhibitor of CyPA promotes cell apoptosis and suppresses cell proliferation. Thus, the nonimmunosuppressive derivatives of CsA are potentially efficient in MM therapy.
-
Keywords:
- multiple myeloma /
- cyclophilin A /
- cyclosporin A /
- cell proliferation /
- apoptosis
-
多发性骨髓瘤(multiple myeloma,MM)是一种起源于B淋巴细胞的血液恶性肿瘤,特征表现是恶性浆细胞克隆性异常增殖,导致患者出现肾功能不全、贫血和骨质破坏等多器官损害[1]。当前MM临床治疗仍然十分困难,现有多种治疗手段虽然可以显著提高患者的缓解率和生存期,但大部分患者达到平台期后,疾病进展和复发仍不可避免[2]。因此,寻找新型、高效、低毒的治疗药物和可靠的预后评估手段成为研究的焦点。
亲环素A(cyclophilinA,CyPA)是亲环素(cyclophilin,CyP)家族成员,在细胞凋亡、细胞间信号传导等多种生物学过程中具有至关重要的作用[3]。CyPA在乳腺癌、胰腺癌、非小细胞肺癌(non-small cell lung cancer,NSCLC)等多种肿瘤组织中呈高表达,在肿瘤形成发展中扮演重要的角色[4-5]。本研究选取25例确诊MM患者的骨髓标本及4种骨髓瘤细胞株作为研究对象,探讨CyPA表达水平与骨髓瘤进展的相关性以及对骨髓瘤细胞增殖凋亡的影响,旨在为CyPA在多发性骨髓瘤中的发病机理提出佐证,并为治疗和预后评估方案提供参考。
1. 材料与方法
1.1 研究对象
骨髓标本由美国梅奥诊所(Division of Hematology,Mayo Clinic)Kumar.Shaji教授馈赠。从梅奥诊所收集2000年7月至2015年1月间典型MM患者25例,其中男性14例,女性11例,平均年龄46岁,分别于化疗前、后收集标本[治疗方案包括硼替佐米(万珂)联合地塞米松方案或沙利度胺方案]。另选取性别、年龄与患病组相匹配的MM瘤前阶段患者作为对照,包括意义未明的单克隆免疫球蛋白血症(monoclonal gammopathies ofundetermined significance,MGUS)患者25例及冒烟型骨髓瘤(smoldering myeloma,SMM)患者20例。每例留存骨髓标本5 mL,-80℃冻存备用。
骨髓瘤细胞株MM1S、RPMI、OPM-2、U266由美国哈佛医学院(Dana Farber Cancer Institute)Ruben.D. Carrasco 教授馈赠,采用含10% FBS 的RPMI1640培养基培养,置于37℃、5%CO2、湿度充分的恒温培养箱,每3~4 d按1∶3比例传代细胞。
1.2 方法
1.2.1 细胞处理
CyPA抑制剂环孢素CsA(购自美国Sigma-Aldrich公司),DMSO溶解后配成10 mM浓度存储备用。无血清培养基培养MM细胞6 h后,分别采用1、5、10 μM工作浓度CsA刺激细胞24、48、72 h进行后续实验。
1.2.2 ELISA法检测CyPA浓度
人CyPA-ELISA试剂盒(购自武汉优尔生公司),采用双抗体夹心法,按照说明书具体步骤完成检测。
1.2.3 CCK-8法检测细胞增殖
接种单细胞悬液于96孔板,每孔100 μL含8 000个细胞,每组设6个复孔,不同处理时间后,加入CCK-8溶液10 μL,继续培养2 h后在450 nm波长下,酶联免疫分析仪测定各孔光吸收值,记录结果,以时间为横轴,光吸收值的比值为纵轴绘制细胞生长曲线。
1.2.4 Western blot检测凋亡蛋白PARP的表达
提取细胞总蛋白,每孔加样30 μg,常规电泳分离、转膜后室温封闭1 h。PARP一抗(1∶1 000)4℃孵育过夜,TBST洗涤后二抗(1∶5 000)室温孵育1 h,TBST洗涤、ECL化学发光法检测,Quantity one(Bio-Rad)软件半定量分析。
1.3 统计学分析
采用SPSS 13.0统计进行统计学分析,结果均以mean±SD 表示。ELISA和Western blot的比较采用方差分析(one-way ANOVA),多重比较采用LSD法;增殖实验的结果是取3次实验结果的平均值,比较采用析因设计的方差分析;参数比较前进行方差齐性检验,在方差齐性的基础上进行比较,方差不齐时采用非参数检验。以P<0.05为差异具有统计学意义。
2. 结果
2.1 骨髓中CyPA浓度随MM疾病进展逐渐升高
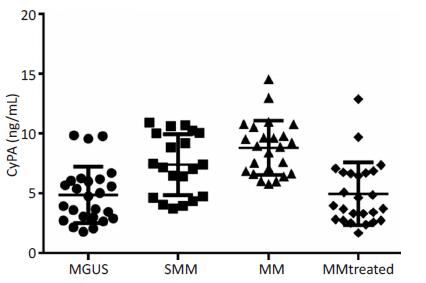
MGUS被认为是浆细胞瘤前病变,可进一步发展为SMM,此时进展为MM的危险度明显升高。ELISA检测结果显示:随着疾病进展,CyPA浓度不断升高,MGUS组CyPA浓度最低,至MM组达最高值,差异具有统计学意义(P<0.001)。MM患者接受治疗后收集标本进行检测,CyPA浓度则明显下降(P<0.001,图 1)。
2.2 CsA处理抑制骨髓瘤细胞中CyPA的分泌
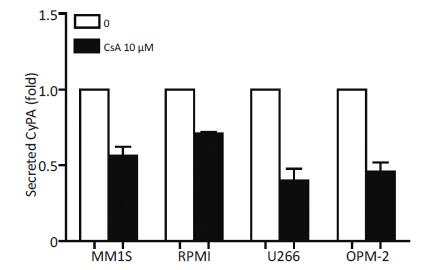
10μM工作浓度CsA处理骨髓瘤细胞,24 h后收集细胞培养上清,ELISA 法检测CyPA 的分泌情况。发现CsA刺激在4种细胞中均可抑制CyPA的分泌,其中对MM1S细胞的作用最强,对RPMI细胞的作用稍弱(图 2),提示CsA对CyPA的作用具有广泛性,而非细胞特异性。
2.3 CsA处理抑制骨髓瘤细胞增殖、促进凋亡
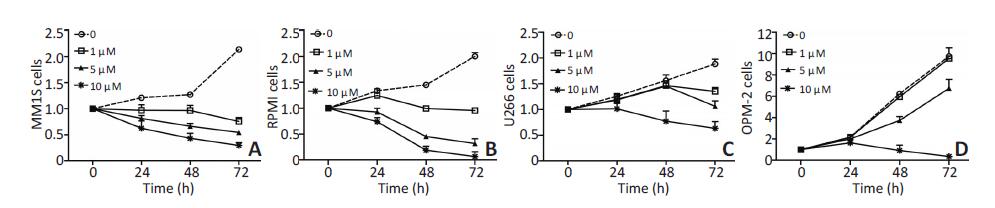
CCK-8检测结果显示,CsA刺激可抑制骨髓瘤细胞的增殖能力;在0~72 h内,细胞的增殖能力总体上有随着时间增长而逐渐减弱的趋势。与未处理组细胞相比,受CsA刺激后的MM1S细胞的增殖能力明显减弱,且在刺激72 h 时最弱(P=0.016)。RPMI、U266和OPM-2细胞则在刺激48、72 h后出现增殖抑制(72 h,P=0.007、0.019、0.002)。低浓度CsA(1、5 μM)刺激OPM-2细胞后,细胞增殖能力同样随时间增长不断减弱;高浓度CsA(10 μM)刺激后,OPM-2细胞增殖能力基本为零。其他细胞系亦出现相同的趋势,这说明10 μM CsA工作浓度不仅明显抑制细胞增殖,更能够引起细胞大量坏死(图 3)。
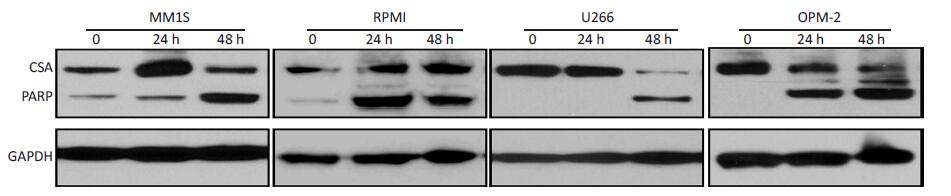
PARP 蛋白裂解是细胞凋亡早期的动态变化。因此,本研究进一步利用Western blot检测PARP表达水平来评估CsA刺激对骨髓瘤细胞凋亡的影响。在4种骨髓瘤细胞中,CsA处理均可诱导出裂解状态的PARP表达;并且随时间延长,CsA诱导PARP裂解的作用也越强(图 4)。
3. 讨论
自Sarris等[6]从牛胸腺细胞中纯化获得CyPA以来,CyPA在细胞生命活动中的重要作用被不断发现,与肿瘤等多种疾病的密切关系也引起关注。CyPA广泛分布于多种组织器官,它可被分泌到细胞外,发挥类似细胞因子的功能,或作为CsA的胞内受体介导CsA 的免疫抑制作用[4-5]。本研究在前期工作中发现,MM患者外周血和骨髓标本中CyPA浓度均明显升高,可能与MM的发生和进展密切相关[7]。在此基础上,本研究对CyPA与MM的关系进行了更加深入的探讨发现,MM与其早期阶段MGUS和SMM相比,随着肿瘤从良性到恶性的演变,骨髓中CyPA的浓度逐渐升高,而当患者接受治疗后CyPA浓度则明显下降;体外实验证实,CsA可作为骨髓瘤细胞中CyPA分泌的抑制剂,抑制细胞增殖、促进细胞凋亡,提示Cy⁃PA可能在MM发生、发展中起重要作用,尤其在异型转变中起关键作用。已有多项研究证实CyPA与多种肿瘤密切相关[8]。CyPA在多数NSCLC组织的胞浆和胞核中呈现出强阳性染色。因此,CyPA普遍高表达可能是肺组织恶性转化的表现;同时NSCLC细胞株中CyPA表达被抑制后,细胞增殖能力和糖代谢水平显著下降,并且出现明显的凋亡现象[9]。CyPA也是胰腺癌组织特征性的高表达分子:胰腺癌细胞株和组织中,CyPA和CD147同步高表达;并且高表达的CyPA还能激活ERK1/2和p38信号通路,具有显著的促增殖作用,并且同时能够诱导化疗抵抗[10]。CyPA还能上调多种耐药基因的表达,诱导肝癌等肿瘤细胞的化疗抵抗,促进肿瘤发展[11-12]。本研究的结果与上述研究结果一致,MM 患者外周血和骨髓标本中CyPA浓度均明显升高,而在治疗后明显下降,与疾病的恶性程度呈正相关;同时CyPA在骨髓中升高的程度更加明显,可以高达外周血浓度的10倍以上。因此,提示将骨髓CyPA浓度作为评估MM预后的分子标记,同时具有一定的特异性和敏感性,可能具有更加重要的临床意义。
CyPA是CsA的胞内受体,介导CsA参与的免疫抑制。二者结合后,抑制胞浆中钙调磷酸酶活化,通过抑制NF-AT去磷酸化和入核、或阻断MAPK/p38信号通路,下调IL-2和IFN-γ的表达,从而促进T细胞凋亡、抑制T细胞增殖和分化[13-15]。目前,已有研究将上述结论应用于抗艾滋病等免疫缺陷疾病的药物研究当中[16]。本研究结果显示,CsA可作为骨髓瘤细胞中CyPA功能的抑制剂,抑制细胞增殖、促进细胞凋亡,提示靶向CyPA的CsA可能在改善MM预后中做出贡献。无免疫抑制作用的CyPA抑制药物具有强大的潜在应用前景,已有多种类似药物处于被研究和开发阶段。Alisporivir(Debio025)是最先被投入Ⅲ期临床试验的CyPA抑制剂,与IFN-γ联用具有高效的抗病毒作用[17]。另外两个CsA 衍生物NIM811[18-19]、MM218[20-21]也在急性肺损伤、关节炎和心肌再灌注损伤中被证实具有显著的抗炎症作用。但目前尚无有关上述药物在MM中的应用研究,本课题组已经收到由Gunter Fischer教授馈赠的MM218试剂,后续实验中将对MM218通过抑制CyPA治疗MM的潜在作用进行深入的探讨。
综上所述,随着MM恶性程度的增加,骨髓中Cy⁃PA浓度显著升高,经治疗缓解后CyPA浓度显著下降,其介导的细胞增殖在MM的致癌机制中起到关键作用。CsA作为CyPA作用的抑制剂,具有促进细胞凋亡、阻碍细胞增殖的作用,无免疫抑制作用的CsA衍生物,可能是潜在高效的MM治疗手段。上述研究发现为临床工作中MM的诊断和预后评估提供新的思路,但具体机制和应用价值还有待进一步研究。
-
-
[1] Ghobrial IM. Myeloma as a model for the process of metastasis: implications for therapy[J]. Blood, 2012, 120(1):20-30. DOI: 10.1182/blood-2012-01-379024
[2] Rajkumar SV. Myeloma today: Disease definitions and treatment advances[J]. Am J Hematol, 2016, 91(1):90-100. DOI: 10.1002/ajh.24236
[3] FengW, Xin Y, Xiao Y, et al. Cyclophilin a enhances cell proliferation and xenografted tumor growth of early gastric cancer[J]. Dig Dis Sci, 2015, 60(9):2700-2711. DOI: 10.1007/s10620-015-3694-9
[4] Lee J. Role of cyclophilin a during oncogenesis[J]. Arch Pharm Res, 2010, 33(2):181-187. DOI: 10.1007/s12272-010-0200-y
[5] Nigro P, Pompilio G, Capogrossi MC. Cyclophilin A: a key player for human disease[J]. Cell Death Dis, 2013, 31(4):e888.
[6] Sarris AH, Harding MW, Jiang TR, et al. Immunofluorescent localization and immunochemical determination of cyclophilin-A with specific rabbit antisera[J]. Transplantation, 1992, 54(5):904-910. DOI: 10.1097/00007890-199211000-00026
[7] Zhu D, Wang Z, Zhao JJ, et al. The Cyclophilin A-CD147 complex promotes the proliferation and homing of multiple myeloma cells[J]. Nat Med, 2015, 21(6):572-580. DOI: 10.1038/nm.3867
[8] Saleh T, Jankowski W, Sriram G, et al. Cyclophilin A promotes cell migration via the Abl-Crk signaling pathway[J]. Nat Chem Biol, 2016, 12(2):117-123.
[9] Qian Z, Zhao X, JiangM, et al. Downregulation of cyclophilin A by siRNA diminishes non-small cell lung cancer cell growth and metastasis via the regulation of matrix metallopeptidase 9[J]. BMC Cancer, 2012, 12: 442. DOI: 10.1186/1471-2407-12-442
[10] Zhang H, Chen J, Liu F, et al. CypA, a gene downstream of HIF-1α, promotes the development of PDAC[J]. PLoS One, 2014, 9(3):e92824.
[11] Chen S, Zhang M, Ma H, et al. Oligo-microarray analysis reveals the role of cyclophilin A in drug resistance[J]. Cancer ChemPharm, 2008, 61(3): 459-469.
[12] Hamilton G. Cyclophilin A as a target of cisplatin chemosensitizers [J]. Curr Cancer Drug Targets, 2014, 14(1):46-58. DOI: 10.2174/15680096113136660109
[13] Bukrinsky M. Extracellular cyclophilins in health and disease[J]. Biochim Biophys Acta, 2015, 1850(10):2087-2095. DOI: 10.1016/j.bbagen.2014.11.013
[14] Guo M, Shen J, Kwak JH, et al. Novel role for cyclophilin A in regulation of chondrogenic commitment and endochondral ossification[J]. Mol Cell Biol, 2015, 35(12):2119-2130. DOI: 10.1128/MCB.01414-14
[15] Malesevi? M, Kühling J, Erdmann F, et al. A cyclosporin derivative discriminates between extracellular and intracellular cyclophilins[J]. Angew Chem Int Ed Engl, 2010, 49(1):213-215. DOI: 10.1002/anie.200904529
[16] Madlala P, Singh R, An P, et al. Association of polymorphisms in the regulatory region of the cyclophilin A gene (PPIA) with gene expression and HIV/AIDS disease progression[J]. J Acquir Immune Defic Syndr, 2016, 72(5):465-473.
[17] Phillips S, Chokshi S, Chatterji U, et al. Alisporivir inhibition of hepatocyte cyclophilins reduces HBV replication and hepatitis B surface antigen production[J]. Gastroenterology, 2015, 148(2):403-414. DOI: 10.1053/j.gastro.2014.10.004
[18] Ditiatkovski M, Neelisetti VN, Cui HL, et al. Inhibition of extracellular cyclophilins with cyclosporine analog and development of atherosclerosis in apolipoprotein E-deficient mice[J]. J Pharmacol Exp Ther, 2015, 353(3):490-495. DOI: 10.1124/jpet.115.223420
[19] Esser-Nobis K, Harak C, Schult P, et al. Novel perspectives for hepatitis A virus therapy revealed by comparative analysis of hepatitis C virus and hepatitis A virus RNA replication[J]. Hepatology, 2015, 62(2):397- 408. DOI: 10.1002/hep.v62.2
[20] Balsley MA, Malesevic M, Stemmy EJ, et al. A cell- impermeable cyclosporine A derivative reduces pathology in a mouse model of allergic lung inflammation[J]. J Immunol, 2010, 185:7663-7670. DOI: 10.4049/jimmunol.1001707
[21] Wang WL, Yuan YJ, Xue FS, et al. Extracellular cyclophilin A may be a potential target to protect against myocardial reperfusion injury[J]. Med Hypotheses, 2011, 77:734-738. DOI: 10.1016/j.mehy.2011.07.026



 下载:
下载: