-
摘要: Th9细胞作为新命名的辅助T细胞亚群,在抗肿瘤免疫治疗中起着重要作用,由转化生长因子-β(transforming growth factor-β,TGF-β)和白细胞介素-4(interleukin,IL-4)共同诱导初始CD4+T细胞分化而来,也可在特定的条件下由其他T细胞转化而来,表现出一定的可塑性。动物实验表明Th9可以抑制肿瘤生长,主要通过分泌IL-9等细胞因子以及其他方式发挥抗肿瘤免疫作用,细胞因子等分子可通过不同的信号途径调控Th9细胞分化、发育。本文旨在对Th9细胞的来源、抗肿瘤免疫作用及机制、相关信号通路等进行阐述,为抗肿瘤治疗提供新的视野和思路。Abstract: As a newly identified T helper cell subset, Th9 plays an important role in anti-tumor immunity. Th9 can be differentiated from CD4+ T cells that have been induced by TGF-beta and IL-4. In addition, other CD4+ T helper cell subsets can be developed to Th9 cell in particular situations, thereby showing its plasticity. Results of animal experiments have indicated that Th9 inhibits tumor growth and plays a significant role in anti-tumor immunity by secreting related cytokines such as IL-9. A few cytokines and molecules can regulate the differentiation and development of Th9 cells in different signaling pathways. This review will focus on the production, anti-tumor immunity, related mechanism, and signaling pathways of Th9 cells, thereby providing a new field of vision and idea for anti-tumor therapy in the future.
-
Keywords:
- Th9 /
- IL-9 /
- anti-tumor immunity /
- signaling pathway
-
在特定细胞因子环境中,初始CD4+T细胞在接受抗原刺激后,会朝着不同的辅助T细胞(helper T cell,Th)方向分化,如Th1、Th2、Th17细胞,还有近期发现的Th9、Th22细胞等。大量的研究表明,Th9细胞参与抗肿瘤免疫应答相关过程,主要通过分泌相关细胞因子影响肿瘤的生长、转移[1-3],本文旨在对Th9细胞的抗肿瘤免疫作用及相关机制、相关信号通路等方面进行阐述,为抗肿瘤治疗提供新的视野和思路。
1. Th9细胞
1.1 Th9细胞来源
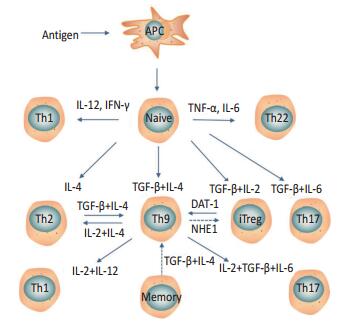
1994年,Schmitt等[4]研究发现转化生长因子-β(transforming growth factor-β,TGF-β)和白细胞介素-4(interleukin,IL-4)、白细胞介素-2(interleukin,IL-2)在一定条件下可诱导幼鼠初始CD4+T细胞大量分泌IL-9。随后在2008年,两项研究先后报道[5-6],TGF-β联合IL-4诱导小鼠初始CD4+T细胞分化为一类可分泌IL-9或IL-9、IL-10的新辅助T细胞,这种不同于Th2或Treg、Th17、Th1的新细胞,被命名为Th9细胞。2010年,Wong等[7]研究发现人体中也存在类似情况,并把这种不同于Th2的细胞也称为Th9细胞。
初始CD4+T细胞在特定细胞因子环境下,向着不同Th细胞分化,若细胞因子是IL-12或IFN-γ可分化为Th1,IL-4则分化为Th2,TGF-β对应是Treg细胞,而Th17则需要TGF-β和IL-6刺激[3, 8],Th22细胞则需要TNF-α和IL-6刺激[9-10]。
1.2 Th9细胞可塑性
除了上述情况,其他细胞在特定的条件下亦能分化为Th9细胞,如Th2、Treg、记忆T细胞等。相反,Th9细胞也可以获得其他辅助细胞的表型,分泌其相关因子,具有一定的可塑性。研究发现无法分泌IL-9的Th2细胞系中加入TGF-β后,IL-9的表达明显上升,Veldhoen等[5]研究认为这是Th2细胞被TGF-β诱导向Th9细胞转化。Tan等[11]研究发现Th9细胞在特定细胞因子环境下可获得Th1、Th2、Th17相关表型,并大量分泌IFN-γ、IL-4、IL-17,但IL-9却无法检出。Putheti等[12]研究表明,人体内TGF-β和IL-4不仅可以诱导初始CD4+CD45RA+T细胞,也可诱导记忆CD4+CD45RO+细胞分泌IL-9。有研究表明,调节T细胞(regulatory T cells,Tregs)也可向Th9细胞分化[12]。Liu等[13]研究发现Th2可以促进Treg细胞转化为Th9细胞,能被IL-4或TGF-β的抗体所抑制。2015年,有两个研究团队先后发现Treg可被诱导转化为Th9细胞,具体过程是TGF-β联合IL-2诱导初始CD4+T细胞激活后可产生Foxp3+Treg细胞,该细胞上糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(glucocorticoid-induced tumor necrosis factor receptor-related protein,GITR)高表达,放入相关激动剂DAT-1后发现Tregs细胞数量明显减少,而Th9细胞明显增多,30%~40% Tregs转化为Th9,而且并没有向其他细胞分化[14-15]。其他研究发现,钠氢交换蛋白1(Na+/H+exchanger,NHE1)可能影响Th9与Treg两者平衡,敲除NHE1后检测到的Th9细胞比例减少,而Treg细胞增多,提示Th9可能转化为Treg细胞,但并未给出直接证据(图 1)[16]。
2. 人体Th9细胞
肿瘤患者外周血,或胸、腹腔积液,以及癌组织中的Th9细胞都明显升高,而且人体Th9细胞可能参与肿瘤进展过程,但具体作用尚待明确。更重要的是Th9分布可能与肿瘤的分期有一定的关系。有研究发现,喉鳞状细胞癌和小细胞肺癌患者外周血中Th9比对照组明显升高,并且Ⅲ、Ⅳ期喉癌患者较Ⅰ、Ⅱ期Th9细胞升高显著[17-18]。Yang等[19]研究发现晚期肝癌腹腔积液中Th9细胞明显较早期升高,其结论与上述研究结果一致。一项关于大肠癌的研究却提出截然相反的观点,认为Th9与大肠癌Ducks分期呈负相关,而且相比外周血、癌旁组织中,结肠癌组织中Th9明显升高[20]。除此之外,肺癌患者胸腔积液中Th9细胞相对于正常志愿者的外周血中明显升高,且高Th9患者的生存期显著缩短,表明Th9与肿瘤的预后密切相关[21-22]。
记忆性Th9细胞也可能与肿瘤发生、发展有联系。Bu等[23]研究发现肺癌患者的恶性胸腔积液中Th9细胞表面CD45RO表达上升,上述大肠癌的研究同样也发现癌组织Th9细胞表面CD45RO蛋白高表达[20]。
3. Th9细胞抗肿瘤免疫作用
3.1 Th9细胞抑制肿瘤生长与转移
Purwar等[1]研究发现Th9细胞能够抑制黑色素瘤的增长,该研究将Th9细胞和对照组分别输入免疫功能不全的黑色素瘤小鼠,前者黑色素瘤细胞生存期明显优于后者,而且相对于Th1、Th2、Th17细胞抑制肿瘤作用更强。Lu等[2]研究发现Th9细胞可明显减少黑色素瘤小鼠肺转移瘤灶数量,并且较Th1效果强。后来研究大多按照上述的黑色素瘤小鼠动物模型进行相关试验,相继发现Th9细胞能够抑制肿瘤生长[15, 24]。除了黑色素瘤外,Th9细胞还可以抑制鳞状细胞癌的生长[25]。近期一项有关Th9相关疫苗的研究表明,Th9细胞通过分泌IL-9阻碍肿瘤细胞种植及扩散[26]。综上所述,Th9细胞可以抑制肿瘤的生长和转移,并强于其他辅助T细胞。
3.2 Th9细胞促进肿瘤生长
Th9细胞促进肿瘤的生长作用并无直接的动物实验证据,该作用主要通过IL-9具体体现。体内除了Th9,Th2、Th17、Treg细胞、NK细胞、肥大细胞也可分泌IL-9[3],表明IL-9并不是Th9细胞的特有“专利”。血液恶性病变中,IL-9往往异常升高,是由异常免疫细胞分泌,也并不是由Th9细胞分泌[27-28]。IL-9促进肿瘤生长的作用大多是在血液恶性疾病中发现,如淋巴瘤患者中发现IL-9可以抑制肿瘤细胞凋亡和促进肿瘤的增殖,并降低瘤细胞对化疗药物的敏感性[29]。研究发现,使用相关抗体阻断IL-9或去除IL-9相关基因,肿瘤进展减慢,而抗肿瘤作用升高[28, 30]。
4. Th9细胞抗肿瘤免疫机制
4.1 Th9细胞促进肿瘤细胞凋亡
Th9细胞可以像CTL一样,高表达granzyme-B,直接作用于靶细胞发挥”杀伤”作用,促进肿瘤凋亡。不过,这种毒性效应却能被相关抑制剂所抑制[1]。另外,也可以通过分泌细胞因子IL-9直接作用瘤细胞,促进凋亡,但这需要瘤细胞表达相关受体才能起作用[25]。其他研究发现,IL-9可以通过诱导黑色素瘤细胞促凋亡因子高表达,导致瘤细胞凋亡[31]。
4.2 诱导其他细胞进入肿瘤组织
有研究发现,小鼠体内注入Th9细胞后,肿瘤组织内白细胞、CD4+T、CD8+T大量升高,而Tregs/CD8+T细胞所占比例却明显下降;相对于对照组,IL-17明显增加,说明Th9细胞可以招募产IL-17的免疫细胞及炎性细胞进入肿瘤组织。Th9细胞可通过诱导肺癌组织上皮细胞CCL20受体和与其配体Ccr6蛋白的表达,促进CTL细胞抗原启动和进入肿瘤组织。主要机制是依赖Ccr6的DCS细胞移入引流淋巴结,激活效应细胞,尤其是CTL细胞进入肿瘤组织[2, 32]。
4.3 分泌相关细胞因子作用于其他细胞
Th9细胞主要分泌细胞因子IL-9作用于其他细胞发挥抗肿瘤免疫作用,也可分泌IL-21、IL-3发挥效应,通过不同的方式作用于其他细胞,其中就包括DCs、CTL、NK、肥大细胞等。
Park等[33]研究发现,当成熟DCs细胞和Th9细胞一起培养时,DCs生存时间明显较长,而且凋亡速度明显下降,表明Th9细胞能够延长DCs细胞的生存期。检测细胞因子时发现,IL-3和IL-9亦明显增高,分别增加相关抗体后,只有IL-3的抗体才能抑制DCs细胞增长,提示Th9分泌IL-3作用于DCs细胞,主要机制是IL-3能够通过不同的信号通路上调DCs抗凋亡蛋白表达。
Végran等[34]研究发现,IL-1β能促进Th9细胞的IL-9和IL-21分泌,并可增强Th9的抗癌效果,实验却表明IL-1β是依赖IL-21而发挥抗癌作用而非IL-9,主要机制是IL-21使CTL或NK分泌的IFN-γ增多,这两种细胞缺失会导致Th9细胞的抗癌效果降低。此外,免疫缺陷的小鼠或阻断IFN-γ均可导致Th9细胞失去抑制肿瘤增长的能力。Kim等[15]研究发现,DTA-1也促进IL-9和IL-21分泌。使用IL-9抗体后能部分消除CTL的抗癌作用,提示DTA-1可能通过IL-9或IL-21增强CTL反应。然后,独立验证CTL细胞和IL-9的关系,使用DAT-1可以使CTL细胞数量增多,而不受IL-9相关抗体的影响,发现CTL细胞上的granzyme B、IFN-γ、TNF-α、CD107a被IL-9抗体所抑制,表明IL-9对CTL的成熟有重要作用。在体外,IL-9却不直接作用于CTL细胞,而是通过增强DCs抗原提呈作用,以及提高相关共刺激和MHC Ⅱ分子表达,而后作用于CTL。Zhao等[35]研究发现,DCs引起Th9细胞升高后,Th9可以提高肿瘤特异性CTL活性,而阻断IL-9后,相关活性亦受到抑制。上述研究均提示,CTL是Th9细胞重要的效应细胞之一。
肥大细胞也有可能是Th9细胞的效应细胞。Purwar等[1]研究发现,当Th9细胞发挥抗癌作用时,缺少肥大细胞的小鼠注入IL-9后肿瘤生长会不明显。AbdulWahid等[26]研究发现,Th9细胞分泌的IL-9能够抑制肥大细胞脱颗粒。同时,Th9的抗肿瘤植入作用也被消除。另外一项平行实验,通过相关试剂消除肥大细胞后,发现注入Th9细胞未能表现出抗肿瘤的效果。不过,也有研究提出不同的意见。其中,Lu等[2]研究发现,注入Th9细胞的肿瘤组织中未检测到肥大细胞升高,而IL-1β和DAT-1诱导的Th9细胞在肥大细胞缺陷的小鼠身上也能保持其抗癌效果[15, 34]。
5. 影响Th9细胞抗肿瘤作用的相关信号通路
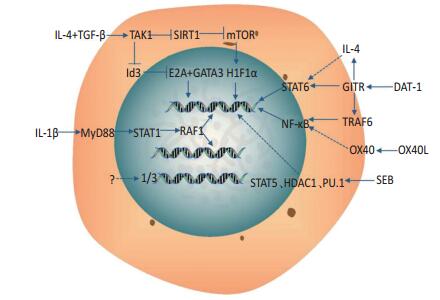
细胞因子或共刺激分子与下游的转录因子构成相当复杂的信号网络,一些细胞因子可通过这些网络影响Th9细胞基因表达。如IL-4可以激活STAT6调控Th9的IL-9基因[36-37],OX40对应的是NF-κB[38],研究发现TGF-β和Smad均可以诱导Th9细胞分化发育[39-40]。
有关Th9抗肿瘤作用方面的信号通路研究相对较少。本文已阐述IL-1β可促进Th9细胞基因编码IRF1因子,而该过程主要通过IL-1R-MyD88-STAT1信号通路,IRF1与IL-9和IL-21相关基因互相结合而诱导Th9分化[34]。
近期研究发现,SIRT1(sirtuin1)缺陷可促进Th9细胞分泌IL-9,并延迟肿瘤进展。研究者探讨IL-4和TGF-β的下游信号PU.1、Smad3、STAT6、STAT5、mTOR、HIF1 α等,发现mTOR-HIF1 α是SIRT1调节Th9所必备的,HIF1 α可直接结合IL-9的基因,促进转录。同时在小鼠和人体均发现SIRT1可以调控Th9细胞的分化,更重要的是,SIRT1上游抑制信号是TAK1(TGF-β activated kinase 1,TAK1)[41]。一项有关分化抑制因子3(inhibitors of differentiation or DNA binding3,Id3)的研究显示,在Id3基因缺陷的小鼠中,TGF-β和IL-4诱导Th9细胞分化的效果增强,抗肿瘤作用增强。Id3可以负调控转录因子E2A和GATA-3,并阻止其与IL-9的基因启动子结合。Id3上游抑制信号也是TAK1,这表明存在TAK1-Id3-E2A和GATA-3信号通路调控Th9细胞分化[24]。
Xiao等[14]研究发现GITR可通过STAT6转录因子和组蛋白乙酰化酶P300诱导Th9分泌IL-9,而另外一个研究团队却发现GITR是经过通路TRAF6-NF-κB,或通过IL-4影响Th9分泌细胞因子。除上述外,也有其他可能的信号通路影响Th9细胞分化。Zhao等[35]的研究发现,DCs表达的OX40L参与诱导Th9细胞产生的过程,这表明OX40与NF-κB信号通路有可能参与Th9抗肿瘤免疫的过程。Miao等[25]研究发现,金黄色葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)可能通过影响转录因子STAT5、HDAC1、PU.1诱导Th9细胞的分化。上述信号通路具体可见图 2[3]。
6. 结语
Th9细胞在抗肿瘤免疫中发挥重要的作用,其抑制肿瘤细胞生长的具体机制相当复杂,主要通过分泌细胞因子发挥效应。其中,IL-9是其最重要的细胞因子,具体机制仍需大量的研究证明。其他因子能够通过不同的信号通路影响Th9细胞的分化,将来可能成为相关治疗靶点。Th9作为新的辅助T细胞,有望成为一种新的治疗策略。
-
-
[1] Purwar R, Schlapbach C, Xiao S, et al. Robust tumor immunity to melanoma mediated by interleukin 9[J]. Nat Med, 2012, 18(8):1248-1253. DOI: 10.1038/nm.2856
[2] Lu Y, Hong S, Li H, et al. Th9 cells promote antitumor immune responses in vivo[J]. J Clin Invest, 2012, 122(11):4160-4171. DOI: 10.1172/JCI65459
[3] Kaplan MH, Hufford MM, Olson MR. The development and in vivo function of T helper 9 cells[J]. Nat Rev Immunol, 2015, 15(5):295-307. DOI: 10.1038/nri3824
[4] Schmitt E, Germann T, Goedert S, et al. IL-9 production of naive CD4+ T cells depends on IL-2, is synergistically enhanced by a combination of TGF-beta and IL-4, and is inhibited by IFN-gamma[J]. J Immunol, 1994, 153(9):3989-3996. http://europepmc.org/abstract/med/7930607
[5] Veldhoen M, Uyttenhove C, van Snick J, et al. Transforming growth factor-[beta] reprograms the differentiation of T helper 2 cells and promotes an interleukin 9-producing subset[J]. Nature Immunol, 2008, 9(12):1341-1346. DOI: 10.1038/ni.1659
[6] Dardalhon V, Awasthi A, Kwon H, et al. Interleukin 4 inhibits TGF-β-induced-Foxp3(+) T cells and generates, in combination with TGF-β, Foxp3(-) effector T cells that produce interleukins 9 and 10[J]. Nat Immunol, 2008, 9(12):1347-1355. DOI: 10.1038/ni.1677
[7] Wong MT, Ye JJ, Alonso MN, et al. Regulation of human Th9 differentiation by typeⅠinterferons and IL-21[J]. Immunol Cell Biol, 2010, 88(6):624-631. DOI: 10.1038/icb.2010.53
[8] Li Y, Yu Q, Zhang Z, et al. TH9 cell differentiation, transcriptional control and function in inflammation, autoimmune diseases and cancer[J]. Oncotarget, 2016, 7(43):71001-71012. http://europepmc.org/abstract/MED/27589682
[9] Trifari S, Kaplan CD, Tran EH, et al. Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from TH-17, TH1 and TH2 cells[J]. Nat Immunol, 2009, 10(8): 97-120. https://www.ncbi.nlm.nih.gov/pubmed/19578368
[10] Azizi G, Yazdani R, Mirshafiey A. Th22 cells in autoimmunity: a review of current knowledge[J]. Euro Ann Aller Clin Immunol, 2015, 47(4):108-117. https://www.researchgate.net/publication/279989210_Th22_cells_in_autoimmunity_a_review_of_current_knowledge
[11] Tan C, Aziz MK, Lovaas JD, et al. Antigen-specific Th9 cells exhibit uniqueness in their kinetics of cytokine production and short retention at the inflammatory site[J]. J Immunol, 2010, 185(11):6795-6801. DOI: 10.4049/jimmunol.1001676
[12] Putheti P, Awasthi A, Popoola J, et al. Human CD4 memory T cells can become CD4+ IL-9+ T cells[J]. PLoS One, 2010, 5(1):262-262. https://www.ncbi.nlm.nih.gov/pubmed/20090929
[13] Liu JQ, Li XY, Yu HQ, et al. Tumor-specific Th2 responses inhibit growth of CT26 colon-cancer cells in mice via converting intratumor regulatory T cells to Th9 cells[J]. Sci Rep, 2015, 5:10665. DOI: 10.1038/srep10665
[14] Xiao X. GITR subverts Foxp3+ Tregs to boost Th9 immunity through regulation of histone acetylation[J]. Nat Commun, 2015, 6(12):45-58. https://www.researchgate.net/publication/281780579_GITR_subverts_Foxp3_Tregs_to_boost_Th9_immunity_through_regulation_of_histone_acetylation
[15] Kim IK, Kim BS, Koh CH, et al. Glucocorticoid-induced tumor necrosis factor receptor-related protein co-stimulation facilitates tumor regression by inducing IL-9-producing helper T cells[J]. Nat Med, 2015, 21(9):1010. DOI: 10.1038/nm.3922
[16] Singh Y, Zhou Y, Shi X, et al. Alkaline cytosolic pH and high sodium hydrogen exchanger 1 (NHE1) activity in Th9 cells[J]. J Biol Chem, 2016: 730259. https://www.researchgate.net/publication/308123454_Alkaline_cytosolic_pH_and_high_sodium_hydrogen_exchanger_1_NHE1_activity_in_Th9_cells
[17] 孙牧男, 方艳秋, 刘磊, 等.小细胞肺癌患者外周血中Th9细胞水平检测及其临床意义[J].吉林大学学报医学版, 2016, 42(3):561-564. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-IGMD201511001736.htm Sun MN, Fang YQ, Liu L, et al. Detection of Th9 cells in peripheral blood of patients with small cell lung cancer and its clinical significance[J]. J Jilin Univ (Medi Edit), 2016, 42(3):561-564. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-IGMD201511001736.htm
[18] 郭欣, 吴志宇, 陈春悠, 等.喉鳞状细胞癌患者中Th9细胞及白细胞介素-9的变化及其临床意义[J].中华实验外科杂志, 2014, 31(7):1609-1612. http://cdmd.cnki.com.cn/Article/CDMD-10422-1015522207.htm Guo X, Wu ZY, Chen CY, et al. The abnormality and clinical significant of T helper 9 cells and interleukin-9 in patients with laryngeal squamous cell carcinoma[J]. Chin J Exp Surg, 2014, 31(7):1609-1612. http://cdmd.cnki.com.cn/Article/CDMD-10422-1015522207.htm
[19] Yang XW, Jiang HX, Huang XL, et al. Role of Th9 cells and Th17 cells in the pathogenesis of malignant ascites[J]. Asian Pac J Trop Biomed, 2015, 5(10):806-811. DOI: 10.1016/j.apjtb.2015.07.013
[20] 张磊昌, 陈利生, 张森, 等.CD4+IL-9+细胞在大肠癌免疫微环境中的分布及临床意义[J].中华肿瘤防治杂志, 2014, 21(6):407-410. http://www.cnki.com.cn/Article/CJFDTOTAL-QLZL201406004.htm Zhang LC, Chen LS, Zhang S, et al. Distribution and clinical significance of CD4+ IL-9+ lymphocyte in immune microenvironment of colorectal cance[J]. Chin J Cancer Prev Tre, 2014, 21(6):407-410. http://www.cnki.com.cn/Article/CJFDTOTAL-QLZL201406004.htm
[21] Yong L, Hua L, Kan Z, et al. Interleukin-17 inhibits development of malignant pleural effusion via interleukin-9-dependent mechanism[J]. Sci China Life Sci, 2016:1-8. DOI: 10.1007/s11427-016-0097-y?slug=full%20text
[22] Ye ZJ, Zhou Q, Yin W, et al. Differentiation and immune regulation of IL-9-producing CD4+ T cells in malignant pleural effusion[J]. Am J Res Crit Care Medi, 2012, 186(11):1168-1179. DOI: 10.1164/rccm.201207-1307OC
[23] Bu XN, Zhou Q, Zhang JC, et al. Recruitment and phenotypic characteristics of interleukin 9-producing CD4+ T cells in malignant pleural effusion[J]. Lung, 2013, 191(4):385-389. DOI: 10.1007/s00408-013-9474-4
[24] Nakatsukasa H, Zhang D, Maruyama T, et al. The DNA-binding inhibitor Id3 regulates IL-9 production in CD4+ T cells[J]. Nat Immunol, 2015, 16 (10):1077. DOI: 10.1038/ni.3252
[25] Miao BP, Zhang RS, Sun HJ, et al. Inhibition of squamous cancer growth in a mouse model by Staphylococcal enterotoxin B-triggered Th9 cell expansion[J]. Cell Mol Immunol, 2015. https://www.ncbi.nlm.nih.gov/pubmed/26388239
[26] Abdul-Wahid A, Cydzik M, Prodeus A, et al. Induction of antigen-specific TH9 immunity accompanied by mast cell activation blocks tumor cell engraftment[J]. Int J Cancer, 2016, 139(4):841-853. DOI: 10.1002/ijc.30121
[27] Feng LL, Gao JM, Li PP, et al. IL-9 Contributes to immunosuppression mediated by regulatory T cells and mast cells in B-cell non-Hodgkin's lymphoma[J]. J Clin Immunol, 2011, 31(6):1084-1094. DOI: 10.1007/s10875-011-9584-9
[28] Hoelzinger DB, Dominguez AL, Cohen PA, et al. Inhibition of adaptive immunity by IL-19 can be disrupted to achieve rapid T-cell sensitization and rejection of progressive tumor challenges[J]. Cancer Res, 2014, 74 (23):6845-6855. DOI: 10.1158/0008-5472.CAN-14-0836
[29] Lv X, Feng L, Ge X, et al. Interleukin-9 promotes cell survival and drug resistance in diffuse large B-cell lymphoma[J]. J Exp Clin Cancer Res, 2016, 35(1):1-9. DOI: 10.1186/s13046-015-0276-9
[30] Vieyra-Garcia PA, Wei T, Gram ND, et al. STAT3/5 dependent IL-9 overexpression contributes to neoplastic cell survival in mycosis fungoides[J]. Clin Cancer Res, 2016, 60(6):1175-1177. http://clincancerres.aacrjournals.org/content/early/2016/02/05/1078-0432.CCR-15-1784?cited-by=yes&legid=clincanres;1078-0432.CCR-15-1784v1
[31] Fang Y, Chen X, Bai Q, et al. IL-9 inhibits HTB-72 melanoma cell growth through upregulation of p21 and TRAIL[J]. J Surg Oncol, 2015, 111(8): 969-974. DOI: 10.1002/jso.v111.8
[32] Lu Y, Yi Q. Utilizing TH9 cells as a novel therapeutic strategy for malignancies[J]. Oncoimmunology, 2013, 2(3):23084. DOI: 10.4161/onci.23084
[33] Park J, Li H, Zhang M, et al. Murine Th9 cells promote the survival of myeloid dendritic cells in cancer immunotherapy[J]. Cancer Immunol Immunotherapy, 2014, 63(8):835-845. DOI: 10.1007/s00262-014-1557-4
[34] Végran F, Berger H, Boidot R, et al. The transcription factor IRF1 dictates the IL-21-dependent anticancer functions of TH9 cells[J]. Nat Immunol, 2014, 15(8):758-766. DOI: 10.1038/ni.2925
[35] Zhao Y, Xiao C, Chen J, et al. Dectin-1-activated dendritic cells trigger potent antitumour immunity through the induction of Th9 cells[J]. Nat Commun, 2016, 5(7):12368. https://www.researchgate.net/publication/305923527_Dectin-1-activated_dendritic_cells_trigger_potent_antitumour_immunity_through_the_induction_of_Th9_cells
[36] Goswami R, Jabeen R, Yagi R, et al. STAT6-dependent regulation of Th9 development[J]. J Immunol, 2012, 188(3):968-975. DOI: 10.4049/jimmunol.1102840
[37] Chen N, Lu K, Li P, et al. Overexpression of IL-9 induced by STAT6 activation promotes the pathogenesis of chronic lymphocytic leukemia [J]. Int J Clin Exp Path, 2014, 7(5):2319-2323. http://europepmc.org/articles/PMC4069881
[38] Xiao X, Balasubramanian S, Liu W, et al. OX40 signaling favors the induction of T (H)9 cells and airway inflammation[J]. Nat Immunol, 2012, 13(10):981-990. DOI: 10.1038/ni.2390
[39] Elyaman W, Bassil R, Bradshaw EM, et al. Notch receptors and Smad3 signaling cooperate in the induction of interleukin-9-producing T cells [J]. Immunity, 2012, 36(4):623-634. DOI: 10.1016/j.immuni.2012.01.020
[40] Wang A, Pan D, Lee Y, et al. Smad2 and Smad4 regulate TGF-β-mediated IL-19 gene expression via EZH2 displacement[J]. J Immunol, 2011, 191 (10):4908-4912. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_PM24108699
[41] Yu W, Bi Y, Xi C, et al. Histone deacetylase SIRT1 negatively regulates the differentiation of interleukin-9-producing CD4+T cells[J]. Immunity, 2016, 44(6):1337-1349. DOI: 10.1016/j.immuni.2016.05.009
-
期刊类型引用(4)
1. 张峰,王晓燕. 肿瘤浸润性T淋巴细胞在宫颈癌中的作用研究进展. 中国计划生育和妇产科. 2023(07): 22-24+28 .  百度学术
百度学术
2. 顾烨,陈卫昌. 辅助性T细胞9/白细胞介素-9在消化系统恶性肿瘤中的研究进展. 胃肠病学. 2023(09): 551-555 .  百度学术
百度学术
3. 高勇,宋月,韩姝坤,毕晓琳. Th9、Th17、CD4~+CD25~+FoxP3~+调节性T细胞在慢性淋巴细胞白血病患者外周血中的变化. 中国输血杂志. 2019(01): 26-29 .  百度学术
百度学术
4. 王进,董晓强,朱新国,赵华,毛德利,赵鑫. IL-9在结肠癌组织中的表达及其临床意义. 南方医科大学学报. 2018(08): 943-948 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: