Relationship between preoperative FIB-4 and hepatocellular carcinoma prognosis after curative resection
-
摘要:目的 探讨FIB(Fibrosis)-4评分系统与肝细胞癌(HCC)患者临床病理特征及预后的关系。方法 收集2009年1月至2012年12月间245例接受根治性肝切除手术的HCC患者的临床及随访资料进行分析,利用Kaplan-Meier进行单因素生存分析,Cox比例风险回归模型进行多因素生存分析。结果 根据患者术前FIB-4评分,将患者分为FIB-4Ⅰ(≤3.25)和FIB-4Ⅱ( > 3.25)。FIB-4能够预测肝硬化程度(Ishak分级:1~5级 vs. 6级,r=0.681,P < 0.001),其主要与患者的肝功能指标如谷草转氨酶(P < 0.001)、胆红素(P=0.009)、白蛋白(P=0.001)及血小板计数(P < 0.001)相关,与其他病理特征无关。单因素及多因素分析均表明FIB-4能够预测HCC患者的预后(总生存时间:P=0.037,0.011;无瘤生存时间:P=0.027,0.043)。结论 FIB-4有可能作为HCC根治性切除术后的预后参考指标之一。Abstract:Objective To investigate the correlation between FIB-4 and the clinicopathological characteristics and prognosis of patients with hepatocellular carcinoma (HCC) after curative resection.Methods From January 2009 to December 2012, the clinicopathological and follow-up data of 245 patients with HCC after curative resection were retrospectively studied. Their survival was calculated using the Kaplan-Meier method. The Cox proportional hazard regression model was used for the multivariate analysis.Results According to FIB-4 index, patients were divided into two subgroups: FIB-4Ⅰ(≤3.25) and FIB-4Ⅱ( > 3.25). FIB-4 could predict liver cirrhosis severity (Ishak grade, Grade 1-5 vs. Grad 6, r=0.681, P < 0.001). It was associated with liver function such as:aspartate transaminase (P < 0.001)、total bilirubin (P=0.009)、albumin (P=0.001) and platelet count (P < 0.001) other than tumor clinicopathologic features. Both univariate and multivariate analysis showed FIB-4 could predict the prognosis of HCC patients (Overall survival: P=0.037 and 0.011; Recurrencefree survival: P=0.027 and P=0.043, respectively).Conclusion The preoperative FIB-4 index could be used as a prognostic marker for the prognosis of HCC after curative hepatectomy.
-
Keywords:
- hepatocellular carcinoma /
- liver cirrhosis /
- FIB-4 /
- hepatitis B virus /
- prognosis
-
肝细胞癌(hepatocellular carcinoma,HCC)是主要与乙型(HBV)和丙型(HCV)肝炎病毒感染相关的恶性肿瘤。在过去的几十年中,HCC在中国及全球的发生率持续升高,手术切除仍然是HCC的首要治疗手段[1-2]。然而,多数HCC患者术后5年生存率仍低于50% [2]。因此,建立简便可靠的指标用于筛选具备HCC手术适应证的患者并行术后监测,显得尤为重要。研究表明,HCC的典型特征为多数患者具有肝硬化病史,这一特点决定并影响了患者的局部炎症/免疫微环境的变化[3]。在肝硬化诱导慢性炎症的长期过程中,各种炎症细胞如中性粒细胞、淋巴细胞、单核细胞、成纤维细胞等促进癌细胞的增殖,并进而提供肿瘤形成的肥沃“土壤” [4]。本课题组前期研究已经证实单核/淋巴细胞比率(MLR)与HCC术后患者的预后密切相关[5]。近年研究发现,通过病理组织检查和肝组织硬度检测(LSM)进行肝硬化评分也能预测HCC术后患者的生存和复发[6-7]。因此,本文研究分析了肝硬化评分系统FIB-4与HCC患者的临床病理特征及预后的关系。
1. 材料与方法
1.1 临床资料
选取2009年1月至2012年12月期间重庆医科大学附属第一医院肝胆外科术后病理诊断的HCC患者245例。所有病例均需符合以下标准:1)所有患者均检测HBV表面抗原和HBV DNA定量;2)完整的实验室检测数据;3)CT或MRI排除远处转移;4)术前未行抗癌治疗;5)肿瘤根治性切除;6)完整的随访记录,包括各项实验室检查及影像学检查;7)术后生存1个月以上;8)排除肝病相关死亡。所选取的病例均通过医院伦理委员会审批,所有患者签署知情同意书。
1.2 方法
患者术前行常规实验室及影像学检查,除外手术禁忌证。术后半年,所有患者均定期每月随访,半年后,每3~6个月随访:包括甲胎蛋白、肝功能、腹部B超或CT等。根据前期的研究[8],FIB-4评分公式如下:年龄×谷草转氨酶(AST)/血小板计数(109/L)×谷丙转氨酶(ALT)1/2。根据文献报道,FIB-4Ⅰ≤3.25可能为轻度到中度肝纤维化(本研究无正常肝组织),FIB-4 Ⅱ > 3.25可能为重度肝纤维化或肝硬化[9]。术后肝切除标本由本院病理科评估,并予以肝硬化病理分级(Ishak分级)。
1.3 统计学分析
采用SPSS 18.0软件进行统计学分析,计数资料比较采用独立样本t检验或U检验,计量资料比较采用χ2检验或Fisher检验。Kaplan-Meier进行单因素生存分析,有统计学意义的指标进一步纳入Cox比例风险回归模型进行多因素生存分析。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 病例临床特征
男性208例,女性37例;中位年龄52(20~79)岁,≤50岁者111例, > 50岁者134例。其中,小肝癌(≤3.0 cm)89例,大肝癌( > 3.0 cm)156例;根据TNM分期,Ⅰ~Ⅱ期208例,Ⅲ期37例;根据Ishak分级,肝硬化108例,肝纤维化137例(表 1)。患者中位生存时间(OS)为40.5(4.0~50月)个月,中位无瘤生存时间(RFS)为37.1(1.0~49.5)个月。
表 1 肝细胞癌患者的临床病理特征Table 1. Clinical characteristics of patients with hepatocellular carcinoma
2.2 手术情况
肝根治性切除术采用双极电凝断肝[10]。其中,109例(44.5%)施行肝门血流阻断,13例(5.3%)予以输血支持,平均出血量约301(30~1 800)mL,手术均完整切除肿瘤,切缘距肿瘤边缘≥1~2 cm,术后病理证实切缘均无残留肿瘤。术后再出血 > 500 mL患者2例,胆漏5例,再次手术2例,无手术死亡病例。
2.3 临床病理特征与FIB-4及预后的关系
FIB-4主要与患者的肝功能,如:AST( < 0.001)、胆红素(P=0.009)、白蛋白(P=0.001)及血小板计数(P < 0.001)相关,与Ishak病理分级(1~5级 vs. 6级)呈正相关(r=0.681,P < 0.001),与肿瘤病理特征缺乏相关性(如:甲胎蛋白、肿瘤大小、肿瘤数目、癌栓和TNM分期)。单因素分析显示:AST(P=0.041)、癌栓(P=0.004)、肿瘤大小(P < 0.001)、TNM临床分期(P=0.011)、血小板计数(P=0.049)和肿瘤数目(P=0.007)与OS有关;AST(P=0.046)、癌栓(P < 0.001)、肿瘤大小(P < 0.001)、TNM临床分期(P=0.003)、甲胎蛋白(P=0.008)与RFS有关。在进一步的多因素分析中发现:肿瘤大小、肿瘤数目和TNM分期分别能预测OS;癌栓、肿瘤大小和TNM分期则与RFS相关(表 2)。
表 2 患者总生存时间和无瘤生存时间的单因素和多因素分析Table 2. Univariate and multivariate analyses for the overall and recurrence free survival of patients
2.4 FIB-4与HCC患者预后的关系
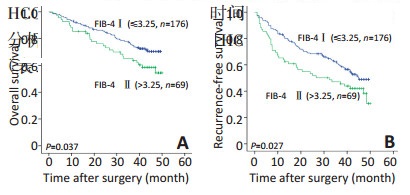
基于FIB-4评分的肝硬化和肝纤维化患者中,肝纤维化患者的OS长于肝硬化组(均值:37.0 vs. 33.4个月,P < 0.001,图 1A),肝纤维化患者的RFS时间明显优于肝硬化患者(均值:31.2 vs. 25.8个月,P < 0.001,图 1B)。单因素及多因素分析结果显示:FIB-4与HCC患者的OS(P=0.037,0.011)及RFS(P=0.027,0.043)均显著相关(表 2)。
2.5 高FIB-4组( > 3.25,n=69)中临床病理特征与预后的关系
因为FIB-4 > 3.25能够预测肝硬化,并与HCC的预后差有关,进一步分析其亚组中各临床病理特征与HCC预后的关系。单因素分析显示,相对晚期HCC(TNM Ⅲ期)患者生存时间短,易复发。多因素分析进一步证实,TNM Ⅲ期HCC患者预后明显更差(表 3)。
表 3 高FIB-4评分组( > 3.25,n=69)的预后分析Table 3. Prognostic analyses of high FIB-4 scoring subgroup ( > 3.25, n=69)
3. 讨论
肝硬化对术后患者的潜在影响目前仍缺乏确切的评估报告。最近,日本学者Toyoda等[11]发现,在一组行根治性肝切除术且多数为HCV感染(62.7%)的HCC患者中,FIB-4能够预测其术后生存情况。因此,FIB-4可能也与HBV感染的HCC患者的预后存在联系,目前尚无相关研究开展。
本研究发现,基于FIB-4评分的肝硬化患者(FIB-4 > 3.25)在根治性肝切除术后可能有更短的生存时间和较高的复发率,尤其是大肝癌和临床分期相对较晚的患者预后更差。我们认为,肝硬化组织中的一些炎症相关因素与此有关。首先,手术切除主要针对肿瘤组织而非肝硬化组织,癌旁的肝硬化组织本身也是肿瘤炎症内环境的一部分,并与肿瘤细胞、肝炎病毒等相互影响,是术后复发的高危因素。其次,手术减除肿瘤负荷以后,肝硬化组织和肝炎病毒仍可促进肝功能损伤和肝内复发。HCC的术后复发部分可能源于肝硬化组织中残存的肿瘤细胞,而非原发肿瘤[12]。另外,有研究显示[13],循环肿瘤细胞能够被肝硬化组织中的炎症细胞招募,进而成为最终局部复发的根源。这也与前期炎症与肿瘤相关性的研究结果基本一致[5]。
本研究中,虽然FIB-4与肝癌总生存及无瘤生存相关,但并未发现其与HCC预后相关的重要病理指标相关(如:甲胎蛋白、肿瘤大小、肿瘤数目、癌栓和TNM分期)。因为大多数的HCC是由肝硬化和肿瘤两种疾病组成,二者均是影响HCC预后的重要因素[14]。肝硬化的预后与患者的炎症和肝功能情况密切相关。而影响肿瘤的预后因素则更加复杂,除了慢性炎症背景外,肿瘤还具备另外六大特征:过度增生、生长抑制(肿瘤抑制基因)、侵袭转移、无限复制、血管化生成和持续细胞凋亡。这些均与多种细胞信号活化和肿瘤基因变异形成的复杂信号网络密切相关[15]。FIB-4则仅仅反映了它们所致的肝功能损害结果[16]。如结合肿瘤病理特征与FIB-4,可能会更加准确地判断HCC的预后。
在这项回顾性研究中,所有的患者均有不同程度的肝纤维化,所以本研究仅将研究对象分为FIB-4Ⅰ(≤ 3.25)和FIB-4Ⅱ( > 3.25)两组。对于正常肝组织的FIB-4评分未做进一步研究,也意味在其他不同研究对象中,FIB-4Ⅰ(≤3.25)可能同时包含正常肝组织和肝纤维化组织。若扩大标本量,本研究将关注高FIB-4是否与更多的肿瘤病理特征相关(如癌栓、肿瘤大小和数目等)。所以,需要开展更加严格的多中心、大样本研究及具体的分子机制研究,以验证本研究的结果。
综上所述,炎症在HCC的发生发展中起着重要的作用。肝硬化组织是肿瘤发生的重要炎症微环境,通过与肿瘤细胞之间复杂的相互作用,影响HCC的预后。FIB-4能够预测HCC患者术后的生存情况,结合其他肿瘤标记,可能有助于HCC术后复发高危患者的监测和随访,及患者术后是否进行更有效的辅助治疗(如:肝动脉化疗栓塞、生物治疗等)的选择和判断。本研究相信,前瞻性临床研究将有助于研究结果的论证和临床应用。
-
表 1 肝细胞癌患者的临床病理特征
Table 1 Clinical characteristics of patients with hepatocellular carcinoma

表 2 患者总生存时间和无瘤生存时间的单因素和多因素分析
Table 2 Univariate and multivariate analyses for the overall and recurrence free survival of patients

表 3 高FIB-4评分组( > 3.25,n=69)的预后分析
Table 3 Prognostic analyses of high FIB-4 scoring subgroup ( > 3.25, n=69)

-
[1] Wei KR, Yu X, Zheng RS, et al.Incidence and mortality of liver cancer in China, 2010[J]. Chin J Cancer, 2014, 33(8):388-394. DOI: 10.1186/s40880-015-0056-0
[2] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1):7-30. DOI: 10.3322/caac.21387
[3] Sia D, Villanueva A, Friedman SL, et al.Liver Cancer cell of origin, molecular class, and effects on patient prognosis[J]. Gastroenterology, 2017, 152(4):745-761. DOI: 10.1053/j.gastro.2016.11.048
[4] Chen MM, Xiao X, Lao XM, et al. Polarization of tissue-resident TFHlike cells in human hepatoma bridges innate monocyte inflammation and M2b macrophage polarization[J]. Cancer Discov, 2016, 6 (10):1182-1195. DOI: 10.1158/2159-8290.CD-16-0329
[5] 唐涛, 廖锐, 李静, 等.肝细胞癌患者根治性切除术后的预后因素分析[J].中华外科杂志, 2016, 54(6):439-443. http://cdmd.cnki.com.cn/Article/CDMD-12121-1016267844.htm Tang T, Liao R, Li J, et al. Analysis of prognostic factors of patients with hepatocellular carcinoma after radical resection[J]. Chin J Surg, 2016, 54(6):439-443. http://cdmd.cnki.com.cn/Article/CDMD-12121-1016267844.htm
[6] Wang Q, Fiel MI, Blank S, et al. Impact of liver fibrosis on prognosis following liver resection for hepatitis B-associated hepatocellular carcinoma[J]. Br J Cancer, 2013, 109(3):573-581. DOI: 10.1038/bjc.2013.352
[7] Jung KS, Kim SU, Choi GH, et al. Prediction of recurrence after curative resection of hepatocellular carcinoma using liver stiffness measurement (FibroScan®)[J]. Ann Surg Oncol, 2012, 19(13):4278-4286. DOI: 10.1245/s10434-012-2422-3
[8] Yin Z, Zou J, Li Q, et al. Diagnostic value of FIB-4 for liver fibrosis in patients with hepatitis B: a meta-analysis of diagnostic test[J]. Oncotarget, 2017. doi: 10.18632/oncotarget.14430.
[9] Vallet-Pichard A, Mallet V, Nalpas B, et al. FIB-4: an inexpensive and accurate marker of fibrosis in HCV infection. comparison with liverbiopsy and fibrotest[J]. Hepatology, 2007, 46(1):32-36. DOI: 10.1002/(ISSN)1527-3350
[10] 郭剑洋, 杜成友, 李德卫, 等.肝切除术中单用双极电凝断肝的临床研究[J].中华外科杂志, 2014, 52(7):547-550. http://cdmd.cnki.com.cn/Article/CDMD-10631-1014409093.htm Guo JY, Du CY, Li DW, et al. Clinical research of saline-coupled bipolar electrocautery for hepatic transection[J]. Chin J Surg, 2014, 52 (7):547-550. http://cdmd.cnki.com.cn/Article/CDMD-10631-1014409093.htm
[11] Toyoda H, Kumada T, Tada T, et al. A laboratory marker, FIB-4 index, as a predictor for long-term outcomes of hepatocellular carcinoma patients after curative hepatic resection[J]. Surgery, 2015, 157(4): 699-707. DOI: 10.1016/j.surg.2014.10.022
[12] Bruix J, Gores GJ, Mazzaferro V.Hepatocellular carcinoma: clinical frontiers and perspectives[J]. Gut, 2014, 63(5):844-855. DOI: 10.1136/gutjnl-2013-306627
[13] 罗斌, 阙祖俊, 田建辉.髓源性抑制细胞促进循环肿瘤细胞形成转移的研究进展[J].中国肿瘤临床, 2016, 43(11):493-497. DOI: 10.3969/j.issn.1000-8179.2016.11.203 Luo B, Que ZJ, Tian JH. Progress on metastasis induced by myeloidderived suppressor cells to promote circulating tumor cell[J]. Chin J Clin Oncol, 2016, 43(11):493-497. DOI: 10.3969/j.issn.1000-8179.2016.11.203
[14] Arzumanyan A, Reis HM, Feitelson MA. Pathogenic mechanisms in HBV-and HCV-associated hepatocellular carcinoma[J]. Nat Rev Cancer, 2013, 13(2):123-135. DOI: 10.1038/nrc3449
[15] Hanahan D, Robert A. Weinberg. Hallmarks of Cancer: The Next Generation[J]. Cell, 2011, 144(5):646-674. DOI: 10.1016/j.cell.2011.02.013
[16] Kim WR, Berg T, Asselah T, et al.Evaluation of APRI and FIB-4 scoring systems for non-invasive assessment of hepatic fibrosis in chronic hepatitis B patients[J]. J Hepatol, 2016, 64(4):773-780. DOI: 10.1016/j.jhep.2015.11.012
-
期刊类型引用(4)
1. 李玉珍,谢小华,伍文宁,洪峻峰. 基于超声和血清学特征的列线图预测肝细胞癌微血管浸润. 中国超声医学杂志. 2024(05): 547-550 .  百度学术
百度学术
2. 李臻,李杰,李鑫,张玉元,吕培杰,胡鸿涛,吴阳,王彩鸿,余鹏,李一帆. 非侵入性肝纤维化诊断模型对肝癌DEB-TACE术后急性肝功能恶化的预测与生存分析. 临床放射学杂志. 2023(09): 1507-1512 .  百度学术
百度学术
3. 刘忠杰,赵宁,宋永祯,李桂芬. 血清肿瘤标志物CA153、CA125、CA72-4及FIB、IL-6水平用于卵巢癌检测的临床意义. 海南医学院学报. 2018(01): 94-96+100 .  百度学术
百度学术
4. 王海生,卢朝辉. GP73、APRI、FIB-4在慢性HBV感染肝纤维化中的诊断价值. 热带医学杂志. 2018(10): 1299-1303+1402 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: