Clinicopathological features and prognostic factors of neuroendocrine neoplasms at different sites in the digestive system
-
摘要:目的 探讨消化系统不同部位神经内分泌肿瘤(neuroendocrine neoplasms,NENs)的临床病理特征及预后因素。方法 收集天津医科大学肿瘤医院2011年3月至2015年12月收治的284例消化系统NENs,分析比较不同部位NENs临床病理特征的异同,并进行生存分析。结果 本研究中,消化系统NENs以胰腺部位最多见,其次为结直肠、胃。在胰腺NENs中,以G1(51.8%)和G2(35.8%)型为主,WHO分类与淋巴结转移、周围器官侵犯、神经侵犯有关(均P <0.05),但与患者的总生存无关;有远处转移的胰腺NENs患者总生存期更短(P <0.05)。结直肠NENs以NET G1为主(82.5%),大多经内镜下切除或经肛门直肠肿物切除;神经内分泌癌、有淋巴结转移、有远处转移和进展期患者的总生存期更短(均P <0.05)。与胰腺和结直肠相比,胃NENs中男性患者、年龄> 40岁的患者更多;神经内分泌癌和混合性腺神经内分泌癌比例更高、淋巴结转移和远处转移的比例更高;进展期的患者更多(均P <0.05)。WHO分类和有无淋巴结转移与胃NENs的总生存期有关(均P <0.05)。结论 消化系统NENs是一组异质性肿瘤,不同部位的肿瘤具有不同的临床病理特征,并与欧美国家存在差异。仍需要大样本多中心研究来了解不同部位消化系统NENs的生物学行为及预后因素。Abstract:Objective To explore the clinicopathological characteristics and prognostic factors of neuroendocrine neoplasms (NENs) at different sites in the digestive system.Methods The clinicopathological parameters and follow-up data were collected from 284 patients with NENs in the digestive system in Tianjin Medical University Cancer Institute and Hospital from March 2011 to December 2015. The incidence and clinicopathological features were compared between the cases of NENs at different sites and survival analysis was performed.Results In this study, NENs were detected mostly frequently in the pancreas, followed by the colorectum and stomach. In the pancreas, neuroendocrine tumor (NET) G1 (51.8%) and G2 (35.8%) accounted for a large proportion of NENs. World Health Organization (WHO) grades were related to lymph node metastasis, adjacent organ invasion, and nerve invasion (P <0.05 for all) but were not associated with the overall survival time of the patients. The patients with pancreatic NENs with distant metastasis had poor overall survival (P <0.05). Regarding colorectal NENs, most patients had NET G1 (82.5%), and the majority of patients were cured with endoscopic or transanal resection. Patients with NENs, lymph node metastasis, and distant metastasis had poor overall survival (P <0.05 for all). The ratio of male-to-female patients, proportion of patients aged older than 40 years, prevalence of neuroendocrine carcinomas (NECs) and mixed adenoneuroendocrine carcinomas (MANECs), presence of lymph node and distant metastasis, and presence of advanced stage tumors were greater in patients with gastric NENs than in patients with pancreatic and colorectal NENs (P <0.05 for all). WHO grades and lymph node metastasis were associated with the overall survival time of patients with gastric NENs (P <0.05 for both).Conclusions NENs in the digestive system are a group of heterogeneous tumors with different clinicopathological features at different sites. The distribution and clinicopathological features of Chinese patients with NENs in the digestive system are different from those of European and American patients. More multicenter studies with large sample sizes are still needed to understand the biological behaviors and prognostic factors of NENs at different sites in the digestive system.
-
Keywords:
- neuroendocrine neoplasms /
- stomach /
- intestines /
- pancreas /
- prognosis
-
神经内分泌肿瘤(neuroendocrine neoplasms,NENs)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,可发生于全身多个器官和组织,其中以消化系统最为常见。消化系统肿瘤世界卫生组织(WHO)分类2010版对NENs进行了新分类。近几年消化系统NENs的诊断和治疗逐渐规范化,但对于新分类也发现一些问题。另外,我国病理和临床医生在实践工作中也发现我国的消化系统NENs在发病部位、临床特征等方面与欧美国家存在一定差异。我国目前关于消化系统NENs的相关报道相对较少,大宗病例的细致分析更少。因此,本研究收集了使用新分类后明确诊断为消化系统NENs的284例患者的临床病理资料和随访数据,根据部位、WHO分类进行了深入分析,旨在探讨我国消化系统NENs的临床病理特征及与患者生存相关的因素。
1. 材料与方法
1.1 病例资料
回顾性分析天津医科大学肿瘤医院2011年3月至2015年12月收治并经病理诊断为消化系统NENs的患者284例,收集患者性别、年龄、肿瘤部位、肿瘤大小、肿瘤浸润深度、WHO分类、临床分期、淋巴结转移、远处转移、随访等数据。284例患者中,男性169例(59.5%),女性115例(40.5%),男女比例为1.47:1。确诊年龄9~80岁,平均年龄(55.1±12.7)岁,中位年龄57岁。原发肿瘤263例,临床病理资料见表 1。随访时间从疾病确诊之日截至2016年8月31日。
表 1 263例原发胃肠胰NENs的部位分布及其临床病理特征 n(%)
1.2 方法
1.2.1 免疫组织化学染色
每例肿瘤组织经福尔马林固定、石蜡包埋,均进行Syn、CgA、Ki-67免疫组织化学染色。对于Syn、CgA表达不佳的部分病例加染CD56,基于鉴别诊断的需要,依据肿瘤部位补充免疫组织化学检测。所有石蜡标本制成4 μm切片后常规脱蜡,枸橼酸钠抗原修复,加入3%过氧化氢封闭10 min后按照说明书常规进行免疫组织化学染色。
1.2.2 消化系统NENs分类
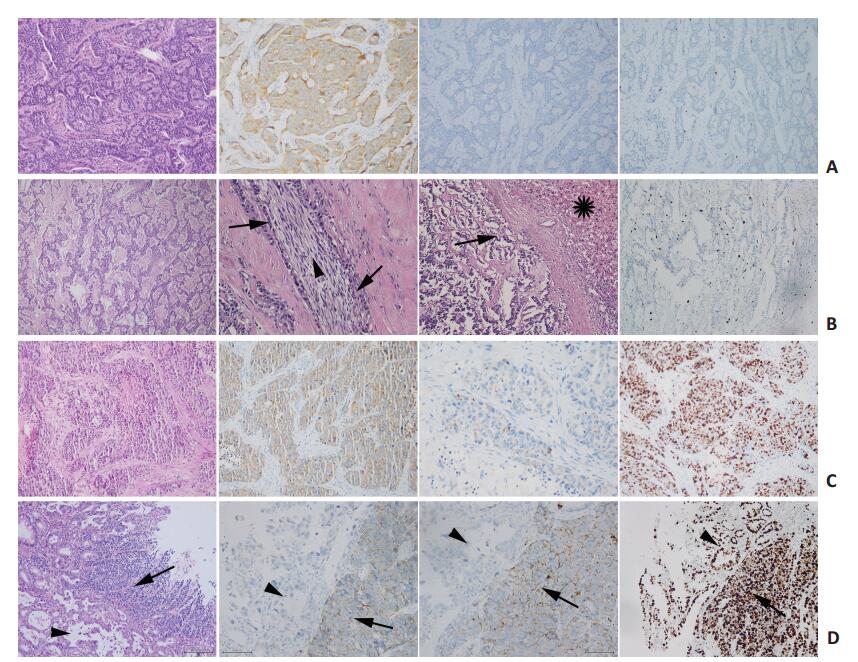
依据WHO 2010分类标准[1],消化系统NENs分为神经内分泌瘤(neuroendo crine tumor,NET)G1、NETG2、神经内分泌癌(neuro endocrine carcinoma,NEC)和混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)(图 1)。当核分裂象与Ki-67指数不一致时,以级别高的为准。MANEC严格按照WHO的定义,具有典型的腺癌和神经内分泌癌成分,且每种成分占30%以上。
![]() 图 1 胃肠胰NENs的病理图像A:1例直肠NET G1的H&E及免疫组织化学染色图像。肿物呈广基息肉样生长,经肛门内镜下切除。肿物位于黏膜下层,最大径0.8 cm,呈假菊形团样排列,细胞异型性小,核分裂象罕见。免疫组织化学Syn阳性、CgA阳性、Ki-67指数约1%。图像均为×200;B:1例胰腺NET G2的H&E及免疫组织化学染色图像。肿物位于胰体尾,体积4.0 cm×4.0 cm×3.5 cm,累犯脾周软组织,伴有肝转移(单发结节,直径约1 cm)。肿瘤细胞呈脑回状排列,细胞大小较一致,胞质细颗粒状,核染色质粗团块状(椒盐样),核分裂象5个/10高倍镜视野;可见肿瘤细胞围神经侵犯、脉管癌栓及肝转移。▶:神经内分泌瘤;➝:神经;❋:肝实质。免疫组织化学Ki-67指数约为5%。除肝转移H&E图像为×100,其余图像均为×200;C:1例胃NEC的H&E及免疫组织化学染色图像。肿瘤位于贲门,溃疡型,最大径6 cm。肿瘤为大细胞型,由弥漫不规则排列的片状细胞构成,可见地图样坏死,核分裂象>50个/10高倍镜视野。免疫组织化学Syn阳性、CgA阳性(核旁点状着色)、Ki-67指数约85%。除CgA免疫组织化学图像为×400,其余图像均为×200;D:1例胃MANEC的H&E及免疫组织化学染色图像。肿物位于胃体,呈表浅溃疡,体积约2 cm×1 cm。肿瘤位于黏膜内,由腺癌(中分化管状腺癌)和NEC(大细胞型)共同组成,各占50%。免疫组织化学:腺癌Syn阴性、CgA阴性、Ki-67指数约70%;神经内分泌癌Syn阳性、CgA阳性、Ki-67指数约为80%。▶:NEC;➝:腺癌。H&E和Ki-67免疫组织化学图像为×100,Syn和CgA免疫组织化学图像为×200
图 1 胃肠胰NENs的病理图像A:1例直肠NET G1的H&E及免疫组织化学染色图像。肿物呈广基息肉样生长,经肛门内镜下切除。肿物位于黏膜下层,最大径0.8 cm,呈假菊形团样排列,细胞异型性小,核分裂象罕见。免疫组织化学Syn阳性、CgA阳性、Ki-67指数约1%。图像均为×200;B:1例胰腺NET G2的H&E及免疫组织化学染色图像。肿物位于胰体尾,体积4.0 cm×4.0 cm×3.5 cm,累犯脾周软组织,伴有肝转移(单发结节,直径约1 cm)。肿瘤细胞呈脑回状排列,细胞大小较一致,胞质细颗粒状,核染色质粗团块状(椒盐样),核分裂象5个/10高倍镜视野;可见肿瘤细胞围神经侵犯、脉管癌栓及肝转移。▶:神经内分泌瘤;➝:神经;❋:肝实质。免疫组织化学Ki-67指数约为5%。除肝转移H&E图像为×100,其余图像均为×200;C:1例胃NEC的H&E及免疫组织化学染色图像。肿瘤位于贲门,溃疡型,最大径6 cm。肿瘤为大细胞型,由弥漫不规则排列的片状细胞构成,可见地图样坏死,核分裂象>50个/10高倍镜视野。免疫组织化学Syn阳性、CgA阳性(核旁点状着色)、Ki-67指数约85%。除CgA免疫组织化学图像为×400,其余图像均为×200;D:1例胃MANEC的H&E及免疫组织化学染色图像。肿物位于胃体,呈表浅溃疡,体积约2 cm×1 cm。肿瘤位于黏膜内,由腺癌(中分化管状腺癌)和NEC(大细胞型)共同组成,各占50%。免疫组织化学:腺癌Syn阴性、CgA阴性、Ki-67指数约70%;神经内分泌癌Syn阳性、CgA阳性、Ki-67指数约为80%。▶:NEC;➝:腺癌。H&E和Ki-67免疫组织化学图像为×100,Syn和CgA免疫组织化学图像为×2001.3 统计学分析
采用SPSS 22.0软件进行统计学分析。计量资料以x±s表示,组间比较采用t检验;计数资料组间比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier法、Logrank检验进行单因素生存分析,Cox回归进行多因素生存分析。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 全部病例的分布特征与生存分析
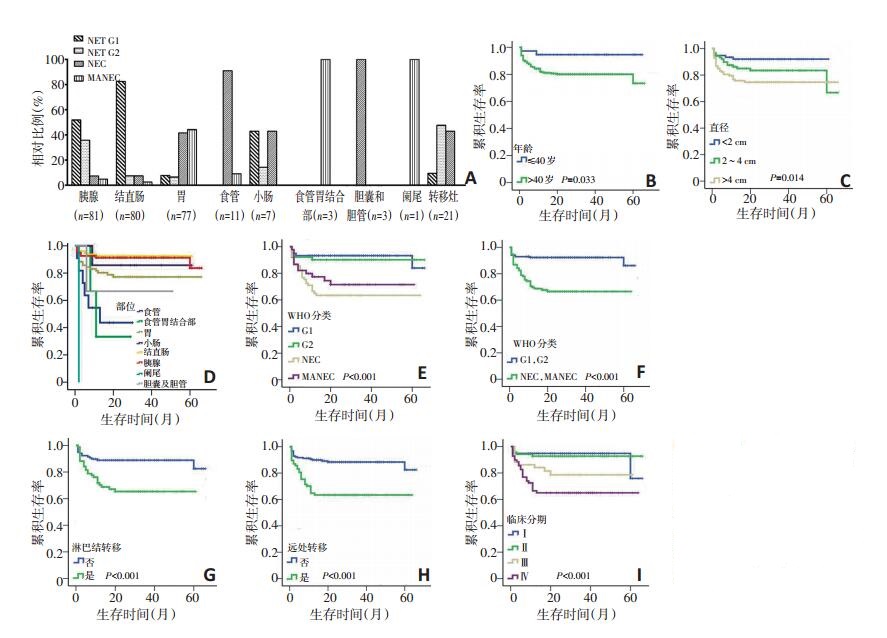
284例患者中,263例原发肿瘤部位分布为胰腺81例(30.8%)、结直肠80例(30.4%)、胃77例(29.3%)、食管11例(4.2%)、小肠7例(2.7%)、食管胃结合部3例(1.1%)、胆囊及胆管3例(1.1%)、阑尾1例(0.4%)。21例来自转移灶,其中肝转移灶16例(原发于胰腺、胆道和十二指肠分别为10、2、1例,3例排除肺原发、同时有腹膜后淋巴结转移但原发灶不明)、腹膜后转移灶5例(原发于胰腺和十二指肠分别为3、1例,1例原发灶不明)。在263例原发肿瘤中,256例经手术切除,7例经咬检、穿刺或切取活检确诊。手术切除的原发瘤平均直径为(4±3.2)cm,其中 < 2 cm、2~4 cm和>4 cm者各为75例(29.3%)、80例(31.3%)和101例(39.4%)。依照2010年WHO分类标准,对全部肿瘤进行分类:NET G1 119例(41.9%)、NET G2 51例(18.0%)、NEC 69例(24.3%)、MANEC 45例(15.8%)。各器官肿瘤的分类见图 2A。在全部病例中,177例(62.3%)行手术切除原发肿瘤,72例(25.4%)手术切除联合化疗,4例(1.4%)手术切除联合生物治疗,3例(0.7%)手术切除联合化疗与靶向治疗,8例(2.8%)仅进行转移灶切除,13例(4.6%)仅进行化疗,2例(0.7%)化疗联合生物治疗,1例(0.4%)仅行靶向治疗,1例(0.4%)行放疗联合化疗,3例(1.1%)放弃治疗。在263例原发肿瘤中,188例进行了淋巴结清扫,其中有75例(39.9%)发生淋巴结转移。250例原发性肿瘤具有临床分期资料,根据美国癌症联合委员会(AJCC)TNM分期标准,Ⅰ期76例(30.4%)、Ⅱ期68例(27.2%)、Ⅲ期51例(20.4%)、Ⅳ期55例(22.0%)。
全部病例的随访时间为1~66个月,平均32.4个月。截至随访结束,死亡51例,均为肿瘤相关性死亡(2例放弃治疗),平均总生存期为(26.8±17.3)个月,中位生存期为26个月。单因素生存分析显示,年龄、部位、直径大小、WHO分类、分期、淋巴结转移、远处转移与患者生存相关(均P < 0.05,图 2B~I),患者年龄>40岁、发生于胃部、肿瘤直径>4 cm、NEC和MAN EC、Ⅳ期、发生淋巴结转移和发生远处转移的患者总生存期较短。而性别与总生存期无相关(P=0.250)。对单因素分析有意义的指标进行Cox回归分析,结果显示有无淋巴结转移(P=0.003,HR=2.847,95%CI:1.433~5.658)和有无远处转移是独立预后因素(P= 0.023,HR=2.125,95%CI:1.111~4.063)。
2.2 胰腺NENs
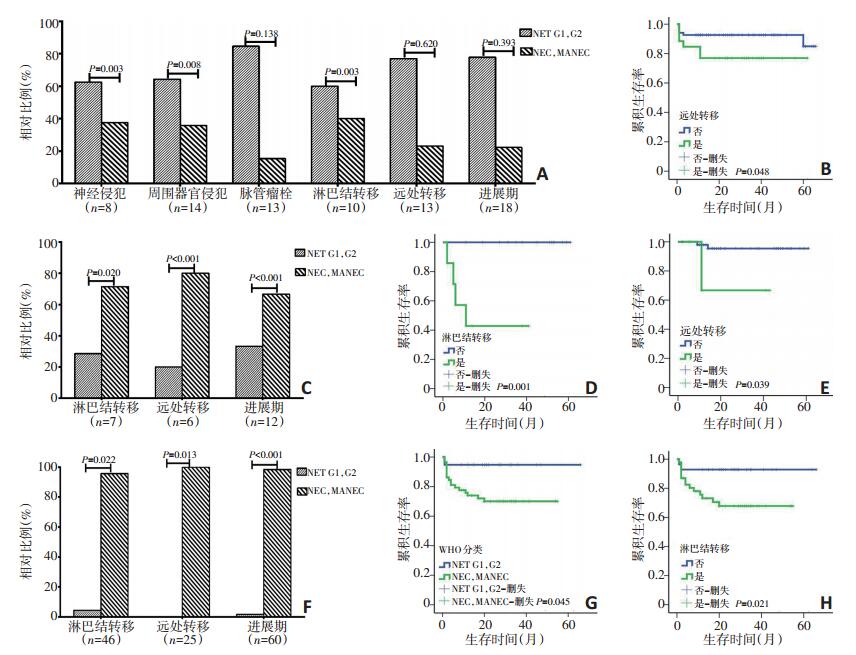
81例胰腺NENs中,30例(37.0%)位于胰头颈,51例(63.0%)位于胰体尾;78例进行根治切除,1例进行肿物切除,1例肿物切检,1例穿刺活检。患者的平均年龄为(49.9±14.2)岁。原发肿瘤和患者的临床病理特征见表 1。在根治标本中,8例(10.3%)侵犯神经,14例(17.9%)侵犯周围器官,13例(16.7%)提示脉管瘤栓。根据WHO分类与上述侵袭性行为及转移之间的关系(图 3A)进行分析,结果显示,与NEC和MANEC相比,NET G1、G2中淋巴结转移、周围器官侵犯、神经侵犯比例更高(分别为P=0.003、0.008、0.003),而不同分类肿瘤在脉管瘤栓、远处转移和临床分期方面差异无统计学意义(分别为P=0.138、0.620、0.393)。截至随访结束,8例患者死亡,其中G1 5例、G2 2例、NEC 1例,患者的平均总生存期为(30.6±19.3)个月。单因素生存分析显示,性别(P=0.658)、年龄(P= 0.222)、直径(P=0.330)、WHO分类(P=0.217)、侵犯周围器官(P=0.483)、侵犯神经(P=0.689)和脉管瘤栓(P= 0.192)、有无淋巴结转移(P=0.938)、有无远处转移(P= 0.381)、临床分期(P=0.126)均与总生存期无关。
另有,13例转移性NENs来自胰腺。对转移灶进行分类评估,G1、G2和NEC分别为2例(15.4%)、6例(46.1%)和5例(38.5%)。截至随访结束,4例(G2 2例、NEC 2例)患者死亡,患者的平均总生存期为(29± 19.9)个月。对全部原发于胰腺的94例NENs患者进行单因素生存分析,结果显示有远处转移的患者总生存期较短(P=0.048,图 3B)。
2.3 结直肠NENs
80例结直肠NENs的临床病理资料见表 1。其中,右半结肠5例(6.2%),左半结肠3例(3.8%),直肠72例(90.0%)。患者的平均年龄为(53.4±12.9)岁。21例进行了肠区段切除手术,37例进行了内镜下肿物切除术,19例经肛门直肠肿物局切术,3例咬检。其中,NET占90%(G1为82.5%,G2为7.5%),而NEC和MANEC分别仅占7.5%和2.5%。21例进行淋巴结清扫的病例中有7例(33.3%)出现淋巴结转移,其中G1 1例、G2 1例、NEC 5例。与NET G1和G2相比,NEC和MANEC中淋巴结转移、远处转移、进展期的比例更高(分别为P=0.020、< 0.001、< 0.001,图 3C)。在随访结束时,6例患者死亡,其中G1 2例、NEC 4例。单因素生存分析结果显示,有淋巴结转移(P= 0.001)、有远处转移(P=0.039)的患者总生存期较短(图 3D,E),进展期患者的生存期有较短的趋势但差异无统计学意义(P=0.078),而性别(P=0.124)、年龄(P=0.490)、肿瘤直径(P=0.164)、WHO分类(P= 0.212)均与患者总生存期无关。
与胰腺NENs相比,结直肠NENs中NET G1所占比例更高(P < 0.001)、肿瘤体积更小(P < 0.001)、淋巴结转移的病例更少(P < 0.001)、临床分期更早(P < 0.001,表 1)。
2.4 胃NENs
77例胃NENs的临床病理资料见表 1。男女比例为3.1:1,患者的平均年龄为(60.0±9.4)岁,97.4%的患者在确诊时>40岁。肿瘤位于近端胃者47例(61.0%),远端胃30例(39.0%)。74例行胃大部切除或全胃切除术,3例行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)。74例进行淋巴结清扫的病例中46例(62.2%)发生淋巴结转移,其中G1、G2、NEC、MANEC各为1、1、17、27例,NEC和MANEC中淋巴结转移的比例更高(P=0.022)。诊断时发现远处转移的25例患者中,NEC 14例,MANEC 11例,而NET未见远处转移,WHO分类与远处转移有显著相关性(P=0.013)。
另外,NEC和MANEC中进展期的患者比例较高(P < 0.001)。WHO分类与淋巴结转移、远处转移和分期的关系见图 3F。在随访结束时,17例患者死亡,其中G1、NEC、MANEC各为2、7、8例。单因素生存分析显示,NEC和MANEC(P=0.045)及有淋巴结转移(P= 0.021)的患者总生存期较短(图 3G,H);而性别(P= 0.605)、年龄(P=0.463)、肿瘤直径(P=0.501)、有无远处转移(P=0.426)、临床分期(P=0.116)均与总生存期无关。与胰腺和结直肠相比,胃NENs中男性患者的比例更大(分别为P=0.008、< 0.001),40岁以上的患者更多(分别为P=0.002、< 0.001),NEC和MANEC比例更高(均P < 0.001),淋巴结转移的比例更高(分别为P=0.019、< 0.001),远处转移的比例更高(分别为P= 0.002、0.016),进展期的患者更多(均P < 0.001,表 1)。
2.5 其他部位NENs
其他部位NENs的临床病理资料见表 1。发生在食管的11例NENs中,NEC 10例(90.9%),MANEC 1例(9.1%),未见NET G1或G2。10例进行了根治性手术,其中5例(50.0%)发现淋巴结转移,4例(40.0%)发现远处转移。在随访结束时,6例死亡,平均总生存期为(11.6± 9.1)个月。3例食管胃结合部的NENs均为MANEC,2例进行了根治性手术,其中1例发现淋巴结转移,2例出现远处转移。在随访结束时,2例死亡,平均总生存期为(16±11.3)个月。
7例发生在小肠的NENs中,5例来自十二指肠。NET G1、G2、NEC分别为3例(42.8%)、1例(14.4%)、3例(42.8%)。6例进行了根治性手术切除,1例行肿物切除术。在根治性手术切除的病例中,4例(57.1%)发现淋巴结转移(G1、G2、NEC各为1、1、2例)。3例发现远处转移,均为NEC。在随访结束时,仅1例NEC患者死亡,生存9个月。另外,1例腹膜后转移性NET G2和1例肝转移性NEC的原发病灶为十二指肠,肝转移性NEC患者在随访结束时已死亡,生存8个月。
2例胆囊NENs均为NEC,均累及肝脏与肠系膜或网膜。1例胆囊管NEC,虽未检测到淋巴结转移或远处转移,但肿瘤内可见神经侵犯及脉管瘤栓,且肿瘤细胞沿胆管播散,胆管上、下切端均见肿瘤累犯。另外,2例肝转移性NEC的原发灶为胆管下段。这5例患者截至随访结束,3例死亡,平均总生存期为(26.0±22.9)个月。仅收集到1例发生在阑尾的NE Ns,为MANEC,未见淋巴结转移,但发现远处转移,术后仅生存2个月。
3. 讨论
1907年德国病理学家Oberndorfer首次提出了“类癌(carcinoid)”或“类癌瘤(carcinoid tumor)”这一术语。随后,又出现了“胺前体摄取及脱羧(amine precursor uptake and decarboxylation,APUD)肿瘤”或“弥散性神经内分泌系统肿瘤”的名称。WHO于2000年在消化系统规范了“神经内分泌肿瘤”的概念,并于2010年又提出新的分类标准,逐渐统一了对这一类肿瘤的命名及分级。Yao等[2]对美国国立癌症研究所监测、流行病学和结果数据库(SEER)的统计分析显示,美国消化系统NENs的发病率从1973年的1.09/10万增长至2004年的5.25/10万。在挪威、英国和德国,消化系统NENs的发病率在近年来也出现显著上升[3-5]。而中国目前鲜见对消化系统NENs的发病率、死亡率的报道。
在本组病例中,胰腺(30.8%)、结直肠(30.4%)和胃(29.3%)占据消化系统NENs的前三位。来自中国23个医院、包含2001年至2010年共2 010例胃肠胰NENs的流行病学研究显示,胰腺(31.5%)和直肠(29.6%)是胃肠胰NENs的最常见原发部位,随后是胃(15.4%)和贲门(11.6%)[6]。中国其他一些小样本研究也显示,国内消化系统NENs以胰腺、结直肠、胃多见[7-15]。而Sandvik等[3]通过对挪威的204例病例进行分析,结果显示胃肠胰NENs在挪威多发生于小肠,其次为阑尾。法国的668例病例分析表明发生于小肠和结肠的胃肠胰NENs占主要部分,其次为胰腺[16]。Tsikitis等[17]通过对SEER数据库1975年至2008年的19 669例胃肠胰NENs进行分析,结果显示以小肠的发病率最高,其次为直肠。中国与欧美国家胃肠胰NENs主要发病部位的差异可能与人种、饮食生活习惯、医疗检测水平差异等因素有关。
本研究对284例胃肠胰NENs的单因素生存分析显示,年龄>40岁、发生于胃、肿瘤直径>4 cm、NEC和MANEC、Ⅳ期、淋巴结转移和远处转移的胃肠胰NENs患者的总体生存较差。进一步的多因素Cox回归分析显示,有无淋巴结转移和远处转移是患者总体生存的独立预后因素。国内其他几个研究也显示发生淋巴结转移和远处转移为影响胃肠胰NENs患者生存的重要因素[7, 13, 18]。另外,几个国内研究还提示肿瘤直径、WHO分类或患者年龄也是影响胃肠胰NENs患者生存的重要因素[8-9, 12, 14]。Garcia-Carbonero等[19]通过对西班牙胃肠胰NENs国家癌症登记处(RGETNE)的837例胃肠胰NENs数据进行统计分析发现,临床分期和Ki-67指数为独立预后因素。但是,一些研究者对目前Ki-67指数判断NEN分类的标准提出质疑,至少在胰腺NENs中,以Ki-67标记指数为2%作为G1、G2的界值不能很好地提示预后,而将5%作为界值进行生存分析更有意义[20-25]。并且,有报道在即将出版的WHO新胃肠胰NENs分类中,将原来的NEC分为NET G3和分化差的NEC[26]。在本研究中,WHO分类仅在胃NENs中与患者生存有关。鉴于不同部位的组织发生存在差异,如胃和结直肠分别来源于胚胎期的前肠和后肠、胰腺是一个既包括内分泌又包括外分泌组织的器官,因此本研究认为在某一特定部位分析NENs的临床病理特征和预后因素更合理、更有临床意义。本研究结果显示,胰腺NENs中NET G1和G2的比例均较大,且具有与胰腺癌类似的侵袭性行为,可见肝转移及腹膜后转移。甚至胰腺NET G1、G2中淋巴结转移、周围器官侵犯、神经侵犯比例高于NEC。Yadav等[27]对2003年至2012年间印度68例胰腺NENs进行研究发现,发生神经侵犯、周围器官侵犯、淋巴管浸润和淋巴结转移的胰腺NENs中,NET G1、G2所占比例更高,与本研究结果相一致。但是,本研究中NEC病例仅占胰腺NENs的7.4%,而NET占87.7%,并且临床送检淋巴结的数量、病理报告的详细程度均可能影响统计分析结果,WHO分类与胰腺NENs侵袭性行为的关系需要更多的大样本研究。另外,本研究结果显示,WHO分类与胰腺NENs患者的总体生存期无关,仅远处转移与患者生存有关。Ekeblad等[28]对瑞典324例胰腺NENs病例进行分析,结果显示TNM分期、WHO分类、根治性手术以及Ki-67指数≥2%为独立预后因素。Kim等[29]通过对韩国首尔峨山医院1995年至2015年277例胰腺NENs进行分析,结果显示WHO分级和淋巴血管侵犯为影响患者生存的独立预后因素。如上所述,一些研究者认为以Ki-67指数5%界定G1和G2的预后意义更强[20-25]。
本组病例的结直肠NENs中,NET占90.0%(G1为82.5%,G2为7.5%),与我国23家医院多中心研究中的直肠NET占87.6%(G1为75.8%,G2为11.8%)的研究结果基本一致[6],而Kourie等[30]对2001年至2012年间黎巴嫩89例胃肠胰NENs的统计结果显示,结直肠NENs仅9例,NET与NEC的比例为4:5。Sandvik等[3]对挪威的204例病例进行分析,结果显示结直肠NENs仅33例,NET与NEC的比例为16:17,均与中国患者的比例有明显的差别。在本组病例中,WHO分类与结直肠NENs患者的总体生存无关,淋巴结转移和远处转移与患者生存有关。Chagpar等[31]通过对美国国家癌症数据库(NCDB)中1998年至2002年被诊断为结直肠NENs的5 457例患者进行统计分析发现,肿瘤浸润深度、肿瘤直径大小、发生淋巴结转移及远处转移为独立预后因素,其中远处转移为最重要的影响因素。Shafqat等[32]对SEER数据库中2000年至2011年诊断为结直肠NEC的1 367例病例进行统计分析,结果显示确诊时年龄更大、男性、Ⅲ期或Ⅳ期以及小细胞类型与更差的生存显著相关。
在本组病例中,与结直肠NENs相比,胃部NENs中男性患者更多、40岁以上的患者更多、NEC和MANEC比例更高、淋巴结转移和远处转移的比例更高、进展期的患者更多。虽然食管及食管胃结合部的NENs病例较少,但也是以NEC和MANEC为主,淋巴结和远处转移多见,患者临床分期晚、预后差。这提示在前肠来源的消化道器官中,恶性度更高的NEC/MANEC更多见,患者预后更差。生存分析显示,WHO分类和淋巴结转移与胃NENs患者的总体生存有关。韩国首尔峨山医院1996年至2014年175例被诊断为胃NENs的患者数据研究显示,WHO G3级、淋巴结转移以及肿瘤浸润深度为影响患者生存的独立预后因素[33]。
上述结果提示,消化系统不同部位的NENs存在表型差异,导致临床处理方式不同,而且其内在的发病机制可能也存在差异。Meeker等[34]总结了68例胰腺NENs、48例小肠NETs与114例胰腺导管腺癌的测序结果,显示与胰腺导管腺癌和小肠NETs相比,胰腺NENs具有其独特的肿瘤相关基因变化,包括MEN1突变、ATRX/DAXX缺失和mTOR通路相关的基因PTEN、TSC2等的突变。Yadav等[27]报道ATRX/DAXX的缺失更多见于直径>5 cm的胰腺NENs,并且存在周围器官侵犯的胰腺NENs均检测到ATRX/DAXX缺失,提示ATRX/DAXX缺失可能与侵袭性表型有关。Kim等[35]报道ATRX/DAXX表达缺失、确诊年龄更晚、更高的肿瘤分级是未发现转移的胰腺NENs患者不良预后的独立因素;而对于发生转移的胰腺NENs,ALT阳性和ATRX/DAXX缺失则与更好的预后相关。Yachida等[36]利用测序和免疫组织化学的方法比较了胰腺NET和NEC,仅在NEC中检测到KRAS突变、p53表达异常、Rb缺失及Bcl-2的高频表达。但是,目前胃肠胰NENs的分类仍是建立在核分裂数目和Ki-67标记指数的基础上,其他分子标志物对于NENs的分类没有明确的诊断意义,但是可能具有潜在的预后意义。对于消化系统其他部位NENs分子标志物的报道较少,仍需要进一步研究。
目前,除了上述的分类标准还存在争议,胃肠胰NENs的临床分期也有待完善。现用的分期为AJCC2010年第7版TNM分期和欧洲神经内分泌协会的ENETS分期,但均有其局限性。在TNM分期中,尚无食管、胆囊和胆管NENs的内容(参照癌分期),阑尾、结直肠NENs的TNM分期系统尚未确定(仅有类癌/高分化肿瘤的TNM分期,低分化肿瘤参照癌),胰腺NENs采用胰腺导管腺癌的TNM分期。同时,临床医生对ENETS分期也存在争议[37]。Luo等[38]提出了对胰腺NENs改善的临床分期“mENETS”。本研究中均采用国内广泛使用的AJCC2010第7版的TNM分期方法,发现仅在结直肠NENs中,进展期患者具有较差的总体生存的趋势,但差异未达到统计学意义。因此,不同部位胃肠胰NENs的分类/分级及临床分期仍需要改善。
综上所述,胃肠胰NENs是一组异质性肿瘤,其发生发展机制、临床转归等方面尚未完全清楚。需要多中心、大样本研究完善诊断及分类标准,建立更好的分期标准,提出更有效的预后参数,从而改善胃肠胰NENs的诊治和预防,降低胃肠胰NENs的发病率及死亡率。
-
图 1 胃肠胰NENs的病理图像
A:1例直肠NET G1的H&E及免疫组织化学染色图像。肿物呈广基息肉样生长,经肛门内镜下切除。肿物位于黏膜下层,最大径0.8 cm,呈假菊形团样排列,细胞异型性小,核分裂象罕见。免疫组织化学Syn阳性、CgA阳性、Ki-67指数约1%。图像均为×200;B:1例胰腺NET G2的H&E及免疫组织化学染色图像。肿物位于胰体尾,体积4.0 cm×4.0 cm×3.5 cm,累犯脾周软组织,伴有肝转移(单发结节,直径约1 cm)。肿瘤细胞呈脑回状排列,细胞大小较一致,胞质细颗粒状,核染色质粗团块状(椒盐样),核分裂象5个/10高倍镜视野;可见肿瘤细胞围神经侵犯、脉管癌栓及肝转移。▶:神经内分泌瘤;➝:神经;❋:肝实质。免疫组织化学Ki-67指数约为5%。除肝转移H&E图像为×100,其余图像均为×200;C:1例胃NEC的H&E及免疫组织化学染色图像。肿瘤位于贲门,溃疡型,最大径6 cm。肿瘤为大细胞型,由弥漫不规则排列的片状细胞构成,可见地图样坏死,核分裂象>50个/10高倍镜视野。免疫组织化学Syn阳性、CgA阳性(核旁点状着色)、Ki-67指数约85%。除CgA免疫组织化学图像为×400,其余图像均为×200;D:1例胃MANEC的H&E及免疫组织化学染色图像。肿物位于胃体,呈表浅溃疡,体积约2 cm×1 cm。肿瘤位于黏膜内,由腺癌(中分化管状腺癌)和NEC(大细胞型)共同组成,各占50%。免疫组织化学:腺癌Syn阴性、CgA阴性、Ki-67指数约70%;神经内分泌癌Syn阳性、CgA阳性、Ki-67指数约为80%。▶:NEC;➝:腺癌。H&E和Ki-67免疫组织化学图像为×100,Syn和CgA免疫组织化学图像为×200
表 1 263例原发胃肠胰NENs的部位分布及其临床病理特征 n(%)

-
[1] Bosman FT, Carneiro F, Hruban RH, et al. WHO classification of tumours of the digestive system[M]. IARC Press, Lyon, 2010:64-68.
[2] Yao JC, Hassan M, Phan A, et al. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35, 825 cases in the United States[J]. J Clin Oncol, 2008, 26(18): 3063-3072. DOI: 10.1200/JCO.2007.15.4377
[3] Sandvik OM, Soreide K, Gudlaugsson E, et al. Epidemiology and classification of gastroenteropancreatic neuroendocrine neoplasms using current coding criteria[J]. Br J Surg, 2016, 103(3):226-232. DOI: 10.1002/bjs.2016.103.issue-3
[4] Fraenkel M, Kim M, Faggiano A, et al. Incidence of gastroenteropancreatic neuroendocrine tumours: a systematic review of the literature[J]. Endocr Relat Cancer, 2014, 21(3):R153-R163. DOI: 10.1530/ERC-13-0125
[5] Scherubl H, Streller B, Stabenow R, et al. Clinically detected gastroenteropancreatic neuroendocrine tumors are on the rise: epidemiological changes in Germany[J]. World J Gastroenterol, 2013, 19 (47):9012-9019. DOI: 10.3748/wjg.v19.i47.9012
[6] Fan JH, Zhang YQ, Shi SS, et al. A nation-wide retrospective epidemiological study of gastroenteropancreatic neuroendocrine neoplasms in china[J]. Oncotarget, 2017, 8(42):71699-71708. https://www.researchgate.net/publication/316731996_A_nation-wide_retrospective_epidemiological_study_of_gastroenteropancreatic_neuroendocrine_neoplasms_in_china
[7] Hu HK, Ke NW, Li A, et al. Clinical characteristics and prognostic factors of gastroenteropancreatic neuroendocrine tumors: a single center experience in China[J]. Hepatogastroenterology, 2015, 62 (137):178-183.
[8] Chan DT, Luk AO, So WY, et al. Natural history and outcome in Chinese patients with gastroenteropancreatic neuroendocrine tumours: a 17-year retrospective analysis[J]. BMC Endocr Disord, 2016, 16:12. DOI: 10.1186/s12902-016-0087-9
[9] Jiao X, Li Y, Wang H, et al. Clinicopathological features and survival analysis of gastroenteropancreatic neuroendocrine neoplasms: a retrospective study in a single center of China[J]. Chin J Cancer Res, 2015, 27(3):258-266.
[10] Guo LJ, Wang CH, Tang CW. Epidemiological features of gastroenteropancreatic neuroendocrine tumors in Chengdu city with a population of 14 million based on data from a single institution[J]. Asia Pac J Clin Oncol, 2016, 12(3):284-288. DOI: 10.1111/ajco.2016.12.issue-3
[11] Tang C, Gong L, Zou W, et al. Multivariate analysis of metastasisrelated risk factors for patients with gastroenteropancreatic neuroendocrine tumors based on clinicopathological and endoscopic features[J]. Oncol Rep, 2016, 36(6):3343-3352. DOI: 10.3892/or.2016.5170
[12] Zhang X, Ma L, Bao H, et al. Clinical, pathological and prognostic characteristics of gastroenteropancreatic neuroendocrine neoplasms in China: a retrospective study[J]. BMC Endocr Disord, 2014, 14:54. DOI: 10.1186/1472-6823-14-54
[13] Fang C, Wang W, Zhang Y, et al. Clinicopathologic characteristics and prognosis of gastroenteropancreatic neuroendocrine neoplasms: a multicenter study in South China[J]. Chin J Cancer, 2017, 36(1):51. DOI: 10.1186/s40880-017-0218-3
[14] Wang YH, Lin Y, Xue L, et al. Relationship between clinical characteristics and survival of gastroenteropancreatic neuroendocrine neoplasms: A single-institution analysis (1995-2012) in South China[J]. BMC Endocr Disord, 2012, 12:30. DOI: 10.1186/1472-6823-12-30
[15] Zhang M, Zhao P, Shi X, et al. Clinicopathological features and prognosis of gastroenteropancreatic neuroendocrine neoplasms in a Chinese population: a large, retrospective single-centre study[J]. BMC Endocr Disord, 2017, 17(1):39. DOI: 10.1186/s12902-017-0190-6
[16] Lombard-Bohas C, Mitry E, O'toole D, et al. Thirteen-month registration of patients with gastroenteropancreatic endocrine tumours in France[J]. Neuroendocrinology, 2009, 89(2):217-222. DOI: 10.1159/000151562
[17] Tsikitis VL, Wertheim BC, Guerrero MA. Trends of incidence and survival of gastrointestinal neuroendocrine tumors in the United States: a seer analysis[J]. J Cancer, 2012, 3:292-302. DOI: 10.7150/jca.4502
[18] Zeng YJ, Liu L, Wu H, et al. Clinicopathological features and prognosis of gastroenteropancreatic neuroendocrine tumors: analysis from a single-institution[J]. Asian Pac J Cancer Prev, 2013, 14(10):5775-5781. DOI: 10.7314/APJCP.2013.14.10.5775
[19] Garcia-Carbonero R, Capdevila J, Crespo-Herrero G, et al. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs): results from the National Cancer Registry of Spain (RGETNE)[J]. Ann Oncol, 2010, 21(9):1794-1803. DOI: 10.1093/annonc/mdq022
[20] Jin K, Luo G, Xu J, et al. Clinical outcomes and prognostic factors of resected pancreatic neuroendocrine neoplasms: A single-center experience in China[J]. Oncol Lett, 2017, 13(5):3163-3168. DOI: 10.3892/ol.2017.5834
[21] Boninsegna L, Panzuto F, Partelli S, et al. Malignant pancreatic neuroendocrine tumour: lymph node ratio and Ki67 are predictors of recurrence after curative resections[J]. Eur J Cancer, 2012, 48(11): 1608-1615. DOI: 10.1016/j.ejca.2011.10.030
[22] Panzuto F, Boninsegna L, Fazio N, et al. Metastatic and locally advanced pancreatic endocrine carcinomas: analysis of factors associated with disease progression[J]. J Clin Oncol, 2011, 29(17):2372-2377. DOI: 10.1200/JCO.2010.33.0688
[23] Khan MS, Luong TV, Watkins J, et al. A comparison of Ki-67 and mitotic count as prognostic markers for metastatic pancreatic and midgut neuroendocrine neoplasms[J]. Br J Cancer, 2013, 108(9):1838-1845. DOI: 10.1038/bjc.2013.156
[24] Rindi G, Falconi M, Klersy C, et al. TNM staging of neoplasms of the endocrine pancreas: results from a large international cohort study [J]. J Natl Cancer Inst, 2012, 104(10):764-777. DOI: 10.1093/jnci/djs208
[25] Scarpa A, Mantovani W, Capelli P, et al. Pancreatic endocrine tumors: improved TNM staging and histopathological grading permit a clinically efficient prognostic stratification of patients[J]. Mod Pathol, 2010, 23 (6):824-833. DOI: 10.1038/modpathol.2010.58
[26] Kim JY, Hong SM, Ro JY. Recent updates on grading and classification of neuroendocrine tumors[J]. Ann Diagn Pathol, 2017, 29:11-16. DOI: 10.1016/j.anndiagpath.2017.04.005
[27] Yadav R, Kakkar A, Sharma A, et al. Study of clinicopathological features, hormone immunoexpression, and loss of ATRX and DAXX expression in pancreatic neuroendocrine tumors[J]. Scand J Gastroenterol, 2016, 51(8):994-999. DOI: 10.3109/00365521.2016.1170195
[28] Ekeblad S, Skogseid B, Dunder K, et al. Prognostic factors and survival in 324 patients with pancreatic endocrine tumor treated at a single institution[J]. Clin Cancer Res, 2008, 14(23):7798-7803. DOI: 10.1158/1078-0432.CCR-08-0734
[29] Kim SJ, An S, Lee JH, et al. Loss of progesterone receptor expression Is an early tumorigenesis event associated with tumor progression and shorter survival in pancreatic neuroendocrine tumor patients[J]. J Pathol Transl Med, 2017, 51(4):388-395. DOI: 10.4132/jptm.2017.03.19
[30] Kourie HR, Ghorra C, Rassy M, et al. Digestive neuroendocrine tumor distribution and characteristics according to the 2010 WHO classification: a single institution experience in lebanon[J]. Asian Pac J Cancer Prev, 2016, 17(5): 2679-2681. https://www.researchgate.net/profile/Marc_Rassy/publication/303912213_Digestive_Neuroendocrine_Tumor_Distribution_and_Characteristics_According_to_the_2010_WHO_Classification_a_Single_Institution_Experience_in_Lebanon/links/575e69ab08aec91374af1093.pdf?origin=publication_detail
[31] Chagpar R, Chiang YJ, Xing Y, et al. Neuroendocrine tumors of the colon and rectum: prognostic relevance and comparative performance of current staging systems[J]. Ann Surg Oncol, 2013, 20(4): 1170-1178. DOI: 10.1245/s10434-012-2746-z
[32] Shafqat H, Ali S, Salhab M, et al. Survival of patients with neuroendocrine carcinoma of the colon and rectum: a population-based analysis[J]. Dis Colon Rectum, 2015, 58(3): 294-303. DOI: 10.1097/DCR.0000000000000298
[33] Kim BS, Park YS, Yook JH, et al. Differing clinical courses and prognoses in patients with gastric neuroendocrine tumors based on the 2010-WHO classification scheme[J]. Medicine (Baltimore), 2015, 94 (44): e1748. DOI: 10.1097/MD.0000000000001748
[34] Meeker A, Heaphy C. Gastroenteropancreatic endocrine tumors[J]. Mol Cell Endocrinol, 2014, 386(1-2): 101-120. DOI: 10.1016/j.mce.2013.07.015
[35] Kim JY, Brosnan-Cashman JA, An S, et al. Alternative lengthening of telomeres in primary pancreatic neuroendocrine tumors Is associated with aggressive clinical behavior and poor survival[J]. Clin Cancer Res, 2017, 23(6): 1598-1606. DOI: 10.1158/1078-0432.CCR-16-1147
[36] Yachida S, Vakiani E, White CM, et al. Small cell and large cell neuroendocrine carcinomas of the pancreas are genetically similar and distinct from well-differentiated pancreatic neuroendocrine tumors [J]. Am J Surg Pathol, 2012, 36(2): 173-184. DOI: 10.1097/PAS.0b013e3182417d36
[37] Rindi G, Kloppel G, Alhman H, et al. TNM staging of foregut (neuro) endocrine tumors: a consensus proposal including a grading system [J]. Virchows Arch, 2006, 449(4): 395-401. DOI: 10.1007/s00428-006-0250-1
[38] Luo G, Javed A, Strosberg JR, et al. Modified staging classification for pancreatic neuroendocrine tumors on the basis of the American joint committee on cancer and european neuroendocrine tumor society systems[J]. J Clin Oncol, 2017, 35(3):274-280. DOI: 10.1200/JCO.2016.67.8193



 下载:
下载: