Relationship between Helicobacter pylori infection and the expression of PRC2 and H3K27me3 in gastric cancer
-
摘要:目的 研究幽门螺杆菌(Helicobacter pylori,HP)感染对胃癌组织中多梳抑制复合物2(polycomb repressive complex 2,PRC2)和组蛋白H3K27me3表达的影响,探索HP感染在胃癌发生过程中的作用。方法 利用快速尿素酶检测、Giemsa染色和PCR方法检测复旦大学附属上海市第五人民医院2014年1月至2017年10月行胃癌手术的84例患者HP感染情况,应用免疫组织化学法检测胃癌和癌旁组织PRC2和H3K27me3蛋白的表达,分析两者表达与HP感染之间的相关性。结果 3种方法检测HP感染率分别为70.24%、61.90%和76.19%。PRC2家族成员果蝇zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)、SUZ12、EED和H3K27me3蛋白在胃癌组织中的阳性表达率分别为79.76%(67/84)、77.38%(65/84)、40.48%(34/84)和69.05%(58/84),均显著高于癌旁组织(22.62%、34.52%、8.33%和14.29%,P < 0.05)。临床资料分析表明,EZH2和H3K27me3蛋白在胃癌中的表达与淋巴结转移呈正相关。在HP阳性胃癌组织中,EZH2、SUZ12、EED和H3K27me3蛋白阳性表达率分别为89.06%(57/64)、84.38%(54/64)、46.88%(30/64)和82.81%(53/64),均显著高于HP阴性胃癌组织(50.00%、55.00%、20.00%和25.00%,P < 0.05)。结论 HP感染与胃癌组织中PRC2和H3K27me3蛋白表达上调相关。
-
关键词:
- 幽门螺杆菌 /
- 多梳抑制复合物2 /
- 果蝇zeste基因增强子同源物2 /
- H3K27me3 /
- 胃癌
Abstract:Objective To investigate the effects of Helicobacter pylori (HP) infection on polycomb repressive complex 2 (PRC2) and H3K27me3 expression and to explore the role of HP infection in the development of gastric cancer.Methods Fast urease tests, Giemsa staining, and polymerase chain reaction (PCR) assays were conducted to detect HP in specimens from 84 gastric cancer patients, who had received surgeries in the Fifth People's Hospital of Shanghai from January 2014 to October 2017. Immunohistochemistry staining was applied to examine PRC2 and H3K27me3 expression in gastric cancer tissues and para-tumor tissues. The relationship between HP infection and PRC2 and H3K27me3 expression was analyzed.Results The infection rates of HP were 70.24%, 61.90%, and 76.19% as detected by the three methods, respectively. The expression of enhancer of zeste homolog 2 (EZH2), suppressor of zeste 12 (SUZ12), embryonic ectoderm development (EED), and H3K27me3 protein were detected in 79.76% (67/84), 77.38% (65/84), 40.48% (34/84), and 69.05% (58/84) of gastric cancer tissues, respectively, all of which were significantly higher than those of para-tumor tissues (22.62%, 34.52%, 8.33%, and 14.29%, respectively; P < 0.05). The expression of EZH2 and H3K27me3 were positively correlated with lymph node metastasis, and the expression of these two proteins were also positively correlated. In gastric cancer tissues with HP infection, the expression of EZH2, SUZ12, EED, and H3K27me3 protein were detected at rates of 89.06% (57/64), 84.38% (54/64), 46.88% (30/64), and 82.81% (53/64), respectively, which were significantly higher than in gastric cancer tissues without HP infection (50.00%, 55.00%, 20.00%, and 25.00%, respectively; P < 0.05).Conclusions HP infection is associated with increased expression of PRC2 and H3K27me3 proteins in gastric cancer. -
胃癌是中国常见的恶性肿瘤之一,发病和死亡人数约占世界的50%[1],其发病机制复杂,涉及多基因和多因素的共同作用,其中幽门螺杆菌(Helicobacter pylori,HP)感染与胃癌发生存在密切的关系,但其作用机理目前尚不明确。多梳抑制复合物2(polycomb repressive complex 2,PRC2)是一组转录抑制因子,其核心成分果蝇zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)具有组蛋白甲基转移酶活性,通过对组蛋白H3进行甲基化修饰,从而导致肿瘤的发生发展。目前,有关HP感染是否影响表观调控因子PRC2的表达尚缺乏报道。本研究采用免疫组织化学法检测胃癌组织中PRC2家族蛋白和组蛋白H3K27me3的表达情况,分析HP感染与上述蛋白表达的相关性,探索HP感染在胃癌发生发展中的作用。
1. 材料与方法
1.1 材料
1.1.1 组织标本
选取复旦大学附属上海市第五人民医院2014年1月至2017年10月行胃癌手术的84例患者,其中男性55例,女性29例,平均年龄53岁。所有患者术前未经任何抗肿瘤治疗且术后均得到明确的病理诊断。本研究通过医院伦理委员会审查[批号:(2017)伦审(060备)],所有患者签署知情同意书。
1.1.2 主要试剂
HP快速尿素酶法检测试剂盒购于山东博迈达生物科技有限公司;DNA提取和PCR试剂盒购自天根生化科技公司;免疫组织化学试剂盒购自福州迈新公司;EZH2抗体购自美国Cell Signaling Technology公司,SUZ12、EED和H3K27me3抗体购自英国Abcam公司。
1.2 方法
1.2.1 标本采集
取手术切除的胃癌组织并在距癌灶5 cm处取癌旁组织。胃癌标本分成3份,1份经10%中性甲醛固定,常规石蜡包埋,制片,用于HP染色和免疫组织化学检测;1份用于快速尿素酶检测;1份置于-80℃冰箱保存用于PCR检测。
1.2.2 HP快速尿素酶检测
新鲜胃黏膜(1 mm3)取样后立即置于加有底物反应液的试管内,充分震荡,室温静置5 min,观察试管内液体颜色。如果呈黄色,为阴性;如果呈浅红色~玫瑰红色,为阳性。
1.2.3 HP染色
采用改良的Giemsa染色法检测HP。石蜡切片脱蜡至水,置于0.5%盐酸酒精中10 min,充分水洗后将切片置于Giemsa工作液中经微波炉加热2~4 min。然后用1%冰醋酸快速浸洗,水洗,脱水,透明,封片。
1.2.4 PCR检测
1)组织DNA提取:将冻存的胃组织剪碎、匀浆,加入20 μL蛋白酶K(20 mg/mL),55℃水浴1 h完全消化后按照试剂盒说明书操作,提取DNA进行纯度测定;2)引物设计:针对VacA基因设计引物如下:F':5-GGAGCCCCAGGAAACATTG-3',R:5'-CTGCTTG AATGCGCCAAAC-3'。引物由上海生工生物工程技术服务有限公司合成;3)PCR反应条件:反应总体积为50 μL,上、下游引物各2 μL,应用Touchdown PCR方法扩增基因,94℃预变性4 min,94℃变性0.5 min,自65℃~ 50℃每降3℃循环3次,最后1个温度循环15次,所有循环结束后,72℃延伸10 min。
1.2.5 免疫组织化学法检测
石蜡切片脱蜡至水,微波修复抗原10 min,PBS洗涤,3%过氧化氢孵育20 min。山羊血清37℃封闭30 min,洗涤,分别滴加兔抗人EZH2抗体(1:200)、SUZ12抗体(1:100)、EED抗体(1: 200)和鼠抗人H3K27me3抗体(1:100),4℃过夜。PBS洗涤后,分别滴加羊抗兔和兔抗鼠二抗工作液,温箱中孵育30 min。滴加辣根过氧化物酶标记链酶卵白素,孵育30 min,DAB显色,终止反应。结肠癌和乳腺癌组织(由上海健康医学院基础医学院病理教研室收集与提供)用作阳性对照,阴性对照用PBS替代一抗。
1.2.6 免疫组织化学结果判读
随机选取5个高倍镜视野(×400),计数肿瘤细胞总数和阳性细胞数,计算阳性细胞百分比,以≤25%为0分,26%~50%为1分,51%~75%为2分,>75%为3分;对染色强度进行计分,无显色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。将上述两项得分相加,≥3分定义为阳性, < 3分定义为阴性。所有切片均由两名病理医生独立阅片和判读。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。计数资料以百分率(%)表示,PRC2家族和H3K27me3蛋白的表达,以及与HP感染和临床病理资料之间的关系采用χ2检验。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 HP检测结果
84例胃癌患者,HP快速尿素酶检测法检出率为70.24%(59/84)。Giemsa染色显示胃黏膜细胞胞质呈粉红色,胞核呈蓝色或紫色,HP呈淡蓝色或蓝色,弯曲状或弧形(图 1A),HP检出率为61.90%(52/84)。电泳结果显示,VacA基因扩增电泳条带分子量为353 bp(图 1B),PCR检测阳性率为76.19%(64/84)。3种检测方法中任一结果为阳性者均判为阳性。
2.2 PRC2家族和H3K27me3蛋白在胃癌组织中的表达
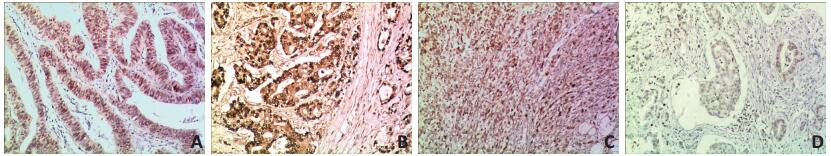
PRC2家族中3个成员EZH2、SUZ12和EED以及H3K27me3蛋白在胃癌组织中的表达均定位于细胞核,为棕黄色颗粒(图 2A~D)。EZH2、SUZ12、EED和H3K27me3蛋白在胃癌组织的阳性表达率分别为79.76%(67/84)、77.38%(65/84)、40.48%(34/84)和69.05%(58/84),均显著高于癌旁组织(22.60%、34.52%、8.33%和14.29%),差异具有统计学意义(P < 0.05,表 1)。
表 1 PRC2家族蛋白在胃癌组织及癌旁组织中的表达
2.3 EZH2和H3K27me3蛋白表达与胃癌临床病理特征的关系
本研究分析了EZH2和H3K27me3蛋白表达与胃癌临床病理指标的关系,发现EZH2和H3K27me3的表达与淋巴结转移相关,发生淋巴结转移的病例EZH2和H3K27me3蛋白表达均显著高于无淋巴结转移的病例(P < 0.05,表 2),与胃癌患者性别、年龄、肿瘤大小、浸润深度、Lauren分型、分化程度、TNM分期和生存时间均无显著相关性。
表 2 EZH2和H3H27me3蛋白表达与胃癌临床病理特征的关系
2.4 胃癌组织中PRC2和H3K27me3蛋白表达与HP感染的关系
在HP阳性胃癌组织中,EZH2、SUZ12、EED和H3K27me3蛋白的阳性表达率分别为89.06%(57/64)、84.38%(54/64)、46.88%(30/64)和82.81%(53/64),均显著高于HP阴性胃癌组织(50.00%、55.00%、20.00%和25.00%,P < 0.05)。差异具有统计学意义(P < 0.05,表 3)。
表 3 PRC2和H3K27me3蛋白在HP阳性及阴性胃癌组织中的表达
2.5 胃癌组织中EZH2与H3K27me3蛋白表达的关系
胃癌组织中,67例EZH2表达阳性的病例中H3K27me3蛋白阳性表达率为74.63%(50/67),17例EZH2表达阴性的病例中H3K27me3蛋白阳性表达率为47.06%(8/17),前者显著高于后者,差异具有统计学意义(P < 0.05),EZH2与H3K27me3蛋白的表达呈正相关(表 4)。
表 4 胃癌组织中EZH2和H3K27me3蛋白表达的关系
3. 讨论
近年来,中国胃癌的发病率不断升高,在胃癌高发地区,成人HP感染率超过56%[2]。HP致癌机制与尿素酶造成的胃黏膜屏障损伤、空泡细胞毒素(VacA)和细胞毒素相关蛋白(CagA)引起的基因突变和免疫反应有关。有研究发现,HP感染可显著提高水通道蛋白(Aquaporin 3)和缺氧诱导因子(hypoxia inducible factor 1α,HIF-1α)表达,使人胃癌细胞AGS和GES-1活性氧含量增加,加重胃黏膜上皮细胞损伤[3];还可以调节环氧化酶- 2(cyclooxygenase-2,COX-2)和15羟基前列腺素脱氢酶(15 hydroxy prostaglandin dehydrogenase,15PGDH)表达进而使前列腺素E2水平上升[4];此外,还可通过转录因子NF-κB上调miR-223-3p表达,进而抑制其下游靶基因ARID1A表达,促进胃癌细胞增殖和转移[5]。MABK通路中EGFR、RAF和MERK等分子在HP感染时表达上调,进而引发高胃泌素血症[6]。HP感染还可通过miR-181b激活IL-6/STAT3信号途径,进而抑制尾型同源盒转录因子(caudal type homeobox transcription factor 2,CDX2)表达和p53信号通路,导致胃癌预后不良[7]。目前,有关HP致癌机制的研究虽然取得了一定进展,但仍未完全阐述清楚,特别是HP感染是否影响表观调控因子的表达。本研究通过分析HP感染与胃癌组织PRC2家族蛋白和组蛋白H3K27me3表达的相关性,寻找其可能的致癌机制。
PRC2是一组转录抑制因子,核心成分EZH2基因位于7q35,其编码产物能对组蛋白进行甲基化修饰,维持下游靶基因沉默,从而诱导肿瘤的发生发展。多项研究表明,EZH2在恶性肿瘤中表达上调,并与肿瘤的侵袭和转移相关,是预后不良的指标[8-13]。本研究结果显示,EZH2蛋白在胃癌组织中的阳性表达率显著高于癌旁组织,且与淋巴转移相关,这与既往文献报道相一致[12-13]。Chen等[14]研究表明,EZH2在胃癌组织中高表达,且与肿瘤的大小、浸润深度、转移及临床分期有关,本研究发现上述因素与胃癌组织中EZH2的表达均无显著相关性。Mattioli等[15]研究发现,EZH2表达水平与肿瘤类型有关,在肠型胃癌中的表达明显高于弥漫型胃癌。本研究结果显示,EZH2的表达水平与胃癌Lauren分型无关。EZH2单独存在时不具有组蛋白甲基转移酶活性,需要在PRC2家族另外两个成员SUZ12和EED的共同参与下构成复合物,才能发挥酶活性。由此可见,SUZ12和EED对于维持复合物结构的稳定性和EZH2的酶活性是必需的[16-18]。有研究报道,SUZ12在结直肠癌、肝癌和乳腺癌中表达均上调[19-20]。本研究对SUZ12和EED蛋白的表达进行分析,结果表明胃癌组织中SUZ12和EED蛋白的表达率显著高于癌旁组织。
组蛋白是染色质的基本组成单位,尾部某些氨基酸残基发生修饰后可以改变染色质的结构,从而影响基因的表达。组蛋白H3的N末端赖氨酸残基K27(H3K27)是最常见的甲基化修饰位点,三甲基化修饰后的组蛋白H3K27me3能抑制下游靶基因的转录,从而调控基因的表达。有关H3K27me3蛋白在肿瘤中的表达水平和临床意义的报道不尽相同,在肝细胞癌和膀胱癌中表达上调且预后不良[21-22],而在乳腺癌、卵巢癌和胰腺癌中表达均下调,且与预后不良相关[23]。作为EZH2的甲基化修饰对象,本研究对H3K27me3蛋白的表达进行分析,结果显示该蛋白在胃癌组织中的表达显著高于癌旁组织,且与淋巴结转移相关。
本研究对胃癌组织中PRC2家族蛋白表达与HP感染的相关性进行分析,结果显示该家族蛋白在HP阳性胃癌组织中的表达显著高于HP阴性胃癌组织,提示HP感染不仅与PRC2家族核心成员EZH2表达上调呈正相关,还与该家族中另外两个成员SUZ12和EED表达上调也相关。进一步分析HP感染与胃癌组织中H3K27me3蛋白表达的关系发现,H3K27me3在HP阳性胃癌组织中的表达显著高于HP阴性胃癌组织,且与EZH2蛋白表达呈正相关,提示HP感染与H3k27me3蛋白的表达相关。
综上所述,HP感染与胃癌组织中PRC2和H3K27me3蛋白表达上调相关,这为阐述病原体对宿主转录调控的影响提供了新的证据,也为探索HP致癌机制提供了新思路。但HP是否直接影响胃癌细胞中PRC2的表达,尚需进一步研究证实。
-
表 1 PRC2家族蛋白在胃癌组织及癌旁组织中的表达

表 2 EZH2和H3H27me3蛋白表达与胃癌临床病理特征的关系

表 3 PRC2和H3K27me3蛋白在HP阳性及阴性胃癌组织中的表达

表 4 胃癌组织中EZH2和H3K27me3蛋白表达的关系

-
[1] 左婷婷, 郑荣寿, 曾红梅, 等.中国胃癌流行病学现状[J].中国肿瘤临床, 2017, 44(1):52-58. http://www.cjco.cn/CN/abstract/abstract13521.shtml [2] 张万岱, 胡伏莲, 萧树东, 等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗, 2010, 15(5):265-270. http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_xdxhjjrzl201005001 [3] Wen J, Wang Y, Gao C, et al. Helicobacter pylori infection promotes Aquaporin 3 expression via the ROS-HIF-1α-AQP3-ROS loop in stomach mucosa: a potential novel mechanism for cancer pathogenesis[J]. Oncogene, 2018. [Epub ahead of print].
[4] Zhao J, Wen S, Wang X, et al. Helicobacter pylori modulates cyclooxygenase-2 and 15-hydroxy prostaglandin dehydrogenase in gastric cancer[J]. Oncol Lett, 2017, 14(5):5519-5525. http://cn.bing.com/academic/profile?id=75e2c97c355b65f39a56df6c26827ed0&encoded=0&v=paper_preview&mkt=zh-cn
[5] Yang F, Xu Y, Liu C, et al. NF-κB/miR-223-3p/ARID1A axis is involved in Helicobacter pylori CagA- induced gastric carcinogenesis and progression[J]. Cell Death Dis, 2018, 9(1):12. DOI: 10.1038/s41419-017-0020-9
[6] Gunawardhana N, Jang S, Choi YH, et al. Helicobacter pylori-Induced HB-EGF upregulates gastrin expression via the EGF receptor, C-Raf, Mek1, and Erk2 in the MAPK pathway[J]. Front Cell Infect Microbiol, 2018, (7):541.
[7] Saito M, Okayama H, Saito K, et al. CDX2 is involved in microRNAassociated inflammatory carcinogenesis in gastric cancer[J]. Oncol Lett, 2017, 14(5):6184-6190. http://cn.bing.com/academic/profile?id=aed3241de0e7b62754f8174031bd587c&encoded=0&v=paper_preview&mkt=zh-cn
[8] Lee SR, Roh YG, Kim SK, et al. Activation of EZH2 and SUZ12 regulated by E2F1 predicts the disease progression and aggressive characteristics of bladder cancer[J]. Clin Cancer Res, 2015, 21(23):5391-5403. DOI: 10.1158/1078-0432.CCR-14-2680
[9] Geng J, Li X, Zhou Z, et al. EZH2 promotes tumor progression via regulating VEGF- A/AKT signaling in non- small cell lung cancer[J]. Cancer Lett, 2015, 359(2):275-287. DOI: 10.1016/j.canlet.2015.01.031
[10] Liu YL, Gao X, Jiang Y, et al. Expression and clinicopathological significance of EED, SUZ12 and EZH2 mRNA in colorectal cancer[J]. J Cancer Res Clin Res, 2015, 141(4):661-669. DOI: 10.1007/s00432-014-1854-5
[11] Wang Y, Chen Y, Geng H, et al. Overexpression of YB1 and EZH2 are associated with cancer metastasis and poor prognosis in renal cell carcinomas[J]. Tumour Biol, 2015, 36(9):7159-7166. DOI: 10.1007/s13277-015-3417-z
[12] Choi JH, Song YS, Yoon JS, et al. Enhancer of zeste homolog 2 expression is associated with tumor cell proliferation and metastasis in gastric cancer[J]. APMIS, 2010, 118(3):196-202. DOI: 10.1111/apm.2010.118.issue-3
[13] Mccabe MT, Brandes JC, Vellino PM, et al. Cancer DNA mehtylation: molecular mechanisms and clinical implications[J]. Clin Cancer Res, 2009, 15(12):3927-3937. DOI: 10.1158/1078-0432.CCR-08-2784
[14] Chen H, Gu X, Su H, et al. Polycomb protein Ezh2 regulates pancreatic beta-cell Ink4a /Arf expression and regeneration in diabetes mellitus [J]. Genes Dev, 2009, 23(8):975-985. DOI: 10.1101/gad.1742509
[15] Mattioli E, Vogiatzi P, Sun A, et al. Immunohistochemical analysis of pRb2/p130, VEGF, EZH2, p53, p16(INK4A), p27(KIP1), p21(WAF1), Ki- 67 expression patterns in gastric cancer[J]. J Cell Physiol, 2007, 210(1): 183-191. DOI: 10.1002/(ISSN)1097-4652
[16] Martín-Pérez D, Sánchez E, Maestre L, et aI. Deregulated expression of the polycomb-group protein SUZ12 target genes characterizes mantle cell lymphoma[J]. Am J Pathol, 2010, 177(2):930-942. DOI: 10.2353/ajpath.2010.090769
[17] Gui Y, Chen J, He Z, et al. SUZ12 depletion suppresses the proliferation of gastric cancer cells[J]. Cell Physiol Biochem, 2013, 31(6):778-784. DOI: 10.1159/000350095
[18] Cao Q, Wang X, Zhao M, et al. The central role of EED in the orchestration of polycomb group complex[J]. Nat Commun, 2014, (5):3127. http://adsabs.harvard.edu/abs/2014NatCo...5E3127C
[19] San K, Horita M, Ganapathy A, et al. Deregulated expression of microRNA-200b/c and SUZ12, a Polycomb repressive complex 2 subunit, in chemoresistant colorectal cancer cells[J]. Genes Cancer, 2017, 8(7- 8):673-681.
[20] KiHnizis A, Banley SM, Faham PJ, et al. Identification of the polycomb group pmtein SU(Z) 12 as a potential molecular target for human cancertherapy[J]. Mol cancer Ther, 2003, 2(1):113-121. http://citeseerx.ist.psu.edu/viewdoc/summary?doi=10.1.1.510.1437
[21] Hayashi A, Yamauchi N, Shibahara J, et al. Concurrent activation of acetylation and tri-methylation of H3K27 in a subset of hepatocellular carcinoma with aggressive behavior[J]. PLoS One, 2014, 10, 9(3): e91330. http://cn.bing.com/academic/profile?id=2eeac80752d905501d6a90b22c16dc76&encoded=0&v=paper_preview&mkt=zh-cn
[22] Ellinger J, Bachmann A, Göke F, et al. Alterations of global histone H3K9 and H3K27 methylation levels in bladder cancer[J]. Urol Int, 2014, 93 (1):113-118. DOI: 10.1159/000355467
[23] Wei Y, Xia W, Zhang Z, et al. Loss of trimethylation at lysine 27 of histone H3 is a predictor of poor outcome in breast, ovarian, and pancreatic cancers[J]. Mol Carcinog, 2008, 47(9):701-706. DOI: 10.1002/mc.v47:9
-
期刊类型引用(6)
1. 宫睿,刘暌,陈劲草,江普查. H3K27M及其甲基化在弥漫性脊髓胶质瘤中的表达及与预后的关系. 中国癌症防治杂志. 2022(02): 167-170 .  百度学术
百度学术
2. 刘芳,王丹,肖贵梅. 血清胃蛋白酶原-Ⅰ、胃蛋白酶原-Ⅱ、PG-Ⅰ/PG-Ⅱ联合幽门螺杆菌抗体鉴别诊断胃癌及癌前病变. 吉林医学. 2022(06): 1640-1642 .  百度学术
百度学术
3. 罗含欢,师杰,边巴扎西,杨旭,尼玛卓玛,王倩,李梅,王寒,廖瑞倩,次仁曲珍. 西藏地区藏族人群胃癌组织中H3K27me3表达水平及其临床意义. 协和医学杂志. 2022(06): 1088-1093 .  百度学术
百度学术
4. 狄潘潘,贾淑云,李帅,王志远,岳云月,王杰. 治疗上皮样肉瘤新药-EZH2抑制剂tazemetostat. 实用药物与临床. 2021(05): 471-476 .  百度学术
百度学术
5. 王学敬. 幽门螺杆菌感染与胃癌共刺激分子OX40和OX40L表达的相关性. 中国微生态学杂志. 2020(08): 915-919 .  百度学术
百度学术
6. 陈洋,王永,彭敏,郑培丽. Hp感染与胃癌中的SOX2、VEGF表达的相关性. 数理医药学杂志. 2019(06): 802-804 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: