-
-
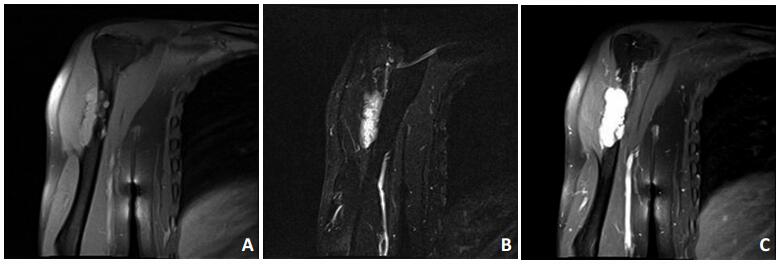
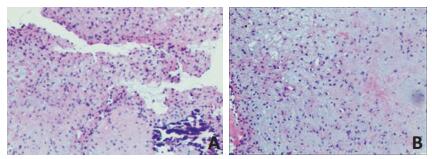
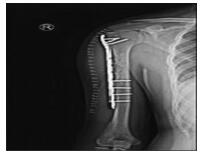
患者男性,36岁,右上臂疼痛6年余,加重2个月,于2018年3月5日就诊于深圳市第二人民医院。体格检查显示:右上臂无明显肿胀,未见明显畸形,局部皮肤完整,浅表静脉未见曲张,局部压痛及叩击痛(+),右肩及肘关节活动稍受限,右上肢感觉、末梢血运正常。CT显示:右肱骨中上段低密度影,局部骨皮质变薄,欠规整,累及范围约6.4 cm,周围软组织未见确切异常(图 1)。CT初步诊断:考虑纤维源性骨肿瘤。为进一步明确诊断收治入院。入院后行右上肢MRI显示:右侧肱骨中上段可见片状长T1长T2信号灶,直径约为6.9 cm×1.7 cm(图 2);增强扫描可见明显强化,上下缘亦见小血管强化,邻近肱骨骨质受压,不规整,周围软组织未见确切异常。于2018年3月20日行右肱骨近端穿刺活检术,病理显示:镜下组织由软骨、纤维及黏液基质构成,细胞丰富、胞质红染,核大小不等,核分裂像偶见,局灶伴钙化(图 3)。诊断为:软骨黏液样纤维瘤(chondromyxoid fibroma,CMF)。2018年4月8日于全麻下行右肱骨近端骨病变刮除术+植骨术+钢板内固定术。术中可见肿瘤位于骨膜下方,外生性生长,包绕肱骨干外侧1/3,表面附有软骨样组织,于右肱骨中上段外侧纵形开槽约为1 cm× 6 cm,于髓腔内彻底刮除病灶,将病灶内组织送病理检查,反复冲洗后予异体骨2包植入。因病变组织体积较大,考虑术后出现病理性骨折概率大,给予局部AO锁定钢板固定。术后复查X片见右肱骨内固定牢靠(图 4)。病理显示:镜下肿瘤由软骨、纤维及黏液基质构成,略呈分叶状结构,伴钙化,胞质红染,局部见多核巨细胞散在分布,并见成骨现象,细胞核稍大,核分裂像易见。诊断为CMF。
小结 CMF为一种罕见的良性骨肿瘤,在骨肿瘤中其发病率仅1%,其中约95%病例发生于长骨的干骺端[1]。本例较为罕见,其位于肱骨中上段,并且位于肱骨的皮质旁。皮质旁CMF在高发人群、发病部位及形态特点上与经典的CMF存在较大差异,不同于经典CMF高发于20~30岁年轻人群,皮质旁CMF的发病年龄范围较大。一项回顾性研究显示年龄为12~82岁,中位年龄40.2岁[2]。
皮质旁CMF罕见且特殊,影像学诊断较为困难,因其病变并非如经典的CMF位于髓内或干骺端,所以鉴别诊断也全然不同。本例诊断主要考虑与骨膜软骨肉瘤、骨膜外骨肉瘤、骨软骨瘤及动脉瘤样骨囊肿相鉴别。良性骨肿瘤中考虑骨软骨瘤、动脉瘤样骨囊肿,生长缓慢的恶性肿瘤也不可忽视,皮质旁CMF易与骨膜外骨肉瘤及骨膜软骨肉瘤相混淆。1)良性病变中骨软骨瘤通常不会破坏骨皮质与骨髓质的连续性,且是由软骨组织构成,故被排除诊断。2)动脉瘤样骨囊肿在核磁共振检测主要表现为典型的蜂窝状分叶结构,分叶为动脉瘤样骨囊肿,增强序列会出现渐进式的增强,因其内含血液,影像学可能观察到液-液平面,在显微镜下会发现含铁血黄素的存在[3]。3)骨膜外骨肉瘤起源于骨皮质表面,与CMF同样具有缓慢的生长速度,其在影像学上表现为广泛致密且存在钙化的分叶样肿瘤,大部分骨膜外骨肉瘤仅具有轻微的骨膜反应,故经常被误诊为良性肿瘤[4]。在显微镜下,骨膜外骨肉瘤主要表现为成熟的骨小梁混合成纤维细胞的纺锤形细胞基质。若考虑为骨膜软骨肉瘤,骨膜软骨肉瘤起源于骨膜表面,进展至后期时CT显示与皮质旁CMF相似,大多为一个巨大的软组织包块中包含多个不规则的斑块状钙化,所以骨膜软骨肉瘤的典型影像学表现为溶骨性破坏并且周边无明显的硬化带,但是MRI显示,骨膜软骨肉瘤在T1及T2序列中均表现为低信号,这一点与皮质旁CMF相反;在病理检查中,骨膜软骨肉瘤是由透明软骨小叶、黏液样基质和软骨细胞组成,具有不同程度的异形细胞,并且侵犯周围的软组织。病理确诊为CMF的金标准,皮质旁CMF同经典的CMF一致,均表现为软骨、黏液、纤维基质的混合,皮质旁CMF的生物学行为较好,对周围软组织无明显侵犯[5]。
CMF通常预后良好,约1%~2%病例最终转化为恶性。一项单中心22例CMF报道,CMF的复发率约为9.1%[6]。本例患者的病理结果提示核分裂像易见,随访3个月,X片暂未发现肿瘤复发的迹象,后续仍需继续随访。皮质旁CMF因其发病率较低,治疗上并无标准流程,常见的手术方法为单纯刮除、刮除术结合植骨术、刮除术结合骨水泥填塞术以及瘤段整块切除术,但国内外学者对CMF的治疗仍然存在争议[7]。病灶内刮除和骨水泥植入被认为是临床上较为有效的方法,这两种方法结合使用可以在保留肢体功能的同时具有较低的复发率。有研究指出,骨水泥不仅可以提供稳定,而且其硬化过程中的放热对于残留病灶具有破坏作用,也有部分学者认为其可以降低复发率[6]。本例患者,异体骨移植填补了骨缺损,而钢板内固定为患者的早期功能锻炼提供了有利条件。
-
[1] Berensteinweyel T, Lebel E, Katz D, et al. Chondromyxoid fibroma of the distal fibula treated by percutaneous radiofrequency ablation[J]. J Orthop Surg, 25(2):2309499017720830. doi:10.1177/23099017720 830.
[2] Baker AC, Rezeanu L, O'Laughlin S, et al. Juxtacortical chondromyxoid fibroma of bone: a unique variant: a case study of 20 patients [J]. Am J Surg Pathol, 2007, 31(11):1662. DOI: 10.1097/PAS.0b013e31806772ec
[3] Mahnken AH, Nolte-Ernsting CC, Wildberger JE, et al. Aneurysmal bone cyst: value of MR imaging and conventional radiography[J]. Eur Radiolo, 2003, 13(5):1118-1124. http://www.ncbi.nlm.nih.gov/pubmed/12695836
[4] Hang JF, Chen PC. Parosteal osteosarcoma[J]. Am Surg, 2014, 138(5): 694-699. http://d.old.wanfangdata.com.cn/Periodical/zgcthmrizz200805002
[5] Cleven AHG, Zwartkruis E, Hogendoorn PCW, et al. Periosteal chondrosarcoma: a histopathological and molecular analysis of a rare chondrosarcoma subtype[J]. Histopathology, 2015, 67(4):483-490. DOI: 10.1111/his.2015.67.issue-4
[6] Bhamra JS, Alkhateeb H, Dhinsa BS, et al. Chondromyxoid fibroma management: a single institution experience of 22 cases[J]. World J Surg Oncol, 2014, 12(1):1-6. DOI: 10.1186/1477-7819-12-1
[7] Jamshidi K, Mazhar F, Jafari D. Chondromyxoid fibroma of pelvis, surgical management of 8 cases[J]. Arc Iran Med, 2015, 18(6):367. http://labs.europepmc.org/abstract/MED/26058932;jsessionid=Wo58AnlMJEo2f7Emxysv.42
-
期刊类型引用(2)
1. 姚碧海,李成山,潘正故,韦艳梅,刘敏,罗继毅,唐东林,马凤艳. 原发性尿道黏液样纤维瘤1例报告. 现代泌尿外科杂志. 2022(05): 447-448 .  百度学术
百度学术
2. 陈明,王艳艳,蒋小莉,姜云惠. 肋骨肿块——请分析病变性质. 临床放射学杂志. 2020(10): 1898+2131-2132 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: