Clinicopathological characteristics and prognosis of patients with centrally located hepatocellular carcinoma in different risk levels
-
摘要:目的 本研究旨在阐明不同危险分级中央型肝细胞癌(centrally located hepatocellular carcinoma, cHCC)患者术后的预后相关危险因素。方法 回顾性分析2006年10月至2014年12月在天津医科大学肿瘤医院和中国医学科学院肿瘤医院接受肝中叶切除术的cHCC患者资料。根据无病生存期(disease-free survival, DFS)的长短分为高危(DFS≤1年)、中危(1<年DFS≤3年)和低危(DFS>3年)三个组。比较各组临床病理特征, 采用Log-rank及Cox法分别对影响患者生存预后的因素进行单因素和多因素分析评估。结果 本项研究共纳入173例患者, 其中高危组中位总生存期(overall survival, OS)为13.5个月, 中危组为24.0个月, 低危组为45.5个月。单因素分析结果显示:肝被膜受侵(P=0.022)、肿瘤毗邻大血管(< 1 cm)(P<0.001)、肿瘤直径>50 mm (P=0.012)、脉管瘤栓(P<0.001)、肿瘤侵袭性生长(P<0.001)和术前TACE (P=0.028)是影响术后复发的主要危险因素; 男性(P=0.013)、AFP>200 ng/mL (P=0.005)、肿瘤直径>50 mm (P=0.013)、肿瘤毗邻大血管(P<0.001)、高Edmondson-Steiner分化级别(P=0.003)、术前TACE (P=0.010)和肿瘤侵袭性生长(P=0.001)是影响术后OS的主要危险因素。Cox多因素分析显示, 肿瘤毗邻大血管和肿瘤侵袭性生长是复发和OS的独立危险因素。40.5%的高危组患者同时具有这两种危险因素, 中危组为13.4%, 低危组为3.1%(P=0.001)。将以上9个预后因素纳入Logistic回归分析, 建立一个预测术后患者是否属于高危组的预测模型,结果显示, 预测准确率随着危险因素的增加而逐渐升高, 当9个预后因素全部加入时, 预测百分比为82.1%。结论 高危组患者的预后相关危险因素明显多于中危组和低危组, 包含这些危险因素的Logistic预测模型可以提供相对准确的生存期及风险层级预测。针对属于高危组几率较高的cHCC患者, 术后推荐更加积极的随访复查与辅助治疗。Abstract:Objective To analyze clinical features and prognosis of hepatocellular carcinoma (cHCC) patients after liver resection, so as to clarify the prognostic risk factors.Methods We retrospectively reviewed the data of patients who underwent mesohepatectomy for cHCC at Tianjin Medical University Cancer Hospital and Chinese Academy of Medical Sciences Cancer Hospital between October 2006 and December 2014.The patients were assigned into three subgroups according to disease-free survival (DFS):high risk (DFS ≤1 year), middle risk (1 year < DFS ≤3 years), and low risk (DFS >3 years).Clinicopathological characteristics were compared and prognostic factors were evaluated using univariate and multivariate analyses.Results In total, 173 patients were reviewed.The median overall survival (OS) in the high-risk group was 13.5 months compared with 24.0 months in the middle-risk group and 45.5 months in the lowrisk group.Univariate analysis showed that liver capsule invasion (P=0.022), tumors adjacent to major vascular vessels (< 1 cm)(P < 0.01), HCC size >50 mm (P=0.012), presence of microvascular invasion (P < 0.001), tumor invasive growth (P < 0.001), and preoperative transarterial chemoembolization (TACE; P=0.028) were significant risk factors for recurrence.The main risk factors for OS were male gender (P=0.013), alpha-fetoprotein >200 ng/mL (P=0.005), tumor size >50 mm (P=0.013), adjacent to major vascular vessels (P < 0.001), high Edmondson-Steiner differentiation grade (P=0.003), preoperative TACE (P=0.010), and tumor invasive growth (P=0.001).Cox multivariate analysis demonstrated that tumors adjacent (< 1 cm) to major vascular trunks and tumor invasive growth were independent prognostic factors for both DFS and OS.In total, 40.5% patients in the high-risk group had both risk factors; this percentage was 13.4% in the middle-risk group and 3.1% in the low-risk group (P=0.001).A prognostic model including the above 9 factors were created based on Logistic regression to predict the percentage of patients belonging to the high-risk group.The Results showed that the prediction accuracy continued to increase with the number of more factors added.When all the 9 factors were included, the predictive percentage was 82.1%.Conclusions :cHCC patients in the high-risk group had more risk factors than those in the middle-and low-risk groups.A prognostic model containing these factors may provide accurate prediction of survival or risk stratification, and cHCC patients with these risk factors should be candidates for aggressive following-up and adjuvant therapy.
-
在全球, 肝细胞癌(hepatocellular carcinoma, HCC)的发病率位居恶性肿瘤的第6位, 死亡率居第3位。大部分(85%) HCC患者来自发展中国家, 尤其在乙型肝炎病毒感染流行的地区如东南亚和撒哈拉以南非洲发病率最高[1-2]。近十年来, 由于早期诊断能力的提高、治疗手段的进步和术后管理的加强, HCC患者的预后有了较大改善[3-7]。
中央型肝细胞癌(centrally located hepatocellular carcinoma, cHCC)是指位于肝脏Couinaud分段的Ⅳa、Ⅳb、Ⅴ和Ⅷ段的HCC。传统上扩大左半肝切除术或扩大右半肝切除术通常被推荐用于治疗这种类型的肝癌。由于大部分cHCC毗邻肝门, 或距主要血管结构(下腔静脉、门静脉一, 二级分支、肝静脉的三条主干)小于1 cm, 因此术中大出血和术后肝功能衰竭的风险显著增加, 往往伴随较高的并发症率和死亡率[8-9]。1972年, 肝中叶切除术首次被报道用于胆囊癌的根治切除, 后期逐渐用于cHCC的手术治疗[10]。由于其切除的正常肝组织较传统扩大半肝切除术显著减少, 可最大限度的保证肝脏功能, 多项临床研究证明其是治疗安全有效方法的cHCC[11-13]。然而, 这种手术操作由于其复杂性和较高的技术要求而没有被普遍推广。
自2006年, 本中心利用术中选择性血管阻断技术对复杂cHCC的外科切除进行了探索, 与常规的扩大左右半肝切除术相比, 术后短期结果良好。大中心临床研究[14-18]也表明, 肝中叶切除术可以达到与传统的半肝切除术类似的无病生存期(disease-free survival, DFS)和总生存期(overall survival, OS)。目前为止, 尚缺乏关于cHCC预后相关危险因素的研究, 也缺乏对肝中叶切除术后随访复查的建议。本研究拟通过单中心数据, 回顾性分析影响cHCC复发及长期生存的危险因素, 并探讨不同危险分级的患者预后因素的差异, 进而建立危险程度预测模型, 指导术后辅助治疗。
1. 材料与方法
1.1 材料
1.1.1 研究对象
本研究回顾性选取2006年10月至2014年12月, 天津医科大学肿瘤医院和中国医学科学院肿瘤医院收治的327例确诊为中央型肝细胞癌并接受肝中叶切除术的患者。三名外科医生对临床病理资料进行回顾性分析, 减少误差及避免选择偏倚。本文将研究对象分为高危组(DFS≤1年)、中危组(1<年DFS≤3年)和低危组(DFS>3年)。纳入标准: 1)影像学和病理学证实没有门静脉或肝静脉等大血管侵犯的单个肿瘤; 2)肝中叶切除术后肝静脉左、右主干及门静脉二级主干保存完好, 具有足够的剩余肝组织代偿肝功能; 3)病理切缘阴性(R0切除); 4)巴塞罗那肝癌分期系统(BCLC)评定为A期; 5) ChildPugh肝功能评估为A级。排除标准: 1)既往其它肿瘤史; 2)肝外或肝内转移、卫星结节、多中心生长和其它同时发生的恶性肿瘤; 3)姑息性切除伴肿瘤残留; 4)术后由于麻醉或心血管疾病引起较重并发症; 5)术后1个月内死亡; 6)年龄>80岁或<18岁。术前经肝动脉化疗栓塞(TACE)治疗的患者, 如在手术前4周完成治疗, 则亦符合纳入条件。R0切除定义为显微镜下肿瘤细胞距最近切缘的最短距离>1 mm。327例患者中, 符合以上标准共筛选出238例, 其中46例失访, 19例患者复发及生存资料不详细, 最终共纳入173名患者。本研究由两院伦理委员会批准, 并按照《赫尔辛基宣言》(1975年, 1983年修订)所规定的原则进行。数据库管理符合我国现行相关隐私权立法。
1.1.2 临床病理资料收集
收集三组患者的一般信息和临床病理资料。临床资料包括性别、年龄、是否酗酒、血清甲胎蛋白(AFP)水平、术前肝功能相关检查如丙氨酸氨基转移酶(ALT)、γ-谷氨酰转肽酶(GGT)、总胆红素(TBIL)、血清白蛋白(ALB)、肝炎病史及术前是否规律抗病毒治疗等。病理资料包括肿瘤大小、肿瘤部位、肿瘤是否毗邻大血管、肝被膜是否受侵犯、Edmondson-Steiner分级[19]、脉管瘤栓、肝纤维化评分、病理切缘、肿瘤内是否有间隔形成和肿瘤生长方式等。肿瘤大小基于肿瘤标本在肉眼病理下所测量得到的最大直径。病理切缘的宽度被定义为从肿瘤边缘到切除线的最小距离。应用Ishak纤维化评分系统(0~6级)评估肝脏纤维化程度[20]。根据Edmondson-Steiner分级系统将肿瘤分化程度分为高、中、低和未分化四级(G1~G4)。同一肿瘤内部如发现不同的肿瘤分级, 则仅记录其占比较多的主要分级。肿瘤毗邻大血管定义为肿瘤边缘距离下腔静脉、Glission蒂一、二级分支或肝静脉左、中、右主干血管壁的距离<1 cm。脉管瘤栓被定义为存在漂浮在微小血管腔隙中的癌细胞簇, 这种微小血管腔隙被内皮细胞所包裹[21]。肿瘤生长导致的瘤体与大血管外壁粘连而非血管壁直接被肿瘤细胞所浸润不被归类为大血管受侵。肿瘤生长方式在本研究中分为侵袭性生长和非侵袭性生长[22-25]。侵袭性生长定义为肿瘤边缘不规则或肿瘤外周假包膜不完整。非侵袭性生长定义为肿瘤边缘锐利或具有完整的假包膜包裹。两位病理医师对所有纳入患者的病理资料进行回顾和验证, 结果不一致的情况下, 需与另一位病理医师协商并达成共识。
1.1.3 手术资料
所有适合肝中叶切除术的病例均经多学科治疗团队审议并通过。手术切口采用常规肋缘下切口, 经腹腔探查排除腹膜播散转移后, 解剖镰状韧带、冠状韧带和三角韧带, 充分游离肝脏。采用血管阻断技术在肝门部分别解剖门静脉和肝动脉左、右支, 并用血管阻断带环绕。结扎肝尾状叶静脉, 将门腔静脉间隙从下至上分离。左、中、右肝静脉的主干用Simpson钳分离并夹持, 此方法只有必要时才对三条主要肝静脉进行阻塞。术中超声检查用于准确确定病变的位置及其与血管系统的关系。在一些肿瘤位置深在的患者中, 本研究应用术前三维重建技术(Yorktal, Shenzhen, China)进一步明确肿瘤与周围血管的毗邻关系。术中使用超声吸引刀(Cavitron Ultrasonic Surgical Aspirator, Söring, Germany)进行肝组织精确解剖分离, 并间断阻断同侧肝动脉及门静脉分支血流25min, 然后恢复5 min。血管切割闭合器(EndoGIA, Covidien, USA)亦被用于肝静脉或Glisson蒂的夹闭离断。肿瘤切除之后的创面使用电灼、4-0 prolene线(Ethicon, Johnson & Johnson, USA)缝合和凝血剂(TISSEEL, Baxter, USA)止血处理。术后第1、3、7天检测血清ALT、GGT、TBIL和ALB的水平。所有手术操作均为规范化操作, 以保证手术质量及安全性。
1.2 方法
1.2.1 术后随访
患者在术后两年内每隔3个月进行随访, 此后每隔4至6个月由同一外科团队在门诊采用标准监测方案进行随访。随访期间定期进行AFP水平、肝功能、腹部超声和胸部X光检查。当超声检查怀疑有HCC复发, 或血清甲胎蛋白(AFP)水平异常升高时, 进行对比增强磁共振成像进一步明确。超声引导下穿刺活检和经股动脉肝动脉血管造影也用于复发肿瘤确诊。PET-CT和骨扫描必要时被用来监测是否有肝外转移。所有患者均随访至死亡或截点日期。DFS是指从肝切除术后直到肿瘤复发, 患者死亡或末次随访的时间。OS是指从肝切除术后直到死亡或截点日期。本研究的末次随访日期(截点日期)为2017年9月31日。173例患者的中位随访时间为61.3 (3.9~81.4)个月。
1.2.2 复发肝癌的治疗
根据日本肝癌研究会的标准来确定是否属于肝内转移或多中心复发。治疗决策基于复发模式和肝储备功能的不同而异。局限于残留肝脏的复发肿瘤通过TACE、再次手术切除或经皮射频消融(RFA)进行治疗。RFA对于治疗3 cm以下的肿瘤被认为与手术相比具有同样的治疗效果, 但TACE被认为是姑息性治疗。RFA和TACE每4周重复一次, 连续4个疗程。肿瘤侵犯门静脉或下腔静脉主干的患者被推荐行辅助放疗。分子靶向药物如索拉菲尼亦被用于伴有肝内肝外多发转移的患者。姑息性放疗用于骨转移的患者, 以缓解疼痛。在本研究中, 对肝功能储备良好(Child-Pugh A级或B级)和行为状态良好(ECOG评分0分或1分)的复发患者一般进行积极治疗, 而Child-Pugh C级患者仅进行支持治疗。
1.3 统计学分析
使用SPSS 19.0软件进行统计学分析。连续变量使用中位数±四分位间距或平均数±标准偏差表示。计数资料的比较采用χ2检验或Fisher检验。生存分析采用Kaplan-Meier法, 单因素生存曲线统计比较采用Log-rank检验, 多因素预后分析采用Cox比例风险回归模型。同时建立多个Logistic回归模型, 评估患者是否属于高危组, 并使用ROC曲线计算模型预测准确度。DeLong法用来检测不同预测模型之间预测百分比的差异是否具有显著性。以P<0.05为差异具有统计学意义。
2. 结果
2.1 临床病理特征
173例患者平均年龄53岁(26~79岁), 包括男性153例(88.4%), 女性20例(11.6%), 其中高危组74例, 中危组67例, 低危组32例。三组病例在流行病学资料如年龄、性别、抽烟、酗酒及术前实验室检查等方面均无显著性差异(表 1)。病理特征如肝被膜受侵、Edmondson-Steiner分级、纤维化评分、病理切缘、炎性细胞浸润、肿瘤内间隔形成、肝细胞钙化、肝细胞水样变性等亦无显著性差异。在高危组中, 接受术前TACE治疗的患者为19例(25.6%), 显著多于中危组的4例(5.9%)和低危组的0例(0)。此外, 高危组患者中肿瘤邻近下腔静脉(<1 cm)的几率也显著高于其它两组(21.6%, 11.9%, 3.1%, P=0.023)。高危组患者肿瘤平均直径为(48.2±28.2)mm, 与中危组及低危组比较无显著性差异[(45.2±17.0) mm和(50.5± 22.7)mm, P=0.957]。术后并发症发生率在高危组为17.5%(n=13), 中危组为14.9%(n=10), 低危组为15.6% (n=5), 三组比较亦无显著性差异(P=0.909)。
表 1 三组患者临床病理特征 n
2.2 复发与长期生存
截止末次随访日期, 173例患者1、3、5年无病生存率分别为69.1%、46.4%和32.8%。其中, 51例复发后行TACE治疗, 11例再次行手术治疗, 27例接受RFA治疗, 33例仅行姑息性放疗。有42例患者接受了两种或两种以上的治疗方法。各组中位DFS分别为:高危组8 (2~12)个月、中危组20 (13~36)个月和低危组43.5(37~75)个月(P<0.01)。高危组患者肝内多结节复发(n=19)和门静脉瘤栓(n=8)的发生率显著高于其它两组(27, 12, 3, P=0.003)。
三组患者中, 共计41例(23.6%)死于肿瘤进展, 19例死于肝功能恶化, 11例死于心脏并发症, 另有7例死于脑卒中。173例患者1、3、5年总生存率分别为93.5%、71.8%和48.6%。高危组1、3、5年OS率分别为83.9%、21.3%和0, 显著低于中、低危组(96.2%、88.1%、24.5%和100.0%、93.8%、86.5%; Log-rank test, P<0.01)。低危组中大部分(75.0%)患者生存时间超过40个月, 中位OS(45.5个月)明显长于高、中危组(13.5个月, 24.0个月, P<0.01)。
2.3 DFS和OS的预后因素
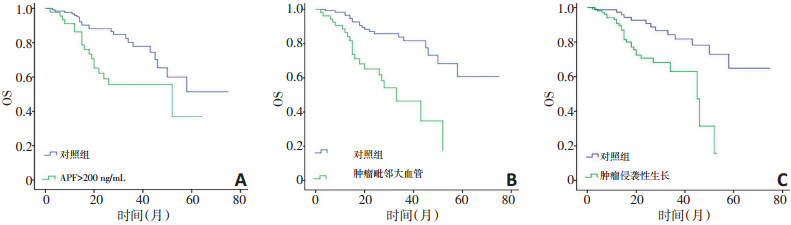
表 2总结了根治性切除术后DFS和OS的单因素和多因素分析结果。单因素分析发现, 肝被膜受侵(P= 0.022)、肿瘤毗邻大血管(<1 cm)(P<0.001)、肿瘤直径>50 mm (P=0.012)、脉管瘤栓(P<0.001)、肿瘤侵袭性生长(P<0.001)和术前TACE (P=0.028)是影响术后复发的主要危险因素; 虽然AFP≤200 ng/mL组DFS率(3年为49.5%)好于AFP>200 ng/mL组(3年为36.4%), 但无显著性差异(P=0.053)。男性(P=0.013)、AFP>200 ng/mL (P=0.005)、肿瘤直径>50 mm (P=0.013)、肿瘤毗邻大血管(P<0.001)、高Edmondson-Steiner分化级别(P=0.003)、术前TACE (P=0.010)和肿瘤侵袭性生长(P=0.001)是影响术后OS的主要危险因素。
表 2 三组患者DFS和OS的单因素及多因素分析
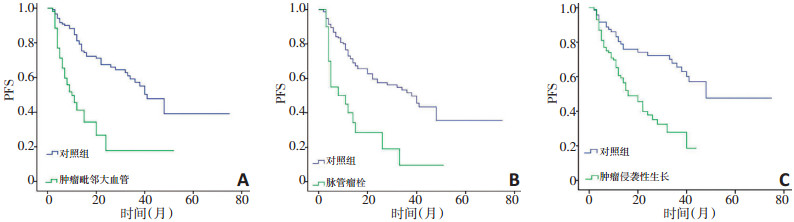
将以上单因素分析结果纳入Cox多因素比例风险回归分析后发现, 肿瘤毗邻大血管(HR=2.737, 95%CI: 1.718~4.359; P<0.001), 脉管瘤栓(HR=2.773, 95%CI: 1.586~4.849; P<0.001)和肿瘤侵袭性生长(HR=2.213, 95%CI: 1.325~3.697; P=0.002)是复发的独立危险因素(图 1)。对于总生存, AFP>200 ng/mL (HR=1.933, 95% CI: 1.030~3.627; P=0.040), 肿瘤毗邻大血管(HR=2.902, 95%CI: 1.508~5.586; P=0.001)和肿瘤侵袭性生长(HR= 2.268, 95%CI: 1.095~4.698; P=0.028)为其独立危险因素(图 2)。其中, 肿瘤毗邻大血管和肿瘤侵袭性生长均为DFS和OS的独立危险因素。
2.4 预后模型建立
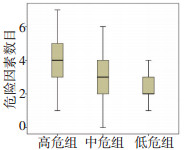
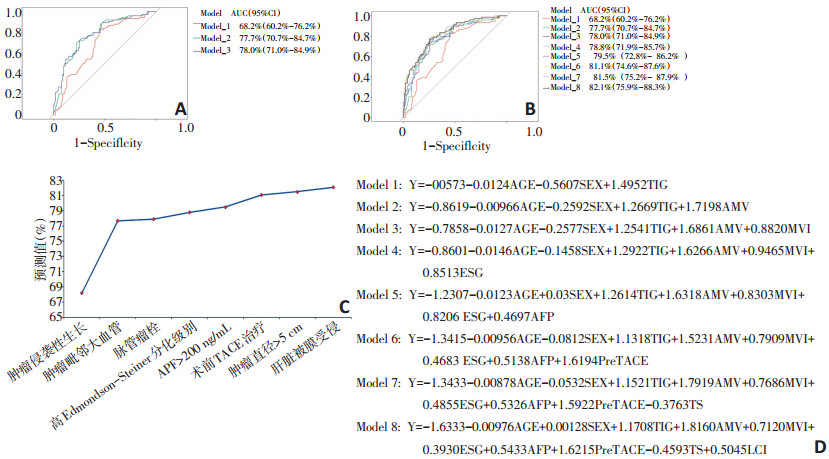
分析以上与DFS和OS相关的9个危险因素在三组患者中的特点, 不考虑它们各自的预后价值。在高危组中, 每个患者平均有(4.29±1.52)个危险因素, 在中危组和低危组, 则分别为(2.85±1.36)和(2.50± 1.21)个危险因素(P<0.01)。68%的高危组患者含有4个及以上危险因素, 73.1%的中危组患者危险因素数目2~4个, 同时, 78.1%的低危组患者危险因素数目小于3个(图 3)。为了探讨Cox多因素分析所得出的独立危险因素在三组中的预测价值, 计算DFS和OS所共同的两个危险因素(肿瘤毗邻大血管和肿瘤侵袭性生长)在患者中的比例。结果发现, 40.5%的高危组患者(n=30)同时存在这两种危险因素, 中危组为13.4%(n=9), 低危组为3.1%(n=1), 三组比较具有显著性差异(P=0.001)。最后, 用Logistic回归分析建立一个以性别和年龄为基础的模型, 通过向基础模型逐个增加危险因素来评估属于高危组的百分比(图 4A)。当把肿瘤侵袭性生长增加进基础模型后, 生成的新模型使用ROC曲线所计算得出患者属于高危组的百分比为68.2%(图 4B)。当肿瘤毗邻大血管被加入模型时, 其预测百分比增加到77.7%。通过DeLong法计算发现, 当危险因素肿瘤毗邻大血管增加入之后, 新模型预测百分比的增加在统计学上具有显著性差异(68.2% vs.77.7%, P=0.002)。然后将剩下的危险因素逐一增加入原模型中, 随着新的危险因素加入, 新模型计算出属于高危组的百分比持续升高, 而无论单个危险因素的预测价值大小(图 4C, 4D)。当9个危险因素全加入模型之后, 模型最终预测值为82.1%, 显著高于以性别和年龄为基础的原始模型(P<0.001)。
![]() 图 4 预后模型▶A:Logistic回归模型计算属于高危组百分比的公式:每增加一个危险因素则产生一个新模型(TIG:肿瘤侵袭性生长;AMV:肿瘤毗邻大血管;MVI:脉管瘤栓;ESG:Edmondson-Steiner低分化;AFP:甲胎蛋白;PreTACE:术前介入治疗;TS:肿瘤直径>50 mm;LCI:肝被膜受侵);B:当肿瘤侵袭性生长加入预测模型后(Model1),其预测值为68.2%;当肿瘤毗邻大血管加入预测模型后(Model2),其预测值为77.7%(P=0.002);当脉管瘤栓加入预测模型后(Model3),其预测值为78.0%;C:当8个预后危险因素(除影响因素男性外)依次纳入模型后,预测值为82.1%,显著高于初始模型(82.1% vs. 68.2%,P<0.001);D:模型预测值随着危险因素的增加而升高,各个模型预测值分别为68.2%,77.7%,78.0%,78.8%,79.5%,81.1%,81.5%和82.1%
图 4 预后模型▶A:Logistic回归模型计算属于高危组百分比的公式:每增加一个危险因素则产生一个新模型(TIG:肿瘤侵袭性生长;AMV:肿瘤毗邻大血管;MVI:脉管瘤栓;ESG:Edmondson-Steiner低分化;AFP:甲胎蛋白;PreTACE:术前介入治疗;TS:肿瘤直径>50 mm;LCI:肝被膜受侵);B:当肿瘤侵袭性生长加入预测模型后(Model1),其预测值为68.2%;当肿瘤毗邻大血管加入预测模型后(Model2),其预测值为77.7%(P=0.002);当脉管瘤栓加入预测模型后(Model3),其预测值为78.0%;C:当8个预后危险因素(除影响因素男性外)依次纳入模型后,预测值为82.1%,显著高于初始模型(82.1% vs. 68.2%,P<0.001);D:模型预测值随着危险因素的增加而升高,各个模型预测值分别为68.2%,77.7%,78.0%,78.8%,79.5%,81.1%,81.5%和82.1%3. 讨论
肝中叶切除术既可以最大限度地保留正常的肝组织, 又可以实现与大血管关系密切肿瘤的R0切除, 目前逐渐成为cHCC的标准术式[8-9, 15-16]。在Mehrabi等[26]研究中, 这种肝段切除术与非解剖性肝切除或扩大半肝切除术相比具有更好的短期疗效。同时, 此种术式也可以缩短住院时间, 降低并发症发生率和死亡率。虽然大多数相关研究[11-12, 16-18]都报道了与扩大半肝切除术相比, 肝中叶切除术在短期手术效果方面的优势, 但很少有研究关注cHCC经肝中叶切除后的预后相关危险因素。
一些研究[27-30]曾报告了肝中叶切除术后1年的OS率大约为67%~94%, 3年和5年OS率分别为44%~ 66.8%和31.7%~53.1%。1、3和5年DFS率则分别为50%~75%、28.8%~46.2%和15%~31.8%。Hu等[27]对52例经过肝中叶切除的cHCC患者和63例经扩大半肝切除的cHCC患者进行随访后发现, 中位DFS分别为23个月和25个月。Wu等[29]回顾分析了15例肝中叶切除术后的患者, 发现1、3、6年DFS率分别为53%、31%和21%。本组病例1、3、5年DFS率分别为69.1%、46.4%和32.8%, 略好于上述报道。一些cHCC肿瘤直径较大, 且与邻近大血管密切粘连, 术中为保留血管表面的完整性无法保证有效的手术切缘(>5 mm), 其是否会影响患者的长期生存目前尚无共识。Jeng等[30]报道了肝中叶切除术后窄切缘(<5 mm)患者与传统扩大半肝切除术后正常切缘患者的复发率和总生存率无显著性差异。前期研究中[25]回顾性分析了118例沿肿瘤表面进行手术切除的cHCC患者, 其1、3、5年DFS率分别为74.4%、45.6%和30.1%, 与文献报道基本一致。由此推断, 更好地了解肝脏内部解剖结构, 术中保留更多的非肿瘤肝组织, 以及外科技术的进步, 有助于得出良好的长期结果。
许多临床研究报道了在普通肝癌切除术后DFS和OS预后相关危险因素方面的结果。其中, 年龄、性别、肿瘤的术前治疗、肝脏功能和肿瘤相关病理参数是最常考虑的因素[31-35]。然而, cHCC患者肝中叶切除术后预后相关的参数仍然缺乏, cHCC和普通肝癌的预后特征是否存在差异也未知。本研究共纳入173例行根治性切除的cHCC患者的临床病理资料, 并依据患者DFS的不同并将其分为三组。根据文献报道[14, 17, 26-29, 33]Kaplan-Meier生存曲线中cHCC患者的分布规律并结合临床经验, 分别选择1年和3年作为分割点。其中, 以1年作为高危组与中危组的分界点, 以3年作为中危组与低危组的分界点。本组173例患者中, 81.5%(n=141)的患者在初次根治性切除后3年内复发, 之后复发风险显著降低, 并在随后的几年内持续保持低复发风险。
脉管瘤栓被广泛认为是与肝癌患者DFS和OS密切相关的危险因素。Li等[21]回顾性分析260例无大血管侵犯的肝癌患者, 其中52例病理检查提示脉管瘤栓。经过60.9个月的随访, 有和无脉管瘤栓的患者1、3、5年OS率分别为88.46、71.15、63.30%和98.56、86.54、76.70% (P=0.015)。进一步纳入包含14个临床病理因素的Cox多变量分析, 结果表明, 脉管瘤栓是影响OS的独立危险因素。在本研究中, 脉管瘤栓也是DFS的独立危险因素, 而且相比其它两个独立因素(肿瘤毗邻大血管和肿瘤侵袭性生长), 其HR值更高。因此, 脉管瘤栓可能是导致术后早期复发和低治愈率的主要原因之一(5年DFS<40%)。在173例患者中, 同时具有三个独立危险因素的患者, 87.2%属于高危组, 这对术后评估此类患者的DFS具有积极意义。同时, 高危组中肿瘤毗邻下腔静脉(<1 cm)的发生率也显著高于其它两组(21.6% vs. 11.9% vs. 3.1%, P=0.023)。在此类手术中, 需要从下腔静脉裸露的血管壁表面仔细剥离肿瘤, 结扎肝尾状叶静脉, 并兼顾术中出血和热缺血反应, 另外, 下腔静脉钳行间歇性夹持也会损害肝功能并可能影响远期预后。在本文单因素分析中, 术前TACE既是影响cHCC术后复发的主要危险因素, 也是影响术后生存的主要危险因素。造成这种结果的原因可能源于术前行TACE治疗的患者往往肿瘤直径比较大, 且大多靠近大血管, 呈现侵袭性生长, 手术完整切除难度大, 术后易于早期复发。这些患者本身就属于易复发的高危患者, 因此造成本研究在单因素分析中得出术前TACE为危险因素的结论。但经过Cox多因素比例风险回归分析的矫正后, 术前TACE并不属于独立危险因素。因此, 造成这种结果的原因可能并非TACE本身所致。
目前有较多关于肝癌长期预后的单因素、多因素研究[33-35], 但关于cHCC预后因素的全面性大中心研究较少。本研究强调了危险因素数量与cHCC的预后呈渐进性负相关, 随着危险因素数目的增加, 患者的长期预后越差, 证实危险因素的积累效应比单个因素的预后价值更加重要。具有4个以上危险因素的患者远期预后较差, 对这些患者需要给予更积极的随访及治疗。本文研究也有一定程度的局限性。首先, 本研究为回顾性, 样本量较少, 选择偏倚不可避免。其次, 本研究中肿瘤毗邻大血管和肿瘤侵袭性生长皆为DFS和OS的独立危险因素, 需要更多前瞻性随机队列研究来验证。
综上所述, 本研究的独特之处在于通过将173例cHCC患者分成三组, 分析影响其长期生存的危险因素, 并建立预后评估模型。Logistic回归分析所建立的9个因子ROC曲线模型, 可与常规临床病理参数结合, 成为有效的预后评估工具, 用以识别出更多的高危患者。这些患者需要更加密切的随访和积极的多学科治疗, 以提高远期生存率。
-
图 4 预后模型
▶A:Logistic回归模型计算属于高危组百分比的公式:每增加一个危险因素则产生一个新模型(TIG:肿瘤侵袭性生长;AMV:肿瘤毗邻大血管;MVI:脉管瘤栓;ESG:Edmondson-Steiner低分化;AFP:甲胎蛋白;PreTACE:术前介入治疗;TS:肿瘤直径>50 mm;LCI:肝被膜受侵);B:当肿瘤侵袭性生长加入预测模型后(Model1),其预测值为68.2%;当肿瘤毗邻大血管加入预测模型后(Model2),其预测值为77.7%(P=0.002);当脉管瘤栓加入预测模型后(Model3),其预测值为78.0%;C:当8个预后危险因素(除影响因素男性外)依次纳入模型后,预测值为82.1%,显著高于初始模型(82.1% vs. 68.2%,P<0.001);D:模型预测值随着危险因素的增加而升高,各个模型预测值分别为68.2%,77.7%,78.0%,78.8%,79.5%,81.1%,81.5%和82.1%
表 1 三组患者临床病理特征 n

表 2 三组患者DFS和OS的单因素及多因素分析

-
[1] Hashem B.Hepatocellular carcinoma[J].N Engl J Med, 2011, 365(12): 1118-1127. DOI: 10.1056/NEJMra1001683
[2] Forner A, Reig M, Bruix J, et al.Hepatocellular carcinoma[J].Lancet, 2018, 391(10127):1301-1314. DOI: 10.1016/S0140-6736(18)30010-2
[3] Kudo M, Finn RS, Qin S, et al.Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma:a randomised phase 3 non-inferiority trial[J].Lancet, 2018, 391(10126): 1163-1173. DOI: 10.1016/S0140-6736(18)30207-1
[4] El-Khoueiry AB, Sangro B, Yau T, et al.Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040):an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017, 389(10088):2492-2502. DOI: 10.1016/S0140-6736(17)31046-2
[5] Abou-Alfa GK, Meyer T, Cheng AL, et al.Cabozantinib in patients with advanced and progressing hepatocellular carcinoma[J].N Engl J Med, 2018, 379(1):54-63. DOI: 10.1056/NEJMoa1717002
[6] Rajyaguru DJ, Borgert AJ, Smith AL, et al.Radiofrequency ablation versus stereotactic body radiotherapy for localized hepatocellular carcinoma in nonsurgically managed patients:analysis of the national cancer database[J].J Clin Oncol, 2018, 36(6):600-608. DOI: 10.1200/JCO.2017.75.3228
[7] Reiss KA, Yu S, Mamtani R, et al.Starting dose of sorafenib for the treatment of hepatocellular carcinoma:a retrospective, multi-institutional study[J].J Clin Oncol, 2017, 35(31):3575-3581. DOI: 10.1200/JCO.2017.73.8245
[8] Yu WB, Rao A, Vu V, et al.Management of centrally located hepatocellular carcinoma:Update 2016[J].World J Hepatol, 2017, 9(13):627- 634. DOI: 10.4254/wjh.v9.i13.627
[9] Xiao Y, Li W, Wan H, et al.Central hepatectomy versus major hepatectomy for patients with centrally located hepatocellular carcinoma: A meta-analysis[J].Int J Surg, 2018, 4(52):297-302. http://www.sciencedirect.com/science/article/pii/S1743919118305910
[10] McBride CM, Wallance S.Cancer of the right lobe of the liver:a variety of operative procedures[J].Arch Surg, 1972, 105(2):289-296. DOI: 10.1001/archsurg.1972.04180080139023
[11] Li W, Li L, Minigalin D, et al.Anatomic mesohepatectomy versus extended hepatectomy for patients with centrally located hepatocellular carcinoma[J].HPB (Oxford), 2018, 20(6):530-537. DOI: 10.1016/j.hpb.2017.11.012
[12] Cho CW, Rhu J, Kwon CHD, et al.Short-term outcomes of totally laparoscopic central hepatectomy and right anterior sectionectomy for centrally located tumors:a case-matched study with propensity score matching[J].World J Surg, 2017, 41(11):2838-2846. DOI: 10.1007/s00268-017-4105-5
[13] Fang CH, Tao HS, Yang J, et al.Impact of three-dimensional reconstruction technique in the operation planning of centrally located hepatocellular carcinoma[J].J Am Coll Surg, 2015, 220(1):28-37. DOI: 10.1016/j.jamcollsurg.2014.09.023
[14] Yantong Y, Shan L, Zhijie C, et al.A model prediction of long-term prognosis in patients with centrally located hepatocellular carcinoma undergoing hepatectomy[J].Eur J Surg Oncol, 2018, 44(10):1595-1602. DOI: 10.1016/j.ejso.2018.06.009
[15] Chen CH, Huang TH, Chang CC, et al.Central hepatectomy still plays an important role in treatment of early-stage centrally located hepatocellular carcinoma[J].World J Surg, 2017, 41(11):2830-2837. DOI: 10.1007/s00268-017-4096-2
[16] Kim WJ, Kim KH, Shin MH, et al.Totally laparoscopic anatomical liver resection for centrally located tumors:A single center experience[J]. Medicine (Baltimore), 2017, 96(4):e5560. DOI: 10.1097/MD.0000000000005560
[17] Qiu J, Chen S, Wu H, et al.The prognostic value of a classification system for centrally located liver tumors in the setting of hepatocellular carcinoma after mesohepatectomy[J].Surg Oncol, 2016, 25(4): 441-447. DOI: 10.1016/j.suronc.2016.03.001
[18] Ali MA, Chuang JF, Yong CC, et al.Extended central hepatectomy with preservation of segment 6 for patients with centrally located hepatocellular carcinoma[J].Hepatobiliary Pancreat Dis Int, 2015, 14(1):63- 68. DOI: 10.1016/S1499-3872(14)60302-7
[19] Edmondson HA, Steiner PE.Primary carcinoma of the liver:a study of 100 cases among 48, 900 necropsies[J].Cancer, 1954, 7:462-503. DOI: 10.1002/(ISSN)1097-0142
[20] Ishak K, Baptista A, Bianchi L.Histological grading and staging of chronic hepatitis[J].J Hepatol, 1995, 22:696-699. DOI: 10.1016/0168-8278(95)80226-6
[21] Li SH, Wei W, Guo RP, et al.Long-term outcomes after curative resection for patients with macroscopically solitary hepatocellular carcinoma without macrovascular invasion and an analysis of prognostic factors[J].Med Oncol, 2013, 30(4):696-704. DOI: 10.1007/s12032-013-0696-3
[22] Zhang W, Lai SL, Chen J, et al.Validated preoperative computed tomography risk estimation for postoperative hepatocellular carcinoma recurrence[J].World J Gastroenterol, 2017, 23(35):6467-6473. DOI: 10.3748/wjg.v23.i35.6467
[23] Lee S, Kim SH, Lee JE, et al.Preoperative gadoxetic acid-enhanced MRI for predicting microvascular invasion in patients with single hepatocellular carcinoma[J].J Hepatol, 2017, 67(3):526-534. DOI: 10.1016/j.jhep.2017.04.024
[24] Hui AM, Takayama T, Sano K, et al.Predictive value of gross classification of hepatocellular carcinoma on recurrence and survival after hepatectomy[J].J Hepatol, 2000, 33(6):975-979. DOI: 10.1016/S0168-8278(00)80131-2
[25] Yu W, Rong W, Wang L, et al.R1 hepatectomy with exposure of tumor surface for centrally located hepatocellular carcinoma[J].World J Surg, 2014, 38(7):1777-1785. DOI: 10.1007/s00268-013-2429-3
[26] Mehrabi A, Mood ZA, Roshanaei N, et al.Mesohepatectomy as an option for the treatment of central liver tumors[J].J Am Coll Surg, 2008, 207(4):499-509. DOI: 10.1016/j.jamcollsurg.2008.05.024
[27] Hu RH, Lee PH, Chang YC, et al.Treatment of centrally located hepatocellular carcinoma with central hepatectomy[J].Surgery, 2003, 133 (3):251-256. DOI: 10.1067/msy.2003.102
[28] Chen XP, Hu DY, Zhang ZW, et al.Role of mesohepatectomy with or without transcatheter arterial chemoembolization for large centrally located hepatocellular carcinoma[J].Dig Surg, 2007, 24(3):208-213. DOI: 10.1159/000102901
[29] Wu CC, Ho WL, Chen JT, et al.Mesohepatectomy for centrally located hepatocellular carcinoma:An appraisal of a rare procedure[J].J Am Coll Surg, 1999, 188(5):508-515. DOI: 10.1016/S1072-7515(99)00026-5
[30] Jeng KS, Jeng WJ, Sheen IS, et al.Is less than 5 mm as the narrowest surgical margin width in central resections of hepatocellular carcinoma justified[J].Am J Surg, 2013, 206(1):64-71. DOI: 10.1016/j.amjsurg.2012.06.010
[31] Yang A, Xiao W, Chen D, et al.The power of tumor sizes in predicting the survival of solitary hepatocellular carcinoma patients[J].Cancer Med, 2018, DOI: 10.1002/cam4.1873.
[32] Bruix J, Cheng AL, Meinhardt G, et al.Prognostic factors and predictors of sorafenib benefit in patients with hepatocellular carcinoma: Analysis of two phase Ⅲ studies[J].J Hepatol, 2017, 67(5):999-1008. DOI: 10.1016/j.jhep.2017.06.026
[33] Toyoda H, Kumada T, Tada T, et al.Differences in the impact of prognostic factors for hepatocellular carcinoma over time[J].Cancer Sci, 2017, 108(12):2438-2444. DOI: 10.1111/cas.2017.108.issue-12
[34] Kassahun WT.Contemporary management of fibrolamellar hepatocellular carcinoma:diagnosis, treatment, outcome, prognostic factors, and recent developments[J].World J Surg Oncol, 2016, 14(1):151. DOI: 10.1186/s12957-016-0903-8
[35] Zheng BH, Liu LZ, Zhang ZZ, et al.Radiomics score:a potential prognostic imaging feature for postoperative survival of solitary HCC patients[J].BMC Cancer, 2018, 18(1):1148. DOI: 10.1186/s12885-018-5024-z
-
期刊类型引用(4)
1. 李庆贺,张家耀,樊斌,王宇. 垂体肿瘤转化因子1和Ten-eleven转运因子1在肝细胞癌中的表达及相关性分析. 中华普通外科学文献(电子版). 2021(01): 18-22 .  百度学术
百度学术
2. 杨萍,李秋芳. 血清AKP、γ-GT、甲胎蛋白在原发性肝癌患者介入治疗前后的变化及意义. 中国卫生工程学. 2021(01): 160-161 .  百度学术
百度学术
3. 程武,张美玲,张巧梅,李晓东. 肝癌患者组织CCT6A表达情况及与疾病分期的关系探究. 中国医学创新. 2021(34): 153-157 .  百度学术
百度学术
4. 袁怡,凌宾芳,董梅娟,卜美玲,李瑞立,吉佳. 机器人中央型肝癌切除手术的护理配合. 护理学杂志. 2020(16): 54-56 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: