Expression of lncRNA DLEU1 in non-small cell lung cancer and its effect on metastasis
-
摘要:目的 研究长片段非编码RNA(long non-coding RNA,lncRNA)淋巴细胞白血病缺失基因1(deleted in lymphocytic leukemia 1,DLEU1)在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表达模式和临床意义,并进一步评估其对肿瘤转移的影响。方法 42例NSCLC患者配对的癌组织和癌旁组织于2008年1月至2012年12月在中南大学湘雅三医院经手术切除获得。采用实时定量聚合酶链反应检测NSCLC组织和细胞中DLEU1的表达特征。运用统计学方法分析DLEU1的表达与NSCLC患者临床病理特征及生存时间的关系。通过体外伤口愈合和细胞侵袭试验分析DLEU1对NSCLC细胞迁移及侵袭的影响。运用蛋白质印迹法检测DLEU1对NSCLC细胞上皮间质转化(EMT)的标志物(E-钙粘蛋白、N-钙黏蛋白和波形蛋白)表达量的影响。结果 42例NSCLC样本中,DLEU1的表达在35例中表现出上调(83.33%),而在7例中表现出下调(16.67%)。DLEU1在NSCLC癌组织的表达量是癌旁组织的2.11倍(P < 0.05)。DLEU1在4种NSCLC细胞系(A549、H1299、SPCA1和H358)的表达量均高于正常肺16HBE上皮细胞,其中,A549细胞中DLEU1表达量最高(P < 0.05)。高表达的DLEU1与淋巴结转移呈正相关(P < 0.05),但与其他参数无显著相关性,包括患者性别、年龄、吸烟史、原发肿瘤大小、组织学分级和TNM分期。与低DLEU1表达组患者相比,高表达组患者生存时间显著缩短(P < 0.05)。与对照组相比,体外干扰DLEU1的表达可显著抑制A549和SPCA1细胞的迁移和侵袭能力(P < 0.05)。与对照组相比,体外干扰DLEU1可显著增加A549细胞中E-钙黏蛋白表达量,而降低N-钙黏蛋白和波形蛋白表达量(P < 0.05)。结论 DLEU1在NSCLC组织和细胞系中表达上调,并与患者淋巴结转移和生存时间相关,且具有通过EMT促进肿瘤细胞迁移和侵袭的功能,表明DLEU1可能作为NSCLC的潜在治疗靶点。
-
关键词:
- 淋巴细胞白血病缺失基因1 /
- 非小细胞肺癌 /
- 上调 /
- 细胞 /
- 转移
Abstract:Objective To investigate the expression pattern and clinical significance of long non-coding RNA deleted in lymphocytic leukemia 1 (DLEU1) in non-small cell lung cancer (NSCLC), and to further evaluate its effect on tumor metastasis.Methods Paired cancer and adjacent tissues were obtained from 42 patients with NSCLC that underwent surgical resection of cancer in The Third Xiangya Hospital of Central South University from January 2008 to December 2012, at the Department of Cardiothoracic Surgery. The expression features of DLEU1 in NSCLC tissue were detected by real-time quantitative polymerase chain reaction assay. Statistical methods were used to analyze the relationship between the expression of DLEU1 and the clinicopathological features and the survival time of patients with NSCLC. Effects of DLEU1 on migration and invasion of NSCLC cells were evaluated by in vitro wound healing and cell invasion assays, respectively. Western blot was performed to investigate the protein levels of Ecadherin, Ncadherin, and Vimentin, which are the biomarkers of epithelial to mesenchymal transition (EMT).Results Of the 42 NSCLC samples, DLEU1 expression was up-regulated in 35 samples (83.33%) and down-regulated in 7 samples (16.67%). The expression level of DLEU1 in NSCLC tissue was 2.11 times that in the adjacent tissues (P < 0.05). The expression of DLEU1 in four NSCLC cell lines (A549, H1299, SPCA1, and H358) was higher than that in normal lung 16HBE epithelial cells, and of these, A549 cells had the highest DLEU1 expression (P < 0.05). Highly expressed DLEU1 was positively correlated with lymph-node metastasis (P < 0.05), but was not significantly associated with other parameters, including patient gender, age, smoking history, primary tumor size, histological grade, and the TNM stage. The survival time of patients with high DLEU1 expression was significantly shorter than that of patients with low DLEU1 expression (P < 0.05). In vitro interference with DLEU1 expression significantly inhibited the migration and invasion of A549 and SPCA1 cells compared with that of the control group (P < 0.05). Upon interference with DLEU1 expression, protein levels of E-cadherin increased, whereas those of N-cadherin and Vimentin decreased in A549 cells in comparison with the control group.Conclusions The expression of DLEU1 is up-regulated in NSCLC tissues and cell lines, correlates with lymph-node metastasis and survival times in patients with NSCLC, and promotes tumor cell migration and invasion by regulating EMT, suggesting that DLEU1 may be a potential therapeutic target for NSCLC. -
肺癌是最常见的癌症之一,也是全球癌症相关死亡的主要原因,可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),超过85%的肺癌病例属于NSCLC[1]。近年来,尽管在治疗和预后方面取得了较大进展,但NSCLC患者的总体5年生存率仍然低于15%[2]。长片段非编码RNA(long non-coding RNA,lncRNA)通常是一类长度超过200个核苷酸的非编码RNA,且无明显的蛋白质编码功能[3]。lncRNA在各种癌症中表达失调,并通过调节癌细胞生长、凋亡、迁移和侵袭促进肿瘤发生和进展[4-5]。lncRNA淋巴细胞白血病缺失基因1(deleted in lymphocytic leukemia 1,DLEU1)位于染色体13q14.3上,其在慢性淋巴细胞白血病,多发性骨髓瘤和其他造血系统恶性肿瘤中表达失调并发挥重要作用[6-7]。本研究预实验发现,与癌旁组织相比,DLEU1在NSCLC癌组织中表达上调。然而,关于DLEU1在NSCLC中确切的临床意义及肿瘤生物学功能,特别是在肿瘤细胞迁移和侵袭中的作用仍然存在较多未知领域。故本研究旨在分析DLEU1的表达与NSCLC患者临床病理特征及生存时间的关系,并进行一系列体外功能试验探讨DLEU1对NSCLC细胞迁移和侵袭的影响。
1. 材料与方法
1.1 材料
1.1.1 设备与试剂
ABI7500实时荧光定量PCR仪购自美国Applied Biosystems公司,倒置显微镜和荧光显微镜购自日本Olympus公司,E-Gel Imager凝胶成像系统购自美国Invitrogen公司。Dulbecco改良的Eagle培养基(DMEM)培养基、胎牛血清(FBS)和Lipofetamine 2000转染试剂均购自美国Thermo Fisher Scientific公司;总RNA提取试剂、逆转录及实时定量聚合酶链反应试剂均购自北京Takara公司,引物购自上海Sangon Biotech公司。E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)抗体均购自美国Abcam公司,DLEU1特异性siRNA(si-DLEU1)和对照siRNA(siNC)购自苏州GenePharma公司。
1.1.2 临床标本
42例NSCLC患者配对的癌组织和癌旁组织于2008年1月至2012年12月在中南大学湘雅三医院经手术切除获得,并在液氮中快速冷冻直至使用。本研究得到中南大学湘雅三医院伦理委员会的批准,并获得所有参与者书面的知情同意。其中,男性患者25例,年龄为21~68岁,平均年龄为(53.18±6.23)岁;女性患者17例,年龄为18~70岁,平均年龄为(52.01±5.59)岁。所有诊断为NSCLC的患者在手术前均未接受过放疗和化疗。采用2004年世界卫生组织修订的肿瘤分类系统确定NSCLC的组织学类型和等级[8]。所有患者的临床病理信息均被收集,包括患者性别、年龄、吸烟史、原发肿瘤大小、组织学分级、淋巴结转移和TNM分期。最终随访时间为2017年12月30日,生存时间(overall survival,OS)定义为手术至患者死亡或手术至最后记录点之间的时间。
1.2 方法
1.2.1 细胞培养
4种NSCLC细胞系(A549、H1299、SPCA1和H358)和正常肺16HBE上皮细胞由上海生命科学研究院细胞库提供。所有细胞系放置于37℃含5%CO2的细胞培养箱中培养,给予充足的DMEM培养基,并添加10% FBS、100 U/mL青霉素和100 μg/ mL链霉素。
1.2.2 RNA抽提、逆转录及实时定量聚合酶链反应
按照说明书流程,采用总RNA提取试剂从组织和细胞中提取总RNA。采用PrimeScriptTM RT Master Mix进行逆转录反应。然后,每份样品分为3份,使用SYBRTM Select Master Mix在ABI7500实时荧光定量PCR仪上进行实时定量聚合酶链反应。反应条件:95℃ 5 min(聚合酶活化),然后进行40个循环:95℃ 30 s(变性),55℃ 30 s(退火)和72℃ 30 s(延伸)。以GAPDH作为内参对照,引物序列:DLEU1,5'-AGGA GTCTACCTGGAAATG-3'和5'-GGACAGAGTTAAA CGCAAC-3';GAPD,5'-TCAAGAAGGTGGTGAAGC A-3'和5'-AGGT GGAGGAGTGGGTGT-3'。最后,通过2-ΔΔCq方法计算DLEU1表达倍数改变[9]。
1.2.3 细胞转染
si-DLEU1和si-NC的序列分别是5'-GCAGUCUGUUCUGAACAUA-3'和5'-GUCUGC AGCUGAGAGUAT-3'。转染过程如下:将处于对数生长期的细胞接种到富含完全培养基的6孔板中,待细胞生长至80%融合度时,根据说明书,使用Lipofectamine 2000将50 nmoL si-DLEU1和si-NC转染至A549和SPCA1细胞。48 h后,收集转染的细胞用于实时定量聚合酶链反应以确定转染效率。
1.2.4 细胞侵袭试验
采用Matrigel胶包被的Transwell小室进行细胞侵袭测定。取转染后的A549和SPCA1细胞重悬于200 μL无血清DMEM培养基中,并于Matrigel胶包被的Transwell上室中进行铺板,使每孔细胞数约为5×104个。下室中添加600 μL的完全培养基作为化学引诱剂。在37℃培养箱中孵育48 h后,除去上室中的细胞和基质胶,以甲醛固定侵入下室的细胞,采用结晶紫染色并在Olympus荧光显微镜下计数。
1.2.5 伤口愈合试验
将转染后的A549和SPCA1细胞以1×106个细胞/孔接种于6孔板中并培养至80%融合度。采用200 μL移液管尖端刮擦单层细胞,然后将细胞在不含FBS的培养基中继续培养。在倒置显微镜下观察伤口愈合情况并在0和24 h拍照,并使用伤愈合率Image J软件测量伤口宽度。伤口愈合率=(原始伤口宽度-不同时间点的伤口宽度/原始伤口宽度×100%。
1.2.6 蛋白质印迹法
通过RIPA缓冲液从制好的A549细胞提取总蛋白质样品,并采用BCA蛋白质测定试剂盒定量。用10%聚丙烯酰胺凝胶分离蛋白质并转移到PVDF膜上,在室温下用含5%脱脂牛奶的TBST液封闭2 h,然后在4℃下用抗体(E-cadherin、N-cadherin和Vimentin)孵育过夜。以TBST液洗涤3次后,将膜与辣根过氧化物酶缀合的抗体在室温下孵育2 h,采用E-Gel Imager凝胶成像系统观察目的蛋白条带。
1.3 统计学分析
采用SPSS 18.0软件进行统计学分析。每组试验至少独立重复3次,计量资料以x±s表示。通过配对t检验比较DLEU1在NSCLC癌组织和癌旁组织中的表达水平,并采用One-way ANOVA比较A549、H1299、SPCA1、H358和16HBE中DLEU1的表达水平。采用Chi-square test或Fisher确切概率法确定DLEU1水平与NSCLC临床病理学特征之间的关系。应用KaplanMeier及Log-rank法分析DLEU15表达与NSCLC患者生存时间的关系。其余统计分析均采用Student's t检验,以P < 0.05为差异具有统计学意义。
2. 结果
2.1 DLEU1的表达水平在NSCLC中显著上调
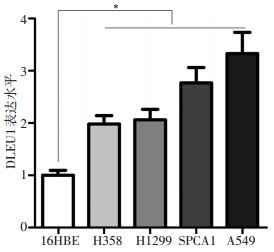
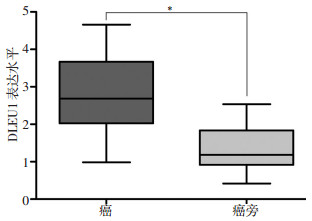
DLEU1在NSCLC癌组织的表达量是癌旁组织的2.11倍(图 1,P < 0.05),42例NSCLC样本中,DLEU1的表达在35例中表现出上调(383.33%),而在7例中表现出下调(16.67%)。DLEU1在4种NSCLC细胞系(A549、H1299、SPCA1和H358)的表达均高于正常肺16HBE上皮细胞,其中,A549细胞中DLEU1表达量最高(图 2,P < 0.05)。
2.2 DLEU1的表达水平与NSCLC患者临床病理特征的关系
以NSCLC癌组织中DLEU1表达量的平均值(2.79)为界限,患者中DLEU1的表达水平 < 2.79时指定为低DLEU1表达组(n=24),表达水平≥2.79指定为高DLEU1表达组(n=18)。与低DLEU1表达组相比,高DLEU1表达组显示出较高的淋巴结转移(表 1,P < 0.05),但与其他参数无显著相关性,包括患者性别、年龄、吸烟史、原发肿瘤大小、组织学分级和TNM分期。
表 1 DLEU1的表达水平与NSCLC患者临床病理特征的关系
2.3 DLEU1的表达水平与NSCLC患者生存时间的关系
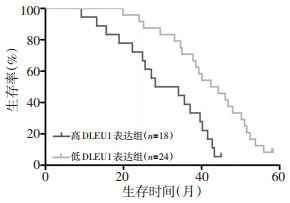
生存曲线发现,与低DLEU1表达组患者相比,高DLEU1表达组患者生存时间显著缩短(图 3,P < 0.05),其中总生存期风险比为3.57,95%CI为1.62~7.86。
2.4 干扰DLEU1对NSCLC细胞迁移的影响
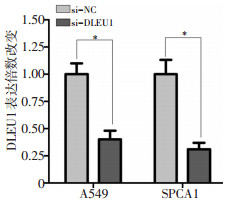
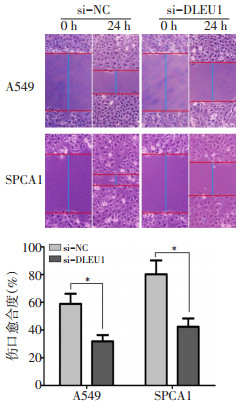
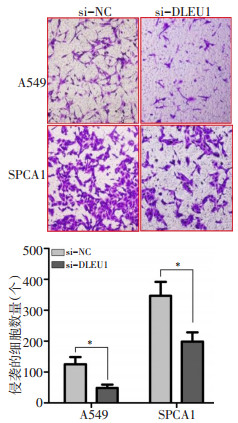
为了探索DLEU1对NSCLC细胞转移的影响,本研究采用si-DLEU1和si-NC转染至A549和SPCA1细胞。结果显示,与si-NC相比,转染si-DLEU1的A549和SPCA1细胞中DLEU1的表达水平显著降低(图 4,P < 0.05)。其次,通过伤口愈合试验观察DLEU1对A549和SPCA1细胞迁移的影响。A549细胞转染si-NC和si-DLEU1 24 h后,伤口愈合率分别为(58.88±7.27)%和(31.78±4.61)%;SPCA1细胞转染si-NC和si-DLEU1 24 h后,伤口愈合率分别为(80.15±10.02)%和(42.40±6.33)%。与si-NC相比,转染si-DLEU1可显著抑制A549和SPCA1细胞迁移能力(图 5,P < 0.05)。
2.5 干扰DLEU1对NSCLC细胞侵袭的影响
随后,采用细胞侵袭试验检测DLEU1对A549和SPCA1细胞侵袭的影响。与si-NC相比,当用si-DLEU1转染A549[(48.65±10.40)vs.(125.39±23.15)]和SPCA1 [(198.42±29.67)vs.(346.67±45.01)]24 h后,单个视野下侵袭的细胞数量显著减少(图 6,P < 0.05)。
2.6 干扰DLEU1对NSCLC细胞上皮间质转化(EMT)标志物蛋白表达量的影响
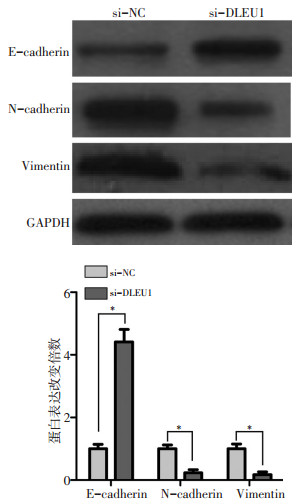
蛋白质印迹法显示,A549细胞中si-DLEU1组E-cadherin蛋白表达量是si-NC组的4.41倍,而N-cadherin和Vimentin蛋白表达量分别是si-NC组的0.23和0.17倍。与si-NC组相比,体外干扰DLEU1可显著增加A549细胞中E-cadherin蛋白表达量,而降低N-cadherin和vimentin蛋白表达量(图 7,P < 0.05)。
3. 讨论
转移性NSCLC患者预后差,死亡率极高。因此,靶向抑制肿瘤的转移对于改善晚期患者的预后具有重要意义。近年来,越来越多的研究显示表达失调的lncRNAs与NSCLC的发生发展密切相关,表明这些lncRNAs可能作为NSCLC早期诊断和监测预后的有效生物标志物,也可作为NSCLC分子靶向治疗的潜在靶点[10-11]。近期研究发现,lncRNA DLEU1在乳腺癌中高度表达,并在卵巢癌和胃癌发生发展中起关键作用,这些结果表明DLEU1可作为多种肿瘤的潜在诊断生物标志物和治疗靶点[12-14]。然而,关于DLEU1在NSCLC中确切的临床意义及肿瘤生物学功能,尤其对肿瘤细胞迁移和侵袭中的影响尚不明确。本研究发现NSCLC中高表达的DLEU1具有促进肿瘤迁移和侵袭的功能。
本研究中,首先探讨了DLEU1在NSCLC中的临床意义。通过采用实时定量聚合酶链反应检测42例NSCLC样本和4种NSCLC细胞系中DLEU1的表达水平。结果发现,与癌旁组织和正常肺16HBE上皮细胞相比,DLEU1在NSCLC癌组织和细胞系中的表达均表现出显著上调,并与患者阳性淋巴结转移和较短的生存时间相关,这与既往报道DLEU1在卵巢癌和胃癌的表达特征一致[13-14],表明NSCLC中表达上调的DLEU1与患者不良预后和肿瘤转移相关。由于DLEU1参与癌症的发展,因此人为调控其在肿瘤细胞中的表达水平已成为肿瘤治疗干预的潜在策略。Shao等[15]发现干扰DLEU1可显著抑制子宫内膜癌细胞迁移和侵袭。同时,Liu等[16]发现在体外和体内敲低DLEU1的表达可显著抑制结直肠癌细胞的增殖、迁移和侵袭。鉴于以上数据,推测DLEU1亦可能调节NSCLC细胞的转移行为。随后,采用DLEU1特异性siRNA(si-DLEU1)研究其对NSCLC细胞迁移和侵袭的影响。结果与推测的一致,转染si-DLEU1可显著抑制A549和SPCA1细胞迁移和侵袭能力。
侵袭和转移是癌症高死亡率的主要原因,EMT与癌细胞的高侵袭性和转移密切相关[17]。上皮细胞失去连接蛋白,如E-cadherin,并获得间充质制标志蛋白。如N-cadherin和Vimentin,对促进EMT至关重要。越来越多的证据表明lncRNAs通过调节EMT参与肿瘤的侵袭和转移。例如,抑制lncRNA SNHG20可通过与EZH2的增强子结合调节E-cadherin进而减少肝癌细胞增殖和侵袭[18]。过表达lncRNA ATB通过上调ZEB1和ZEB2促进EMT过程,最终促进肝癌细胞侵袭和转移[19]。lncRNA LINC01186通过降低肺癌细胞EMT抑制迁移和侵袭,而lncRNA SOX2OT通过诱导EMT过程促进NSCLC的迁移和侵袭[20-21]。本研究观察到转染si-DLEU1可显著下调N-cadherin和Vimentin蛋白表达量而上调E-cadherin蛋白表达量,提示干扰DLEU1主要通过降低EMT进而抑制NSCLC细胞转移行为。
目前,研究者普遍认为lncRNA在细胞中调控方式主要包括以下途径:1)通过影响目的基因启动子转录;2)通过影响RNA聚合酶Ⅱ的活性;3)通过与目的基因的转录本形成互补双链;4)通过与目的蛋白质结合影响其活性;5)通过改变目的蛋白质在细胞中的定位。最新研究发现,lncRNA可通过竞争性内源RNA(competing endogenous RNA,ceRNA)机制与微小RNA(microRNA,miRNA)结合从而调控miRNA介导的靶基因沉默[22]。因此,推测DLEU1可能通过ceRNA机制调节某个或者某些miRNAs进而促进NSCLC迁移和侵袭。回顾已发表的相关文献,发现多种miRNAs与NSCLC迁移和侵袭密切相关,包括miR-203、miR-132、miR-577及miR-598等[23]。进一步采用生物信息学分析,发现miR-132与DLEU1存在共同的靶基因结合位点。因此推测DLEU1可能通过ceRNA机制下调miR-132进而促进NSCLC迁移和侵袭,但上述推测仍有待进一步证明。
综上所述,本研究发现DLEU1在NSCLC组织和细胞系中表达上调,并与患者淋巴结转移和生存时间相关。DLEU1可通过调节NSCLC的EMT过程发挥促进肿瘤细胞迁移和侵袭的作用,DLEU1可能为NSCLC潜在的治疗靶点。
-
表 1 DLEU1的表达水平与NSCLC患者临床病理特征的关系

-
[1] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1):7-30. DOI: 10.3322/caac.21387
[2] Lochowski M, Lochowska B, Rebowski M, et al. Five-year survival analysis and prognostic factors in patients operated on for nonsmall cell lung cancer with N2 disease[J]. J Thorac Dis, 2018, 10(6): 3180-3186. DOI: 10.21037/jtd
[3] Zampetaki A, Albrecht A, Steinhofel K. Long non-coding RNA structure and function: Is There a Link[J]? Front Physiol, 2018, 9:1201. DOI: 10.3389/fphys.2018.01201
[4] Balas MM, Johnson AM. Exploring the mechanisms behind long noncoding RNAs and cancer[J]. Noncoding RNA Res, 2018, 3(3): 108-117. DOI: 10.1016/j.ncrna.2018.03.001
[5] Dey BK, Mueller AC, Dutta A. Long non-coding RNAs as emerging regulators of differentiation, development, and disease[J]. Transcription, 2014, 5(4):e944014. DOI: 10.4161/21541272.2014.944014
[6] Grygalewicz B, Woroniecka R, Rygier J, et al. Monoallelic and biallelic deletions of 13q14 in a group of CLL/SLL patients investigated by CGH Haematological Cancer and SNP array (8x60K)[J]. Mol Cytogenet, 2016, 9:1. DOI: 10.1186/s13039-015-0212-x
[7] Dowd AA, Homeida S, Elkarem HA. Detection of chromosome 13 (13q14) deletion among Sudanese patients with multiple myeloma using a molecular genetics fluorescent in situ hybridization technique (FISH)[J]. Malays J Pathol, 2015, 37(2):95-100. http://cn.bing.com/academic/profile?id=1cf263cf71fe97646d384930a349e4ad&encoded=0&v=paper_preview&mkt=zh-cn
[8] Grilley-Olson JE, Hayes DN, Moore DT, et al. Validation of interobserver agreement in lung cancer assessment: hematoxylin-eosin diagnostic reproducibility for non-small cell lung cancer: the 2004 World Health Organization classification and therapeutically relevant subsets[J]. Arch Pathol Lab Med, 2013, 137(1):32-40. DOI: 10.5858/arpa.2012-0033-OA
[9] Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6):1101-1108. DOI: 10.1038/nprot.2008.73
[10] Yang J, Lin J, Liu T, et al. Analysis of lncRNA expression profiles in non-small cell lung cancers (NSCLC) and their clinical subtypes[J]. Lung Cancer, 2014, 85(2):110-115. DOI: 10.1016/j.lungcan.2014.05.011
[11] Wei MM, Zhou GB. Long non-coding RNAs and their roles in non-smallcell lung cancer[J]. Genomics Proteomics Bioinformatics, 2016, 14(5): 280-288. DOI: 10.1016/j.gpb.2016.03.007
[12] Wu Q, Guo L, Jiang F, et al. Analysis of the miRNA-mRNA-lncRNA networks in ER+ and ER-breast cancer cell lines[J]. J Cell Mol Med, 2015, 19(12):2874-2887. DOI: 10.1111/jcmm.12681
[13] Li X, Li Z, Liu Z, et al. Long non-coding RNA DLEU1 predicts poor prognosis of gastric cancer and contributes to cell proliferation by epigenetically suppressing KLF2[J]. Cancer Gene Ther, 2018, 25(3-4): 58-67. DOI: 10.1038/s41417-017-0007-9
[14] Wang LL, Sun KX, Wu DD, et al. DLEU1 contributes to ovarian carcinoma tumourigenesis and development by interacting with miR-490-3p and altering CDK1 expression[J]. J Cell Mol Med, 2017, 21(11):3055-3065. DOI: 10.1111/jcmm.2017.21.issue-11
[15] Shao W, Li Y, Chen F, et al. Long non-coding RNA DLEU1 contributes to the development of endometrial cancer by sponging miR-490 to regulate SP1 expression[J]. Pharmazie, 2018, 73(7):379-385. https://www.ncbi.nlm.nih.gov/pubmed/30001771
[16] Liu T, Han Z, Li H, et al. LncRNA DLEU1 contributes to colorectal cancer progression via activation of KPNA3[J]. Mol Cancer, 2018, 17(1): 118. DOI: 10.1186/s12943-018-0873-2
[17] Yeung KT, Yang J. Epithelial-mesenchymal transition in tumor metastasis[J]. Mol Oncol, 2017, 11(1):28-39. http://d.old.wanfangdata.com.cn/Periodical/zgzlswzlzz200905025
[18] Liu J, Lu C, Xiao M, et al. Long non-coding RNA SNHG20 predicts a poor prognosis for HCC and promotes cell invasion by regulating the epithelial-to-mesenchymal transition[J]. Biomed Pharmacother, 2017, 89:857-863. DOI: 10.1016/j.biopha.2017.01.011
[19] Yuan JH, Yang F, Wang F, et al. A long noncoding RNA activated by TGF-beta promotes the invasion-metastasis cascade in hepatocellular carcinoma[J]. Cancer Cell, 2014, 25(5):666-681. DOI: 10.1016/j.ccr.2014.03.010
[20] Hao Y, Yang X, Zhang D, et al. Long noncoding RNA LINC01186, regulated by TGF-beta/SMAD3, inhibits migration and invasion through Epithelial-Mesenchymal-Transition in lung cancer[J]. Gene, 2017, 608: 1-12. DOI: 10.1016/j.gene.2017.01.023
[21] Zhang K, Li Y, Qu L, et al. Long noncoding RNA Sox2 overlapping transcript (SOX2OT) promotes non-small-cell lung cancer migration and invasion via sponging microRNA 132 (miR-132)[J]. Onco Targets Ther, 2018, 11:5269-5278. DOI: 10.2147/OTT
[22] Chan JJ, Tay Y. Noncoding RNA:RNA regulatory networks in cancer[J]. Int J Mol Sci, 2018, 19(5):1310. DOI: 10.3390/ijms19051310
[23] legras a, pecuchet n, imbeaud s, et al. epithelial-to-mesenchymal transition and microRNAs in lung cancer[J]. Cancers (Basel), 2017, 9 (8):01. http://cn.bing.com/academic/profile?id=dc634c0eae905c460f7b1c51929abce7&encoded=0&v=paper_preview&mkt=zh-cn
-
期刊类型引用(4)
1. 刘明翠,唐江月,缑萍萍,韩爱珺,任蓉,益华. 长链非编码RNA淋巴细胞白血病缺失基因1与卵巢癌细胞紫杉醇耐药的相关性研究. 世界临床药物. 2022(11): 1412-1420 .  百度学术
百度学术
2. 张科,杜国波,谭榜宪. 长链非编码RNA与宫颈癌预后关系研究进展. 医学综述. 2020(02): 274-279 .  百度学术
百度学术
3. 喻欣,刘文艺,杜隆德,王春光,谢晶,牟巨伟. lncRNA GPC3-AS1在非小细胞肺癌中的表达及对癌细胞生物学行为的影响. 中华生物医学工程杂志. 2020(03): 200-206 .  百度学术
百度学术
4. 孙英慧,谢晓冬,欧阳明玥,宋爽,杨冀,于卉影. Entinostat影响NK细胞对非小细胞肺癌杀伤作用的体外研究. 中国肿瘤临床. 2019(08): 378-383 .  本站查看
本站查看
其他类型引用(3)



 下载:
下载: