Eleven cases of DEB-TACE comprehensive interventional strategy for stage Ⅲa hypovascular hepatocellular carcinoma
-
摘要:目的 探讨门静脉支架联合125I粒子条植入、载药微球经肝动脉化疗栓塞术(drug-eluting beads transarterial chemoembolization,DEB-TACE)及分子靶向药物综合治疗Ⅲa期乏血供肝细胞癌(hepatocellular carcinoma,HCC)伴门静脉癌栓(portal vein tumor thrombus,PVTT)的安全性和有效性。方法 回顾性分析2016年11月至2018年10月于华中科持大学同济医学院附属协和医院11例确诊为Ⅲa期乏血供HCC伴PVTT 11例患者,行门静脉支架联合125I粒子条植入后序贯使用载药微球经肝动脉化学栓塞术(DEB-TACE)及分子靶向药物综合治疗。随访期间,评估所有患者治疗后支架通畅情况及DEB-TACE治疗后的肿瘤反应,比较术前、术后1个月的肝功能、血常规的变化并总结并发症的发生情况。结果 根据原发性肝癌诊疗规范(2017年版)11例患者均为Ⅲa期,Child-Pugh A、B级,影像学提示为乏血供肝癌,最大径为8.4±4.1(2.8~14.1)cm,均伴有PVTT,其中程氏分型Ⅱ型者4例,Ⅲ型者7例;门静脉主干癌栓≥50%者6例, < 50%者1例。所有患者顺利进行125I粒子支架门静脉内植入联合DEB-TACE治疗。支架植入后3个月、6个月通畅率均为100%;DEB-TACE治疗后3个月完全缓解(complete response,CR)患者4例(36.4%),部分缓解(partial response,PR)患者5例(45.5%),疾病稳定(stable disease,SD)患者2例(18.2%),PD患者0例。客观反应率(objective response rate,ORR)为81.8%,疾病控制率(disease control rate,DCR)为100%。肝肾功能、血常规等指标术前与术后1个月差异无统计学意义,11例患者在围手术期过程中未出现严重并发症。结论 门静脉支架联合125I粒子条植入序贯使用载药微球经肝动脉化学栓塞术(DEB-TACE)及分子靶向药物,综合治疗Ⅲa期乏血供HCC伴PVTT可以恢复门脉主干血流并保持中长期通畅,同时较理想地杀灭肿瘤及控制肿瘤生长,是安全有效的治疗策略。Abstract:Objective To evaluate the efficacy and safety of portal vein stenting combined with 125I particle strand implantation followed by drug-eluting beads transarterial chemoembolization (DEB-TACE) and molecular-targeted therapy for the treatment of stage Ⅲa liver cancer lacking a blood supply.Methods A retrospective analysis of 11 patients who had stage Ⅲa liver cancer lacking a blood supply combined with portal vein tumor thrombosis (PVTT) was conducted from October 2016 to October 2018. All the patients underwent portal vein stenting combined with 125I particle strand implantation, DEB-TACE, and comprehensive treatment containing molecular-targeted drugs. During the follow-up period, all patients were evaluated for stent patency after the implantation and tumor response after DEB-TACE treatment. The liver function and blood routine changes before and 1 month after the surgery were completed, and the complications were summarized.Results All 11 patients were judged as stage Ⅲa liver cancer based on the Chinese staging criteria (2017), Child-Pugh classification grade A and B. The imaging findings indicated that these tumors were hypovascular. The maximum diameter of these lesions was (8.4±4.1) (2.8-14.1) cm, and all patients had PVTT. Among them, there were 4 cases of Cheng's type Ⅱ and 7 cases of type Ⅲ: 6 cases of main PVTT ≥50% and 1 case of PVTT < 50%. All patients underwent portal vein stenting combined with 125I particle strand implantation, DEB-TACE, and comprehensive treatment containing molecular-targeted drugs. Three and 6 months after stent implantation, the patency rate was 100%; 3 months after DEB-TACE treatment, complete response was achieved in 4 (36.4%) patients, partial response was achieved in 5 (45.5%) patients, and stable disease was achieved in 2 (18.2%) patients. No patients exhibited progressive disease. Therefore, the objective response rate was 81.8% and disease control rate was 100%. As for the liver and kidney function and blood routine tests, there were no significant differences between baseline and 1 month after the surgery. In addition, no patient had any serious complication during the perioperative period.Conclusions For patients with stage Ⅲa liver cancer lacking a blood supply and PVTT, a comprehensive treatment strategy including portal vein stenting combined with 125I particle strand implantation, DEB-TACE, and molecular-targeted therapy can restore portal vein blood flow and maintain mid- and longterm stent patency, while effectively killing tumors and controlling tumor growth, which is a safe and effective treatment strategy.
-
Keywords:
- hepatocellular carcinoma (HCC) /
- portal vein stent /
- 125I seed /
- drug-eluting beads
-
全球癌症统计表明,肝癌将是全球第六大常见癌症,也是全球癌症死亡的第四大原因,原发性肝癌以肝细胞癌(hepatocellular carcinoma,HCC)为主,占75%~85%[1]。由于肝癌的解剖学和生物学特点,其合并门静脉癌栓(portal vein tumor thrombus,PVTT)的发生率较高,可达44.0%~62.2%[2]。HCC合并PVTT患者在自然发展的情况下中位生存期仅为2.7~4个月[3]。各国指南表明经肝动脉化疗栓塞(transarterial chemoembolization,TACE)是进展期肝癌的首选治疗方法,但PVTT的形成降低了门静脉的血流灌注,使得TACE的疗效并不明显。门静脉支架联合125I粒子条的使用使得此类患者的门静脉重新开通,肝实质正常血流供应得以恢复,使其获得TACE治疗的机会[4]。传统碘油TACE(conventional TACE,cTACE)对于乏血供肝癌疗效不佳,相较而言药物洗脱微球(drug-eluting beads,DEB)TACE的治疗在乏血供肝转移癌中具有较好的疗效和安全性[5]。另外指南推荐分子靶向药物作为Ⅲa期肝癌首选治疗,如无明显的服用禁忌,均推荐服用[6]。本文的11例患者均接受门静脉支架粒子条,DEB-TACE及分子靶向药物综合介入治疗,旨在探讨该治疗策略的安全性和有效性。
1. 材料与方法
1.1 回顾性分析一般资料
2016年11月至2018年10月于华中科技大学同济医学院附属协和医院11例患者,均按照诊断标准确诊为HCC合并PVTT,患者一般资料见表 1。
表 1 患者基线特征
1.2 方法
1.2.1 入组和排除标准
入组标准:1)年龄为18~ 75岁,性别不限。2)符合病理或原发性肝癌诊疗规范(2017年版)为Ⅲa期肝癌。3)根据程氏分型为Ⅱ型或Ⅲ型PVTT[7]。4)Child-Pugh分级A或B级。5)ECOG评分≤1.6患者及其家属签署知情同意书。
排除标准:1)疑似良性血栓形成,有PVTT的局部治疗史。2)合并其他严重疾病,无法完成治疗。3)有出血倾向,凝血时间明显延长国际标准化比值(international normalized ratio,INR)>1.5。
1.2.2 手术方法
治疗过程:所有患者在无手术禁忌后先进行125I粒子条支架门静脉内植入术,待肝功能指标恢复至术前水平后行DEB-TACE继续治疗。术前、术后1个月查血常规、肝肾功能、凝血功能等指标。所有患者在确诊为肝癌合并门静脉癌栓后均需按规律服用分子靶向药物(索拉菲尼或阿帕替尼)。
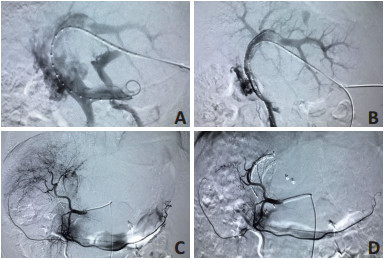
门静脉支架联合125I粒子条内植入方法:常规准备,皮肤消毒、铺巾,穿刺点2%利多卡因局麻后,在多普勒超声导向下用21 G Chiba套管针穿刺未受累肝段的门静脉分支,成功后送入0.018英寸导丝及6 F导管鞘。后交换泥鳅导丝及5 F猪尾导管,越过门静脉狭窄段入脾静脉或肠系膜上静脉行直接造影,判断癌栓累及范围。测量癌栓长度,植入125I粒子的数量按公式:梗阻段长度(mm)/4.5+4计算[4]。本研究中使用的125I粒子有效长度为3.25 mm,由钛包裹,每个125I粒子的放射性为25.9 MBq,半衰期为59.4天,有效辐射半径约1.7 cm,主要光子发射和初始剂量率分别为31.4 keV,35.5 keV和7 cGy/h。将所需125I粒子连续封装入无菌鞘管内制成粒子条备用。建立两根导丝轨道,分别经导丝引入适当型号的血管内支架及制备好的125I粒子条,将粒子条置于支架与门静脉癌栓之间卡住。释放后重新置入猪尾导管,再次造影复查,确认支架及粒子条位置满意后用弹簧圈封堵肝内穿刺道(图 1)。
DEB-TACE操作方法:常规准备,皮肤消毒、铺巾,局麻下采用Seldinger技术穿刺右侧股动脉,引入5F Yashiro及微导管至腹腔动脉、左右肝动脉、肠系膜上动脉注入造影剂行动脉造影,DSA摄影。寻找肿瘤染色灶,将导管超选择至肿瘤供血动脉,将制备好的携载表柔比星的Callispheres载药微球经微导管输送至肿瘤供血动脉,直到药物流速减慢至停止及可见血管铸型停止。复查造影满意后拔管,加压包扎。
1.2.3 术后处理
术后留院4~7 d,予保肝、抗凝等对症支持治疗,术后抗凝措施:每12 h低分子肝素皮下注射1次,出院后阿斯匹林口服100 mg/d。所有患者在确诊为HCC合并PVTT后均按需规律服用分子靶向药物(如索拉菲尼、阿帕替尼)。术后3 d复查血常规、肝肾功能、凝血功能等生化指标,如无特殊异常及严重并发症出现即可安排出院。
1.2.5 术后随访
每月电话随访1次,了解患者的并发症情况及生存质量。术后4周复查肝肾功能、血常规、凝血功能等。每4~6周复查AFP及上腹部平扫+增强CT以了解患者肝内病灶治疗后情况,同时评价门静脉支架内的通畅情况;肝内病灶治疗后应答采用改良实体肿瘤应答评估标准(mRECIST)[8]进行评价。
1.3 统计学分析
采用IBM SPSS Statistics 24软件进行数据分析,计量资料以

2. 结果
2.1 手术情况
全组11例患者手术均顺利进行。其中经右支穿刺入路3例,经左支穿刺入路8例。门静脉主干梗阻段平均长度为43.9±13.1(27.3~76.2)mm。共植入支架12枚(直径10~16 mm,长度40~100 mm),其中1例患者植入支架2枚;125I粒子条11条(共190枚125I粒子,平均每条17.3粒);每瓶Callispheres微球混合80 mg表柔比星,其中100~300 µm微球5例,300~500 µm微球6例,术中共注入微球111 mL,平均每例患者10.1 mL。
2.2 血常规与肝功能变化
通过比较发现,术后1个月肝功能及血常规指标与术前比较无显著差异(P>0.05),可认为该综合治疗策略对患者的肝功能和血常规指标不产生影响(表 2)
表 2 患者术前及术后1个月血常规及肝功能比较
2.3 支架通畅情况
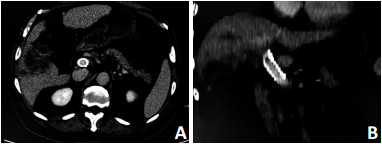
所有患者平均随访时间为4~24个月,患者术后每6周行CT平扫+增强扫描检查以评估门静脉通畅情况,至随访期结束或患者死亡,所有患者支架置入后3个月、6个月支架通畅率均为100%(图 2)。
2.4 DEB-TACE治疗后肿瘤反应
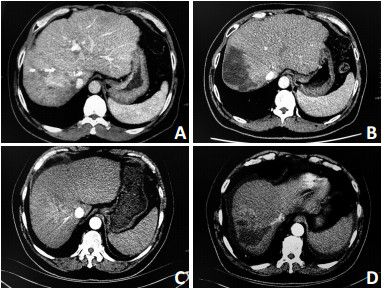
根据mRECIST评价标准,所有患者术后经CT平扫+增强评估病灶治疗情况,在11例患者中,DEBTACE术后3个月CR患者4例(36.4%),PR患者5例(45.5%),SD患者2例(18.2%),PD患者无,客观反应(OR)定义为CR+PR,疾病控制(DC)定义为CR+PR+SD。CRR为36.4%,ORR为81.8%,DCR为100%(图 3)。
2.5 并发症发生情况
11例患者均未出现穿刺出血、胆漏、肝脓肿、腹腔出血、肿瘤出血、胃肠道出血等技术并发症。术后不良反应主要为栓塞后综合征,表现为发热、恶心及术区疼痛,对症处理后均明显改善。
3. 讨论
肝癌合并PVTT往往导致正常肝实质灌注不足,肝脏储备能力下降,因此TACE的疗效存在争议,2017年NCCN指南指出肝癌合并PVTT为TACE治疗的相对禁忌证。对于这些患者,目前尚无标准治疗方案[9]。门静脉支架的放置可及时恢复门静脉血流灌注,增强肝脏储备功能;同时缓解由癌栓造成的门静脉高压,降低出血风险。为后续的TACE治疗打下基础。但是,支架植入后很容易由于肿瘤生长或支架内血栓形成造成再狭窄。为了延长支架通畅时间,在门静脉支架置入术后进行三维适形放射治疗等外照射放射治疗是有益的。但相比之下,近距离放射治疗可能是一种更为合适的选择[10]。其优势在于:1)肿瘤区域内高度积聚的辐射,对周围正常组织无严重损伤;2)持续放射抑制肿瘤细胞增殖并诱导细胞凋亡;3)不受患者呼吸运动的影响;4)低剂量辐射通过改变肿瘤细胞的免疫表型降低了转移的发生率。一项包含137例患者的回顾性对照研究表明,门静脉支架联合125I粒子植入相较于三维适形放疗而言,具有更长的支架通畅期和更高的生存获益[11]。当然,近距离放射治疗与三维适形放疗相比,仍然有其不足之处,如剂量分布不均匀,不能较好的适形。
本文中的11例患者放置门静脉支架联合125I粒子条后3个月、6个月的支架通畅率均为100%,这为合并门静脉癌栓的患者提供了中长期的门静脉通畅,为后续的治疗提供了良好的肝脏储备能力。
TACE是中晚期肝癌首选的治疗方法,其疗效很大程度上取决于碘油的沉积情况。乏血供肝癌供血动脉细疏,碘油即时沉积少,在病灶内的充填不完全,且在注入时容易发生反流栓塞正常肝动脉,导致肝功能损害,单用传统的碘油栓塞难以取得较好的疗效。研究证实,乏血供肝癌仍以肝动脉供血为主,其治疗仍可采用经血管途径,针对肿瘤供血动脉的栓塞仍然是治疗的关键措施,选择合理的栓塞材料至关重要[12]。
一项212例患者参与的前瞻性RCT研究(PRECISION V)[13]显示,DEB-TACE与传统碘油TACE相比,完全反应率,客观反映率和疾病控制率分别为27% vs. 22%,52%vs. 44%及63%vs. 52%。虽然总的来说DEB-TACE并不优于传统碘油TACE,但是高风险患者分层分析后表明,在Child-Pugh B级,ECOG评分为1分,双叶病变和复发性疾病患者中,DEB-TACE的OR和DC显著优于传统TACE治疗。此外,药物洗脱微球可以更加安全地递送更高剂量的阿霉素,可明显改善患者的耐受性,显著降低阿霉素严重的肝毒性和相关不良反应。另有证据表明,在乏血供肿瘤如胃肠道肿瘤肝转移患者的治疗方面,与传统疗法相比,药物洗脱微球表现出较为明显的优势[5, 14]。
本研究中11例患者均于门静脉支架联合125I粒子条植入后行DEB-TACE治疗,术后每6周行CT平扫+增强进行治疗部位病灶评估,根据mRECIST标准,术后3个月CR 4例(36.4%),PR 5例(45.5%),SD 2例(18.2%),PD患者0例,其完全反应率为36.4%,客观反应率为81.8%,疾病控制率为100%。
分子靶向药物如索拉菲尼可抑制肿瘤细胞增殖和肿瘤血管生成,并可在多种肿瘤模型中提高细胞凋亡率,现已成为进展期肝癌的推荐治疗方法[6],一项多国、随机、双盲、安慰剂对照的Ⅲ期临床试验(SHARP)[15]显示,在晚期肝细胞癌患者中,接受索拉非尼治疗的患者中位生存期和放射学进展时间比服用安慰剂的患者长近3个月。而对于合并有门静脉癌栓的肝癌患者,另有研究表明,索拉菲尼的使用能使10%该类患者达到血运重建,效果显著[16]。因此本文中涉及患者在肝癌合并门静脉癌栓确诊后,均需按规律服用索拉菲尼或阿帕替尼治疗。
对于Ⅲa期乏血供肝癌目前标准治疗尚存争议,本研究联合门静脉支架粒子条,DEB-TACE及分子靶向药物综合介入治疗,通过门静脉支架联合125I粒子条使门静脉再通并取得较长的通畅时间,通过DEB-TACE获得了良好的客观反应率和疾病控制率,与此同时,分子靶向药的服用进一步提高了患者的生存获益。手术治疗期间,术中未发生严重并发症,术后肝功能与术前相比无显著性差异。综上所述,该治疗方式安全有效,值得进一步研究。
-
表 1 患者基线特征

表 2 患者术前及术后1个月血常规及肝功能比较

-
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. http://cn.bing.com/academic/profile?id=72ddb2c2747f7f6244ee8ffc4ce98b19&encoded=0&v=paper_preview&mkt=zh-cn
[2] Zhang ZM, Lai EC, Zhang C, et al. The strategies for treating primary hepatocellular carcinoma with portal vein tumor thrombus[J]. Int J Surg, 2015, 20:8-16. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fbwk201405020
[3] Katagiri S, Yamamoto M. Multidisciplinary treatments for hepatocellular carcinoma with major portal vein tumor thrombus[J]. Sur Today, 2014, 44(2):219-226. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=969c2749a4b6bc05188930edda8ab90e
[4] Zhang ZH, Liu QX, Zhang W, et al.Combined endovascular brachytherapy, sorafenib, and transarterial chemobolization therapy for hepatocellular carcinoma patients with portal vein tumor thrombus[J]. World J Gastroenterol, 2017, 23(43):7735-7745. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QKC20172017121900134890
[5] Cao G, Zhu X, Li J, et al.A comparative study between Embosphere((R)) and conventional transcatheter arterial chemoembolization for treatment of unresectable liver metastasis from GIST[J]. Chin J Cancer Res, 2014, 26(1):124-131. http://cn.bing.com/academic/profile?id=13e5275d3c4c6d28d1b4cc7b130b3bdb&encoded=0&v=paper_preview&mkt=zh-cn
[6] 樊嘉, 秦叔逵, 沈锋, 等.原发性肝癌诊疗规范(2017年版)[J].中国实用外科杂志, 2017(7):705-720. http://d.old.wanfangdata.com.cn/Periodical/crbxx201703001 [7] 程树群, 吴孟超, 陈汉, 等.肝癌门静脉癌栓分型的影像学意义[J].中华普通外科杂志, 2004, (4):6-7. http://d.old.wanfangdata.com.cn/Periodical/zhptwk200404002 [8] Lencioni R, Llovet JM. Modified RECIST (mRECIST) Assessment for Hepatocellular Carcinoma[J]. Semin Liver Dis, 2010, 30(1):52-60. DOI: 10.1055/s-0030-1247132
[9] 吴孟超, 程树群, 陈敏超, 等.肝细胞肝癌合并门静脉癌栓多学科诊治中国共识(2016年版)(讨论稿)[J].肝癌电子杂志, 2016(1):1-14. http://d.old.wanfangdata.com.cn/Periodical/gadzzz201601002 [10] Lu J, Guo JH, Zhu HD, et al. Safety and efficacy of irradiation stent placement for malignant portal vein thrombus combined with transarterial chemoembolization for hepatocellular carcinoma: a singlecenter experience[J]. J Vasc Interv Radiol, 2017, 28(6):786-794. DOI: 10.1016/j.jvir.2017.02.014
[11] Yu TZ, Zhang W, Liu QX, et al. Endovascular brachytherapy combined with portal vein stenting and transarterial chemoembolization improves overall survival of hepatocellular carcinoma patients with main portal vein tumor thrombus[J]. Oncotarget, 2017, 8(7):12108. http://cn.bing.com/academic/profile?id=c4043cc74941fc4cd26e796d43977f11&encoded=0&v=paper_preview&mkt=zh-cn
[12] Liu YS, Lin CY, Chuang MT, et al. Five-year outcome of conventional and drug-eluting transcatheter arterial chemoembolization in patients with hepatocellular carcinoma[J]. BMC Gastroenterology, 2018, 18(1). http://cn.bing.com/academic/profile?id=1a2c91966c2f4663aaed9053c0d397bc&encoded=0&v=paper_preview&mkt=zh-cn
[13] Lammer J, Malagari K, Vogl T, et al. Prospective Randomized Study of Doxorubicin-Eluting-Bead Embolization in the Treatment of Hepatocellular Carcinoma: Results of the PRECISION V Study[J]. CardioVascular and Interventional Radiology, 2010. 33(1):41-52. DOI: 10.1007/s00270-009-9711-7
[14] Martin RC, Salem R, Adam R, et al. Locoregional surgical and interventional therapies for advanced colorectal cancer liver metastases: expert consensus statements[J]. HPB(Oxford), 2013, 15(2):131-133. http://cn.bing.com/academic/profile?id=1332cd13f052327c9ca0193f3c5f6fd3&encoded=0&v=paper_preview&mkt=zh-cn
[15] Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. New Engl J Med, 2008, 359(4):378-390. DOI: 10.1056/NEJMoa0708857
[16] Jeong SW, Jang JY, Shim KY, et al. Practical Effect of Sorafenib Monotherapy on Advanced Hepatocellular Carcinoma and Portal Vein Tumor Thrombosis[J]. Gut Liver, 2013, 7(6):696-703. DOI: 10.5009/gnl.2013.7.6.696
-
期刊类型引用(15)
1. 徐樟琦,简以增,廖霁婷. TACE综合介入治疗晚期原发性肝癌的临床效果及对患者肝功能影响研究. 中外医疗. 2023(16): 84-88 .  百度学术
百度学术
2. 李海霞,王秀香,王明月,李辉. 药物洗脱微球-肝动脉化疗栓塞术联合微波消融治疗原发性肝癌对肝功能指标和CRP、TNF-α的影响. 中外医学研究. 2023(20): 168-172 .  百度学术
百度学术
3. 唐嘉莹. 采用MRI诊断对肝脏炎性病变、乏血供肿瘤进行辨别的临床研究. 影像研究与医学应用. 2022(03): 47-49 .  百度学术
百度学术
4. 胡卫,刘良进. DCE-MRI结合DWI评估肝癌介入治疗疗效的应用价值. 国际医药卫生导报. 2022(05): 719-724 .  百度学术
百度学术
5. 余海滨,张克勤,冷向北,王文英,万萍,欧阳兵,杨文娟. 40~120μm直径三丙烯微球m-肝动脉化疗栓塞术治疗乏血供肝癌的疗效与安全性分析. 当代医学. 2022(13): 49-52 .  百度学术
百度学术
6. 刘松,于广计,王庆东. CalliSpheres载药微球经肝动脉化疗栓塞治疗全身化疗失败的不可切除结直肠癌肝转移的疗效及预后因素分析. 中国癌症防治杂志. 2022(02): 171-176 .  百度学术
百度学术
7. 苗颖. 载药微球治疗原发性肝癌的研究进展. 河北医药. 2022(14): 2198-2202 .  百度学术
百度学术
8. 王瑶,吴孟航,万娟,罗义平. 老年肝癌合并门静脉癌栓微创诊疗研究进展. 老年医学与保健. 2022(04): 945-949 .  百度学术
百度学术
9. 刘松,乔元岗. 介入序贯阿帕替尼、卡瑞利珠单抗治疗原发性肝癌1例. 现代消化及介入诊疗. 2022(08): 944-946 .  百度学术
百度学术
10. 刘松,王倩,乔元岗,邱忠华,张伟伟. DEB-TACE联合仑伐替尼治疗不可切除中晚期肝癌的临床研究. 现代消化及介入诊疗. 2022(12): 1562-1566 .  百度学术
百度学术
11. 于爱军,于满,迟强,李修明. 外生型肝癌误诊为肾上腺嗜铬细胞瘤临床报告并文献复习. 临床误诊误治. 2021(05): 14-17 .  百度学术
百度学术
12. 张大闯,马富权,马富平,晁延军,李志路,刘宁,代晓强. 载药微球与传统C-TACE在治疗乏血供型原发性肝癌中的临床疗效对比. 现代消化及介入诊疗. 2021(06): 689-692 .  百度学术
百度学术
13. 刘心,汪五全,温玉蓉. DEB-TACE联合索拉非尼对肝细胞癌的临床疗效. 血管与腔内血管外科杂志. 2021(05): 605-609+623 .  百度学术
百度学术
14. 鄢清元,熊巍,杨文平. 晚期肝癌患者索拉非尼分子靶向治疗的有效性及对疾病控制率的影响研究. 中国医学创新. 2021(29): 173-177 .  百度学术
百度学术
15. 尹星,付民,尹先哲,周阳,常欢. 载药微球TACE在无法切除肝癌患者中的应用以及对术后无进展和总生存时间的影响. 中西医结合肝病杂志. 2021(12): 1123-1126 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: