LncRNA ABHD11-AS1 promotes proliferation and migration of non-small cell lung cancer cells by regulating STAT1/STAT3 expression
-
摘要:目的 探讨lncRNA ABHD11-AS1在非小细胞肺癌中的生物学功能和作用机制。方法 选取2016年7月至2018年12月在广东医科大学附属医院行非小细胞肺癌手术的248例患者,采用χ2检验分析lncRNA ABHD11-AS1的表达与患者年龄、性别、临床病理分期、病理类型及吸烟状态的关系;采用Kaplan-Meier法分析ABHD11-AS1对非小细胞肺癌患者的预后意义;应用qRTPCR方法检测ABHD11-AS1在非小细胞肺癌组织和细胞系中的表达;通过体外功能测定评估敲低ABHD11-AS1对细胞增殖和转移的影响;通过Western blot实验探讨ABHD11-AS1在非小细胞肺癌中致癌作用的分子机制。结果 lncRNA ABHD11-AS1高表达组较低表达组吸烟患者较少(P=0.02),分期更晚(P < 0.01);ABHD11-AS1高表达预示非小细胞肺癌患者预后不良;ABHD11-AS1在非小细胞肺癌组织和癌细胞株中高表达;敲低ABHD11-AS1的表达可抑制体外细胞增殖和迁移;敲低ABHD11-AS1表达抑制STAT1和STAT3癌蛋白的表达。结论 ABHD11-AS1可能通过促进STAT1和STAT3癌蛋白的表达,从而增加非小细胞肺癌细胞的增殖、集落形成以及迁移和侵袭能力。
-
关键词:
- 长链非编码 /
- RNA lncRNA ABHD11-AS1 /
- 非小细胞肺癌 /
- 增殖 /
- 侵袭
Abstract:Objectives Long-chain non-coding RNA (lncRNA) plays an important role in tumorigenesis and development. At present, lncRNAs are still insufficiently studied in non-small cell lung cancer. This study focused on the biological function and mechanism of lncRNA ABHD11-AS1 in non-small cell lung cancer.Methods A total of 248 non-small cell lung cancer patients who underwent surgery in the Affiliated Hospital of Guangdong Medical University from July 2016 to December 2018 were selected. Chi-square test was used to analyze the relationship between the expression of lncRNA ABHD11-AS1 and age, sex, clinical pathological stage, pathological type and smoking status. Kaplan-Meier method was used to analyze the prognostic significance of ABHD11-AS1 in patients with non-small cell lung cancer. qRT-PCR was used to detect the expression of ABHD11-AS1 in non-small cell lung cancer tissues and cell lines. The effect of knockdown of ABHD11-AS1 on cell proliferation and metastasis was evaluated by in vitro functional assay. Western blot was used to investigate the molecular mechanism of ABHD11-AS1 in non-small cell lung cancer.Results LncRNA ABHD11-AS1 high expression group was related to advanced stage (P < 0.01) and had fewer smoking patients than lower expression group (P=0.02). ABHD11-AS1 high expression was predictive of poor prognosis in patients with non-small cell lung cancer. ABHD11-AS1 is highly expressed in non-small cell lung cancer tissues and cancer cell lines. Knockdown of ABHD11-AS1 expression can inhibit cell proliferation and metastasis in vitro. Knockdown of ABHD11-AS1 expression inhibits STAT1 and STAT3 oncoproteins expression.Conclusions ABHD11-AS1 may promote the proliferation, colony formation, migration and invasion of non-small cell lung cancer cells by promoting the expression of STAT1 and STAT3. -
目前, 肺癌是全球癌症相关死亡的首要原因[1]。尽管使用CT扫描筛查能提高早期诊断率, 但5年相对生存率仍然较低(18%), 部分原因是由于近半数的病例就诊时已经属于晚期, 其5年生存率仅为4%[1-2], 因此迫切需要寻找有助于肺癌早期诊断或分期以及新的靶向治疗标记物。越来越多的证据表明, 超过70%的人类基因组被转录成初级RNA, 但只有约2%编码产物肽, 其余为非编码RNA(non-coding RNA, ncRNA)[3-4]。这些ncRNA在其转录物长度上可以被分成两组: < 200 bp的小ncRNA和≥ 200 bp[5]的长ncRNA(long non-coding RNA, lncRNA)。本研究应用qRT-PCR技术检测非小细胞肺癌组织及细胞中lncRNA ABHD11-AS1的表达, 并通过基因干扰技术抑制非小细胞肺癌细胞株中ABHD11-AS1的表达, 观察其在体外对非小细胞肺癌细胞增殖、克隆及迁移侵袭能力的影响, 并初步探讨其可能的分子机制。
1. 材料与方法
1.1 临床资料
1.1.1 样本收集
选取2016年7月至2018年12月在广东医科大学附属医院行非小细胞肺癌手术的248例患者, 中位年龄60(17~78)岁。所有病例均经病理组织学诊断; 所有标本直接取自手术切除物, 均为配对组织, 即癌组织和癌旁正常组织(距离病灶≥ 5 cm, 经病理证实无肿瘤细胞浸润)。在手术切除后10 min之内取材并置于冻存管中, 储存至-80℃。所有患者均获得随访, 采用电话随访形式, 首次随访时间为2016年12月, 末次随访时间为2019年3月, 随访时间5~32个月。
1.1.2 试剂与仪器
RNA提取试剂盒购自北京天根生物公司, RNA反转录试剂盒购自美国诺维赞生物公司, 荧光定量PCR试剂盒购自北京康为世纪生物公司, 7500荧光定量PCR仪购自美国ABI公司。所有siRNA试剂均购自北京吉码公司。
1.1.3 qRT-PCR检测基因lncRNA
通过PCR引物设计软件Primer Premier 5.0设计lncRNA ABHD11-AS1、STAT1、STAT3和GAPDH的引物序列, 由上海生工生物公司合成。具体序列如下:ABHD11-AS1上游引物:5'- AGGAGTGGTTGCATTTGG GA-3', 下游引物:5'- CCCACCACGCAGTGAATAGT-3';STAT1上游引物:5'- GCACTATTGCCCCTGGAGTT-3', 下游引物:5'- CTACGACACTCTCGAGCTGC-3';STAT3上游引物:5'- TGGCCCAATGGAATCAGCTAC-3', 下游引物:5'-CTGCTGGTCAATCTCTCCCA-3';GAPDH上游引物:5'- GGAAGGACTCATGACCACAGTCC-3', 下游引物:5'- TCGCTGTGAAGTCAGAGGAGACC-3'。引物干粉离心后用焦碳酸二乙酯(DEPC)溶液配制成20 μmol/L, 置于-20℃冰箱备用。
1.2 方法
1.2.1 siRNA的转染
将细胞以所需浓度接种, 在24 h和48 h加入ABHD11-AS1 siRNA和对照siRNA, 终浓度为10 nmol/L。根据说明书, 使用Lipofectamine® RNAiMaxReagent在OptiMEM培养基中进行敲低。通过qRT-PCR检测敲低率。
1.2.2 总RNA的提取和反转录
根据说明书, 使用miRNeasy Mini试剂盒从组织或培养的细胞中分离总RNA。使用High Capacity cDNA Reverse Transcription试剂盒, 在标准条件下使用引物将1 μg总RNA用于20 μL终体积的逆转录反应。使用Power SYBR Green master Mix将1 μL相应的cDNA用于随后的qRT-PCR反应, GAPDH的表达作为内参, PCR扩增的条件为95℃10 min, (95℃ 15 s、60℃ 30 s、72℃ 30 s)×40个循环。3次独立实验后得到的数据采用公式RQ=2-ΔΔCt进行计算。
1.2.3 WST-1法检测细胞增殖
将细胞以1×103个细胞/孔接种到96孔板上。在24 h和48 h时加入ABHD11- AS1 siRNA和对照siRNA。根据说明书, 使用WST-1试剂(德国罗氏公司)在siRNA转染后96~120 h测量细胞增殖能力。每个实验重复3次。
1.2.4 克隆形成实验
对于集落形成, 将用ABHD11- AS1 siRNA和对照siRNA转染的肺癌细胞以2×102个细胞/孔接种在6孔板中。在37℃温育10~14天后, 使用0.1%结晶紫和20%甲醇作为染料溶液来固定和染色菌落。每孔中计数菌落数。超过50个细胞为1个克隆。每个实验重复3次。
1.2.5 细胞迁移和侵袭测定
在Transwell室系统中测量非小细胞肺癌细胞的迁移和侵袭能力。将稀释的细胞外基质(ECM)凝胶溶液60 μL加入小室检测侵袭能力。对于迁移能力的测定, 利用小室并使用相同的方法但不加ECM凝胶溶液。将小室在37℃温箱里孵育4 h, 接下来, 以1×105个细胞/孔接种在含有1%FBS的100 μL培养基中, 将含有10%FBS的培养基500 μL加入小室外。然后将小室置于37℃细胞温箱里孵育24~ 48 h。后用多聚甲醛和结晶紫染色, 利用Image J软件计算细胞数。每个实验重复3次。
1.2.6 Western blot法检测蛋白表达
收集细胞, 提取总蛋白, 用BCA法测定蛋白浓度。取40 μg蛋白, 在15% tricine-SDS-PAGE凝胶上进行电泳分离; 然后将蛋白转至PVDF膜上, 用5%脱脂牛奶封闭, 一抗孵育4℃过夜, 二抗室温孵育1.5 h, 用ECL化学发光液进行显影。
1.3 统计学分析
采用SPSS 19.0统计学软件进行分析。计量资料以

2. 结果
2.1 lncRNA ABHD11-AS1表达情况与预后分析
检测248例非小细胞肺癌与癌旁正常组织中ABHD11-AS1的表达量(图 1A)。非小细胞肺癌患者组织中ABHD11-AS1表达量显著高于配对癌旁组织, 差异具有统计学意义(P < 0.01)。结合生存数据分析显示ABHD11-AS1高表达, 其总生存(over survival, OS)显著低于ABHD11-AS1低表达组(P=0.002, 图 1B)。
2.2 lncRNA ABHD11-AS1表达与临床病理特征的关系
分析lncRNA ABHD11-AS1的表达与患者年龄、性别、临床病理分期、病理类型及吸烟状态的关系, 结果发现lncRNA ABHD11-AS1高表达组较低表达组吸烟患者较少(P=0.02)、分期较晚(P < 0.01)。高表达组的中位年龄为57.5岁, 低表达组为59.0岁, 两组差异无统计学意义(P=0.33, 表 1)。
表 1 lncRNA ABHD11-AS1的表达与肺癌患者临床病理特征的关系
2.3 肺癌细胞与正常支气管上皮细胞的表达水平
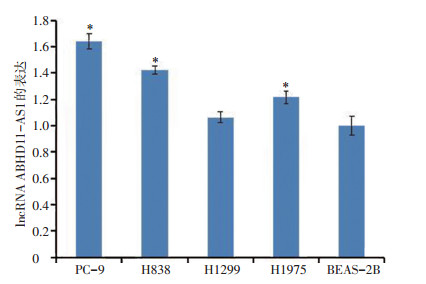
非小细胞肺癌细胞PC-9、H838、H1299和H1975的ABHD11-AS1表达水平显著高于人肺支气管上皮细胞BEAS-2B, 差异具有统计学意义(P < 0.05)。PC-9和H838细胞的ABHD11-AS1表达水平更高, 故选择在PC-9和H838细胞中进行后续实验(图 2)。
2.4 细胞增殖能力
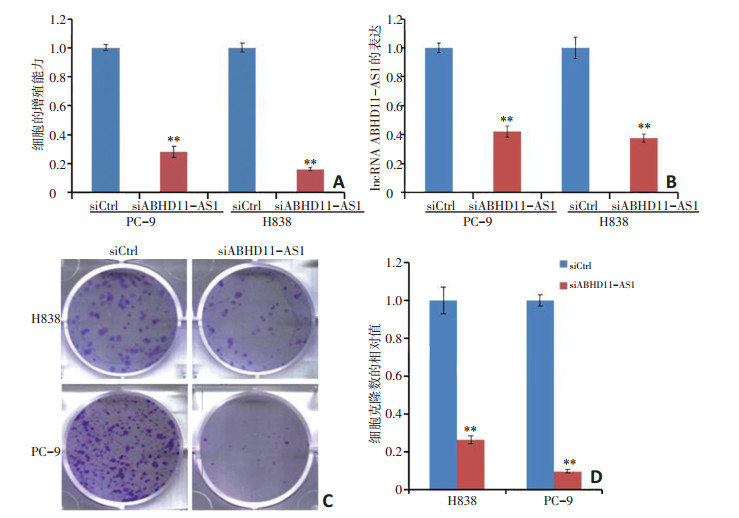
本研究将4条ABHD11-AS1 siRNA(简称为siABHD11-AS1)混合后进行以下细胞功能及分子机制实验。将siABHD11-AS1转染进PC-9和H838两株非小细胞肺癌细胞中, 检测细胞增殖和集落形成能力。qRT-PCR显示用siABHD11-AS1转染后ABHD11-AS1表达显著降低(P < 0.01, 图 3A)。使用WST-1试剂检测细胞增殖能力, 结果显示在PC-9和H838细胞系中ABHD11-AS1敲低96 h后细胞抑制超过35%(P < 0.01, 图 3B)。在PC-9和H838细胞系中抑制ABHD11-AS1后, 集落形成显著减少(P < 0.01, 图 3C, D)。
2.5 细胞迁移和侵袭能力
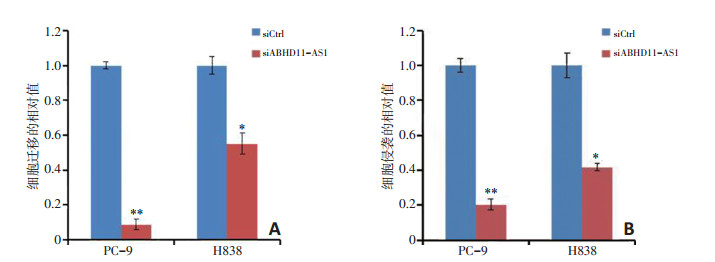
为了研究ABHD11-AS1对非小细胞肺癌细胞中细胞迁移和侵袭的潜在作用, 本研究进行Transwell实验。结果发现在PC-9和H838细胞中敲低ABHD11-AS1后细胞迁移被抑制45%~90%(P < 0.05, 图 4A)。细胞侵袭被抑制60%~80%(P < 0.01, 图 4B)。研究表明ABHD11- AS1可能参与非小细胞肺癌转移潜在相关的机制。
2.6 癌基因蛋白STAT1和STAT3的表达
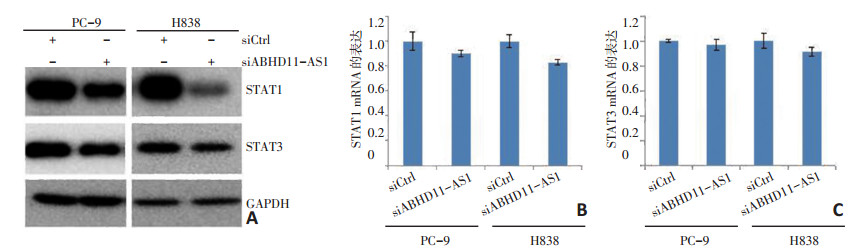
为进一步研究由ABHD11-AS1调节的潜在分子机制, 本研究应用蛋白印迹方法检测在PC-9和H838细胞中ABHD11-AS1敲低后表达改变的蛋白质。结果发现在PC-9和H838细胞中用ABHD11-AS1 siRNA处理细胞72 h后致癌蛋白STAT1和STAT3均降低(图 5A)。研究表明, 癌蛋白STAT1和STAT3可能在ABHD11-AS1网络中调节非小细胞肺癌细胞的增殖、迁移和侵袭中起重要作用。随后通过RT-PCR检测该基因的mRNA表达, 结果发现在PC-9和H838细胞中STAT1和STAT3mRNA无显著变化, 表明在ABHD11-AS1敲低后STAT1和STAT3基因是在转录后水平被调节(图 5B, C)。
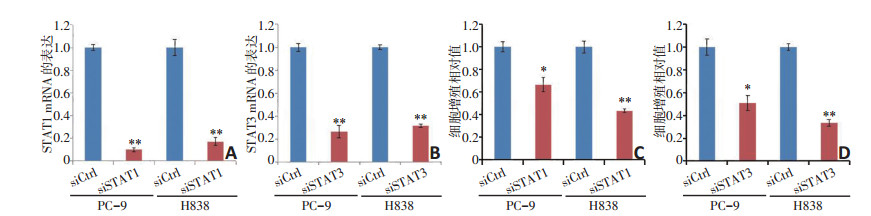
2.7 STAT1和STAT3影响非小细胞肺癌的增殖
进一步探讨ABHD11-AS1是否通过癌蛋白STAT1和STAT3影响非小细胞肺癌的增殖, 本研究后期敲除STAT1和STAT3的表达, 先通过qRT-PCR实验检测其敲除率为65%~90%(图 6A, 6B), 再行WST-1实验检测非小细胞肺癌的增殖率明显降低(图 6C, D)。研究表明STAT1和STAT3是ABHD11-AS1调节非小细胞肺癌生长的重要癌基因。
3. 讨论
越来越多的证据表明, lncRNAs在人体细胞中广泛表达, 并作为关键调节因子影响其增殖、分化、凋亡和细胞周期等[6-7]。此外, lncRNA表达的改变与多种癌症发病机制相关[8-9]。如lncRNA SNHG12在肺癌中高度表达, 通过下调miR-138表达促进肺癌细胞增殖[10]。Liu等[11]发现lncRNA ZEB1-AS1在骨肉瘤中表达上调, 并与晚期临床分期和预后不良有关。体外实验表明, lncRNA ZEB1-AS1通过激活ZEB1促进骨肉瘤细胞的增殖和迁移。然而, lncRNA在肺癌中的生物学功能及其进一步的分子机制尚不明确。
lncRNA ABHD11的反义链RNA1, 简称lncRNA ABHD11-AS1, 位于人类7号染色体q11.23, 是一种新鉴定的lncRNA。既往研究报道ABHD11-AS1在多种肿瘤中失调, 包括胃癌[12]、膀胱癌[13]、子宫内膜癌[14]和上皮性卵巢癌[15]。然而, ABHD11-AS1在非小细胞肺癌中是否异常表达及其生物学功能的相关研究较少。
本研究结果表明lncRNA ABHD11-AS1在非小细胞肺癌组织和癌细胞系中过表达。在非小细胞肺癌细胞中用siRNA敲低lncRNA ABHD11-AS1表达后, 细胞增殖和集落形成减少。转移是癌症的另一种重要恶性行为。据报道, lncRNA参与调节肿瘤转移, 如MALAT-1[16]和HOX反义基因间RNA(HO-TAIR)[17], 本研究发现ABHD11-AS1敲低后非小细胞肺癌细胞的迁移和侵袭能力显著下降, 表明ABHD11-AS1可能参与非小细胞肺癌的分子转移过程。ABHD11-AS1通过复杂的机制诱导肿瘤发生, 包括激活细胞存活和增殖的信号通路。既往研究表明, ABHD11-AS1的失调参与多种肿瘤的发生和发展的过程。如胃癌患者的胃液ABHD11-AS1表达明显较高, 其可作为胃癌筛查的潜在生物标志物[12]。ABHD11-AS1在膀胱癌中高表达, 与临床生物学特征呈正相关, 其降低可抑制膀胱癌细胞的增殖和迁移, 证明其是膀胱癌的治疗靶点[13]。lncRNA ABHD11-AS1通过靶向细胞周期蛋白D1促进子宫内膜癌细胞增殖和侵袭, 在子宫内膜癌中发挥致癌作用[14]。另一项研究表明[15], 上皮性卵巢癌中ABHD11-AS1的表达水平显著上调, ABHD11-AS1的敲低在体内、外均抑制上皮性卵巢癌细胞的增殖和迁移。上述结果均表明ABHD11-AS1参与多种肿瘤发生, 并且在其中充当癌基因的角色。
本研究结果显示在非小细胞肺癌细胞中敲低ABHD11-AS1表达后, 致癌蛋白STAT1和STAT3的表达降低。敲低STAT1和STAT3, 细胞增殖同时减少, 表明这两种蛋白可能参与ABHD11-AS1调节非小细胞肺癌细胞增殖的信号通路。STAT家族包括7个成员: STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6b。STAT1是其中重要成员之一, 参与细胞生长调节、抗病毒和免疫防御[18-19]。STAT1和STAT3是人类恶性肿瘤中最常见被激活的STAT家族成员, 是多种肿瘤的致癌信号通路和胞内信号转导通路中的重要分子, 并可以被多个促炎因子和生长因子活化[20]。STAT1和STAT3生物作用广泛, 可以直接或间接调控相关基因, 在细胞增殖、凋亡、分化和血管生成等方面发挥重要作用。近年研究[21-25]已证实, STAT3在许多造血系统肿瘤及实体肿瘤中均有异常表达, 如白血病、肺癌、肝癌、乳腺癌及前列腺癌等。STAT3参与了肿瘤细胞的增殖、分化、侵袭、转移、血管生成及抗凋亡, 能够诱导抗凋亡蛋白、细胞周期蛋白、基质金属蛋白酶和血管内皮生长因子等的表达[20]。
综上所述, ABHD11-AS1可能通过影响STAT1和STAT3癌蛋白的表达, 影响非小细胞肺癌细胞增殖、集落形成以及迁移和侵袭。本研究表明ABHD11-AS1是人类非小细胞肺癌细胞中的功能性lncRNA, 在非小细胞肺癌进展中起重要作用。
-
表 1 lncRNA ABHD11-AS1的表达与肺癌患者临床病理特征的关系

-
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1):7-30. DOI: 10.3322/caac.21332
[2] Torre LA, Siegel RL, Jemal A. Lung cancer statistics[J]. Adv Exp Med Biol, 2016, 893:1-19. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0211560783/
[3] Haemmerle M, Gutschner T. Long non-coding RNAs in cancer and development: where do we go from here[J]? Int J Mol Sci, 2015, 16 (1):1395-1405. DOI: 10.3390/ijms16011395
[4] Li CH, Chen Y. Targeting long non-coding RNAs in cancers: progress and prospects[J]. Int J Biochem Cell Biol, 2013, 45(8):1895-1910. DOI: 10.1016/j.biocel.2013.05.030
[5] Ma L, Bajic VB, Zhang Z. On the classification of long non- coding RNAs[J]. RNA Biol, 2013, 10(6):925-933. http://cn.bing.com/academic/profile?id=14c05afe22041497ccaa5c3cf47e20fb&encoded=0&v=paper_preview&mkt=zh-cn
[6] Dey BK, Mueller AC, Dutta A. Long non-coding RNAs as emerging regulators of differentiation, development, and disease[J]. Transcription, 2014, 5(4):e9440141-e9440149. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=10.4161/21541272.2014.944014
[7] Johnsson P, Lipovich L, Grander D, et al. Evolutionary conservation of long non-coding RNAs; sequence, structure, function[J]. Biochim Biophys Acta, 2014, 1840(3):1063-1071. DOI: 10.1016/j.bbagen.2013.10.035
[8] Shen XH, Qi P, Du X. Long non-coding RNAs in cancer invasion and metastasis[J]. Mod Pathol, 2015, 28(1):4-13. DOI: 10.1038/modpathol.2014.75
[9] Li J, Tian H, Yang J, et al. Long noncoding RNAs regulate cell growth, proliferation, and apoptosis[J]. DNA Cell Biol, 2016, 35(9):459-470. DOI: 10.1089/dna.2015.3187
[10] Wang X, Qi G, Zhang J, et al. Knockdown of long noncoding rna small nucleolar RNA host gene 12 inhibits cell growth and induces apoptosis by upregulating miR-138 in nonsmall cell lung cancer[J]. DNA Cell Biol, 2017, 36(11):892-900. DOI: 10.1089/dna.2017.3830
[11] Liu C, Pan C, Cai Y, et al. Interplay between long noncoding RNA ZEB1-AS1 and miR-200s regulates osteosarcoma cell proliferation and migration[J]. J Cell Biochem, 2017, 118(8):2250-2260. DOI: 10.1002/jcb.25879
[12] Yang Y, Shao Y, Zhu M, et al. Using gastric juice lncRNA-ABHD11-AS1 as a novel type of biomarker in the screening of gastric cancer[J]. Tumour Biol, 2016, 37(1):1183-1188. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=be6df6744543fc7f4ae3011660da5ebd
[13] Chen M, Li J, Zhuang C, et al. Increased lncRNA ABHD11- AS1 represses the malignant phenotypes of bladder cancer[J]. Oncotarget, 2017, 8(17):28176-28186. http://cn.bing.com/academic/profile?id=e5aa7ad530893d772094a74a2df095f7&encoded=0&v=paper_preview&mkt=zh-cn
[14] Liu Y, Wang LL, Chen S, et al. LncRNA ABHD11-AS1 promotes the development of endometrial carcinoma by targeting cyclin D1[J]. J Cell Mol Med, 2018, 22(8): 3955-3964. DOI: 10.1111/jcmm.13675
[15] Wu DD, Chen X, Sun KX, et al. Role of the lncRNA ABHD11-AS1 in the tumorigenesis and progression of epithelial ovarian cancer through targeted regulation of RhoC[J]. Mol Cancer, 2017, 16(1): 138-148. DOI: 10.1186/s12943-017-0709-5
[16] Gutschner T, Hammerle M, Eissmann M, et al. The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J]. Cancer Res, 2013, 73(3):1180-1189. DOI: 10.1158/0008-5472.CAN-12-2850
[17] Gupta RA, Shah N, Wang KC, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010, 464(7291):1071-1176. DOI: 10.1038/nature08975
[18] Schindler C, Brutsaert S. Interferons as a paradigm for cytokine signal transduction[J]. Cell Mol Life Sci, 1999, 55(12):1509-1522. DOI: 10.1007/s000180050391
[19] Avalle L, Pensa S, Regis G, et al. STAT1 and STAT3 in tumorigenesis: A matter of balance[J]. JAKSTAT, 2012, 1(2):65-72. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3670295
[20] Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1845(2):136-154. http://cn.bing.com/academic/profile?id=e558a1e7d292138b777881af1e03c587&encoded=0&v=paper_preview&mkt=zh-cn
[21] Ishida F, Matsuda K, Sekiguchi N, et al. STAT3 gene mutations and their association with pure red cell aplasia in large granular lymphocyte leukemia[J]. Cancer Science, 2014, 105(3):342-346. DOI: 10.1111/cas.12341
[22] Geletu M, Guy S, Raptis L. Effects of SRC and STAT3 upon gap junctional, intercellular communication in lung cancer lines[J]. Anticancer Res, 2013, 33(10):4401-4410. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=095b2b561ba93ad33d99d1673532c0be
[23] Ramakrishna G, Rastogi A, Trehanpati N, et al. From cirrhosis to hepatocellular carcinoma: new molecular insights on inflammation and cellular senescence[J]. Liver Cancer, 2013, 2(3-4):367-383. DOI: 10.1159/000343852
[24] Hsu FN, Chen MC, Lin KC, et al. Cyclin-dependent kinase 5 modulates STAT3 and androgen receptor activation through phosphorylation of Ser727 on STAT3 in prostate cancer cells[J]. Am J Physiol Endocrinol Metab, 2013, 305(8):E975-986. DOI: 10.1152/ajpendo.00615.2012
[25] Ibrahim SA, Hassan H, Vilardo L, et al. Syndecan-1 (CD138) modulates triple-negative breast cancer stem cell properties via regulation of LRP-6 and IL-6-mediated STAT3 signaling[J]. PloS One, 2013, 8(12):e857371-e8573714. http://cn.bing.com/academic/profile?id=1741221e84e65e1225539e0492d88914&encoded=0&v=paper_preview&mkt=zh-cn
-
期刊类型引用(4)
1. 高欣,仇公才,于少博,王海存,姜兴明,孙东升. ABHD11-AS1在肿瘤中表达及调控作用研究. 肿瘤学杂志. 2022(06): 504-509 .  百度学术
百度学术
2. 郭明珠,梁珍珍,韩晶晶,庞晶. LncRNA PSMA3-AS1靶向miR-379-3p基因对非小细胞肺癌细胞增殖、迁移和侵袭影响的机制研究. 实用癌症杂志. 2022(07): 1050-1054+1067 .  百度学术
百度学术
3. 郑延龙,高喆. OCT4及STAT3的表达对肺癌化疗药物耐药性的影响. 中国处方药. 2021(01): 20-22 .  百度学术
百度学术
4. 邵旭辉,丁希艳,李彦冬. 长链非编码RNA牛磺酸上调基因在肝癌组织中表达及对肝癌细胞活性的影响. 北华大学学报(自然科学版). 2021(06): 748-752 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载: