Treatment strategies and outcomes of pulmonary recurrence after neoadjuvant chemoradiation plus total mesorectal excision for rectal cancer in a multidisciplinary team model
-
摘要:目的 了解多学科协作(multidisciplinary team,MDT)模式下直肠癌术后肺转移治疗决策现状和结局,为加强医疗质量管理、完善MDT模式提供依据。方法 回顾性收集2007年7月至2015年2月北京大学肿瘤医院680例接受术前新辅助治疗联合根治术的直肠癌患者临床资料,调查术后发生肺转移的患者在MDT模式下的治疗决策、执行情况和生存结局。结果 研究纳入85例术后肺转移患者,68例采用MDT模式治疗,其中28例建议行局部根治,40例建议行姑息治疗;决策总执行率为89.7%(61/68),未执行者均选择进一步保守治疗。局部根治的患者在直肠原发灶术后首次发生复发/转移后的3年复发/转移后生存率(survival after recurrence,SAR)高于姑息治疗患者(84.8% vs.37.6%,P < 0.001)。结论 在MDT模式运行良好的情况下,直肠癌根治术后肺转移的治疗决策执行率较高,部分患者在该模式下有机会获得根治且预后良好;引入“患者参与”和“社会支持”将有助于构建全新MDT模式和提高医疗质量管理水平。Abstract:Objective To investigate the treatment strategies and outcomes of pulmonary recurrence after total mesorectal excision for rectal cancer in a multidisciplinary team (MDT) model and enhance health care quality management.Methods This retrospective cohort study, conducted from July 2007 to February 2015 at Peking University Cancer Hospital (PKUCH) identified 680 patients with mid-low rectal cancer who received neoadjuvant chemoradiation in combination with total mesorectal excision. We investigated MDT treatment decisions, the final implementation, and survival outcomes of patients with pulmonary recurrence who entered the MDT model.Results We identified 85 patients with metachronous pulmonary recurrence. Of these, 68 patients were treated within the MDT model at PKUCH. For 28 patients, local treatment with a curative intent was recommended. The other 40 patients received palliative treatment or supportive care. Of the 68 MDT decisions, 61 (89.7%) were implemented. Discordance arose in instances where patients received a more conservative treatment than what was originally recommended. The estimated 3-year survival after recurrence (SAR) rate was significantly different between patients who received curative versus palliative treatment (84.8% vs. 37.6%, P < 0.001).Conclusions We observed a high concordance between MDT decisions and final implementation in patients with pulmonary rences after total mesorectal excision of rectal cancer. Considerable pulmonary recurrence can be treated with a curative intent, and good outcomes can be achieved through the MDT model used at PKUCH. Patients' participation and social support may contribute to the development of a new MDT model and lay the foundation for enhancing medical quality management.
-
国际癌症研究机构(IRAC)发布的Globocan2018数据显示,目前结直肠癌位居全球恶性肿瘤发病和死亡的第3位和第2位[1],年死亡例数仅次于肺癌,是构成全球疾病负担最主要的恶性肿瘤之一。虽然卫生行政部门常规将结、直肠癌进行统一监测和干预,但结肠癌和直肠癌在发病分布、诊疗、进展和转归等方面存在一定差异。在中国,直肠癌占全部结直肠癌发病构成比高于欧美国家和地区(50% vs.30%)[2-3],而直肠癌较结肠癌更易发生肺转移[4],因此直肠癌肺转移的诊疗是中国结直肠癌临床实践中不容忽视的问题。
胸部CT的广泛应用及外科手术、靶向治疗、精准放疗和介入治疗等学科快速发展,为直肠癌肺转移的发现和治疗带来更多机会,但其复杂性和异质性较大,因此治疗过程有赖于多学科协作制定方案,并开展全程综合治疗。
自2002年起,北京大学肿瘤医院在全院推动肿瘤多学科协作组(multidisciplinary team,MDT)治疗模式,并将其纳入医院质量管理,对促进诊治策略科学化和改善患者预后有着重要意义[5]。笔者对2007年7月至2015年2月在北京大学肿瘤医院接受新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)和全直肠系膜切除术(total mesorectal excision,TME)的中低位直肠癌患者术后肺转移的诊断情况、MDT模式下形成的推荐治疗决策和执行情况及患者预后进行回顾性分析,为加强医疗质量管理、优化MDT模式提供依据。
1. 材料与方法
1.1 病例资料
采用回顾性队列研究方法,收集2007年7月至2015年2月于北京大学肿瘤医院行nCRT+TME的5 123例中低位直肠癌患者资料。纳入标准(包含以下所有条件):1)在本院行直肠癌根治术,且术前接受调强放疗(intensity-modulated radiation therapy,IMRT)同步卡培他滨的nCRT,具体方案为GTV 50.6 Gy/CTV 41.8 Gy/22 f,同步口服卡培他滨(825 mg/m2,bid,d1~5/w);2)肿瘤下缘距离肛缘≤10 cm;3)术后病理证实为直肠腺癌;4)直肠癌术前胸部X线/CT、腹部B超/CT评估无远隔转移;4)术后随访监测中,通过CT或PET-CT诊断为肺转移;5)基线信息、原发灶诊疗信息、随访信息和发生肺转移后治疗方案等资料完整。排除标准(包含以下任一条件):1)过去5年内曾患其他恶性肿瘤;2)合并炎症性肠病、家族性腺瘤性息肉病或Lynch综合征。根据上述标准,共680例患者纳入研究。其中,术后随访中通过监测CT或PET-CT确诊为肺转移患者85例。
1.2 方法
1.2.1 各类型肺转移的定义[6]
同时性/异时性肺转移:前者定义为“在初始结直肠癌分期检查时发现的肺转移”,后者定义为“基线检查后发现的肺转移”。本研究纳入患者为术后发生肺转移,均为异时性肺转移。单纯性/非单纯性肺转移:前者定义为“不伴有肺外转移(无论是否存在原发灶/局部复发)”;后者定义为“伴有肺外转移(无论是否存在原发灶/局部复发)”。初发/非初发肺转移:前者定义为“肺作为首个远处转移器官,无论是否伴有其他远处转移”;后者定义为“在其他转移性疾病治疗过程中出现了肺转移”。单发肺转移/多发肺转移:前者定义为“肺部转移病灶为单个”;后者定义为“肺部转移病灶>1个或双肺转移”。
1.2.2 数据收集与随访
通过医院信息系统(Hospital Information System,HIS)检索并查阅患者电子病历,采集患者基本信息和诊疗信息,包括:性别、年龄、直肠癌原发灶部位、nCRT前临床分期、nCRT起止日期及方案、直肠原发灶的手术日期、手术方式、原发灶病理分期、病理类型、分化程度和术后治疗等。患者在直肠癌术后2年内每3个月进行1次随访,之后3年内每半年进行1次随访,随访信息主要通过门诊病案收集,未至门诊复查的患者将接受医院统一的年度电话随访,结合本研究专项电话访谈,收集直肠癌根治术后肺转移的诊疗、转归和生存结局等信息,包括:1)肺转移初始异常发现的途径和时间、确诊肺转移的检查项目和时间、肺转移灶数目(单发/多发)、是否合并肺外转移、肺转移与肺外转移的发生顺序、直肠原发灶手术切除至诊断肺转移的时间间隔即无病间隔(disease free interval,DFI)、发生肺转移后在MDT诊疗模式下形成的推荐治疗方案、实际治疗方案、未执行推荐方案的原因、是否行肺转移灶切除术及手术日期和手术方式;2)患者生存结局(生存/死亡)、从直肠癌术前nCRT开始至因任何原因导致患者死亡的时间间隔即总生存(overall survival,OS)、从直肠癌术前nCRT开始至因直肠癌进展而导致患者死亡的时间间隔即肿瘤特异生存(cancer specific survival,CSS)、从直肠癌术前nCRT开始至术后首次肿瘤复发/转移或因任何原因导致患者死亡的时间间隔即无病生存(disease free survival,DFS)、从直肠癌术后首次发生任意部位复发/转移至因直肠癌进展而导致患者死亡的时间间隔即复发/转移后生存(survival after recurrence,SAR)。
1.2.3 直肠癌肺转移MDT涉及的学科及治疗决策构成
学科包括:胃肠外科、消化内科、胸外科、胸内科、放疗科、介入科、医学影像科、中医科、康复(心理)科。决策包括:1)根治性局部治疗,如R0手术切除、立体定向放疗(stereotactic body radiotherapy,SBRT)、消融术;2)姑息性治疗,包括局部姑息性治疗(肺转移灶姑息手术等)、全身药物治疗(化疗/靶向)和对症支持治疗。
1.3 统计学分析
采用SPSS 22.0统计学软件进行分析。计数资料采用频数和百分比(%)表示,组间比较采用Fisher确切概率法;生存分析采用Kaplan-Meier法,组间比较采用Logrank检验。P < 0.05为差异具有统计学意义。
2. 结果
2.1 基本信息
研究收集680例中低位直肠癌患者信息,随访自2007年7月开始截至2019年7月,时间3.0~131.7个月,中位随访时间58.8个月,术后发生复发/转移的患者186例,其中肺转移85例。肺转移总发生率12.5%(85/680),在ypT0N0、ypT1~2N0、ypT3~4N0和ypN+患者中分别为2.4%(3/124)、7.5%(16/212)、20.0%(31/155)和18.5%(35/189),差异有统计学意义(P < 0.001)。85例肺转移包括男性54例(63.5%),女性31例(36.5%),年龄21~81岁,中位年龄58岁(表 1)。
表 1 85例nCRT+TME后肺转移的直肠癌患者临床资料
2.2 诊断信息
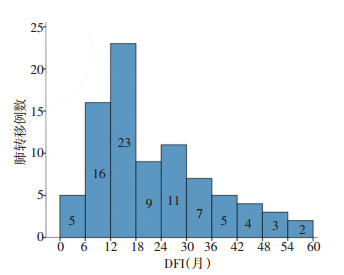
85例肺转移患者均为异时性肺转移,DFI为1.27~ 57.8个月,中位DFI为17.3个月;DFI在12~18个月频率最高(27.1%,23/85),其次是在6~12个月(18.8%,16/85),术后36个月内DFI累计频率达83.5%(71/85);单纯性单发肺转移仅占20.0%(17/85);初始发现途径为胸部CT的患者占68.2%(58/85)。见表 1,图 1。
2.3 治疗决策和执行
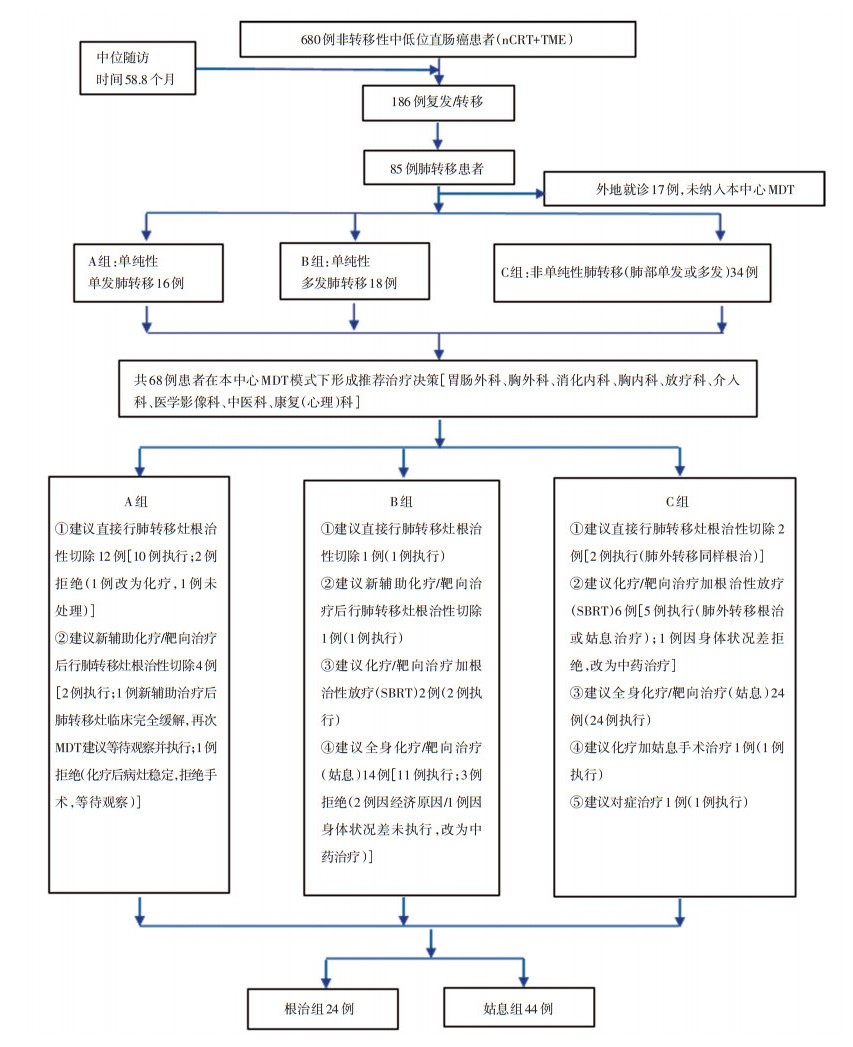
85例肺转移患者中,外院诊疗(随访方式为仅接受本中心电话随访)患者17例,余68例在本中心MDT模式下形成治疗决策,比例为80.0%(68/85)。根据肺转移灶数量和是否伴有肺外转移,将68例患者分为A、B、C三组,分别为单纯性单发肺转移16例、单纯性多发肺转移18例、非单纯性肺转移(肺部单发或多发)34例。筛选流程见图 2。
68项推荐治疗决策中,41.2%(28/68)为针对肺转移灶行根治性治疗,包括20例推荐行根治切除术和8例推荐行根治性放疗,其余58.8%(40/68)为推荐姑息治疗(包括对症处理)。实际执行时,35.3%(24/68)患者进行根治治疗,64.7%(44/68)进行姑息治疗。24例行局部根治的患者详情如下:1)直接行肺转移灶根治手术13例,包括单纯单发肺转移10例、左下肺多发肺转移不伴肺外转移1例,肝转移灶根治性切除后定期复诊发现单发肺转移灶1例,肝转移灶根治性切除后定期复诊发现右中、上叶多发肺转移灶1例;2)先接受新辅助化疗/靶向治疗再接受肺转移灶根治手术3例,包括单发肺转移2例和右肺上叶与左肺下叶多发肺转移1例;3)肺转移灶化疗后完全缓解的患者1例,为单纯性单发肺转移,MDT推荐治疗决策为化疗/靶向治疗后行肺转移灶根治手术,术前复查发现肺转移灶临床完全缓解,再次MDT建议等待观察;4)化疗/靶向治疗后加SBRT 7例,包括多发肺转移灶不伴有肺外转移2例、单发肺转移灶伴有肺外转移2例(1例为脑与肺转移同时发现,肺转移执行本项根治决策,脑转移同时行根治性放疗;1例为肺转移初发执行本项根治决策,后发现肝转移行根治性切除)和多发肺转移伴有肺外转移3例(2例为肺转移初发且执行本项根治决策,后发现骨转移采用姑息治疗;1例为肺转移发生前有右髂血管旁淋巴结转移,行姑息放疗加化疗/靶向治疗后疾病稳定,随后发生肺转移执行本项根治决策)(图 2)。
推荐决策的总执行率为89.7%(61/68),7例未执行者选择进一步保守治疗,原因为2例MDT建议直接行肺转移灶根治术的A组患者,因担心手术风险,1例改为化疗,另1例未做任何处理;1例MDT建议化疗后行肺转移灶切除手术的A组患者,化疗后病灶稳定但担心手术风险,自行等待观察。2例因经济原因、1例因身体状况差(均为B组),未接受推荐的全身姑息性化疗,均改为中药治疗。1例C组患者因身体状况差,未接受推荐的化疗加根治性放疗,改为中药治疗(图 2)。
2.4 MDT模式下直肠癌肺转移患者预后
2.4.1 不同肺转移类型患者预后
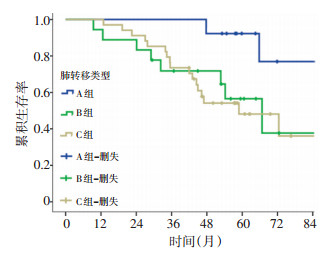
68例患者中,A组患者5年CSS(92.3%)高于B组(56.5%),差异有统计学意义(χ2=6.104,P=0.013),同时高于C组(48.1%),差异有统计学意义(χ2=5.918,P=0.015)。B、C两组相比差异无统计学意义(χ2=0.000,P=0.992)。见图 3。
2.4.2 不同根治程度的肺转移患者预后
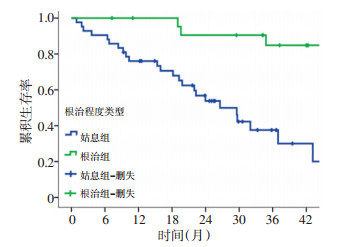
根据实际治疗情况,根治组3年SAR(84.8%)高于姑息组(37.6%),差异有统计学意义(χ2=15.721,P < 0.001)。见图 4。
3. 讨论
直肠癌肺转移进展缓慢[7],其诊断普遍推荐采用高分辨率胸部CT定期监测,不建议采用胸片和MRI[8-9]。《中国结直肠癌诊疗规范(2017版)》中关于术后随访在2015版、2010版基础上删除“定期复查胸片”,PET-CT和病理学检查不作为常规推荐[10-12]。本研究中肺转移发生高峰在术后6~18个月,术后半年内发生率较低,这也为完善直肠癌术后复查程序提供了方向。本研究对象均为术前接受相同方案的nCRT+TME的非转移性中低位直肠癌患者,结果具有一定代表性。
美国国立综合癌症网络(NCCN)和欧洲临床肿瘤协会(ESMO)的结直肠癌临床实践指南、中国结直肠癌诊疗规范中均强调MDT的重要作用[8-13]。直肠癌肺转移异质性大,MDT有助于形成最佳治疗决策,避免单学科诊疗的片面性。本中心直肠癌术后肺转移患者大多仍返回本院就诊且在MDT模式下形成治疗决策,执行率近90%,未执行者倾向选择更保守的治疗,该情况与Blazeby等[14]的研究类似。目前,虽然最新的中国结直肠癌诊疗规范(2017版)和结直肠癌肺转移治疗共识(2018版)对可切除肺转移的手术治疗持积极态度[6, 10],但治疗决策的执行还涉及治疗费用、疗效与患者的经济、身体状况之间的取舍,以及医疗资源可及性、医保政策等因素。未来,建设专业的患者管理团队(如个案管理师或研究护士等)以追踪患者诊疗全程和收集质控数据,并关注患者治疗意愿(积极或保守的决策倾向)、纳入社会支持力量(心理咨询、医患协调、医保咨询、救助机构等)以提高患者治疗依从性,将成为各大医学中心在该领域开展MDT的新内容。
关于MDT对改善患者预后的效果评估,有研究显示,引入MDT诊疗模式可提高结直肠癌患者(尤其是进展期)的5年CSS,该模式下患者死亡风险降为非MDT模式下的65%[15]。一项纳入25 766例结直肠癌患者的队列研究显示,MDT可改善结直肠癌患者生存(HR=0.91),在晚期结直肠癌中更为明显(HR= 0.88)[16]。基于患者伦理和临床实际情况,本研究未涉及非MDT组,患者依据日常诊疗程序均被纳入MDT模式。从患者预后来看,直肠癌术后肺转移为多发灶或伴有肺外转移者生存均较差,此为疾病特征不同造成的差别,但在另一个角度,本中心MDT模式下有1/3患者仍有机会获得积极根治(无论肺转移灶为单发/多发,是否伴有肺外转移)且预后较好。分析原因,在于MDT模式有助于科学、高效、全面地形成积极的治疗决策并开展全程质控,这可能是该领域MDT发挥效用的机制所在。临床需特别注意,若MDT制度的缺乏或不完善可能会造成晚期患者难以第一时间获得根治决策,或因科室间协作失调造成根治决策难以落实,以致于不得不面临姑息治疗的选择。
本研究局限性在于纳入了一部分术前仅采用胸部X线除外肺转移的历史病例,或基线CT显示肺部小结节未定性但术后CT监测得以确诊的患者(即基线分期Mx),可能会造成一定程度的结果偏倚;此外,本研究主要关注肺转移发生后的阶段性MDT决策而非自直肠原发灶初诊至生命结局的全程决策,也是本研究的不足之处。
综上所述,本研究展现了在恶性肿瘤成为常见慢性病的社会背景下,医患双方对于治疗策略的协商过程和实践场景。激进或保守的抉择,风险与受益的考量,均是肿瘤MDT实践中的重要话题,也是“生物-心理-社会”模式在肿瘤诊疗、医患协调、医疗质量管理领域发挥作用的着力点。未来还需引入卫生经济学研究设计并开展相关高证据等级的前瞻性研究以评价该领域MDT模式的综合效果。积极倡导“指南推荐、医生协作、患者参与、社会支持”的全新MDT模式,将可能成为改善患者预后、提高医疗质量管理水平的重要手段和必经之路。
-
表 1 85例nCRT+TME后肺转移的直肠癌患者临床资料

-
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. http://cn.bing.com/academic/profile?id=72ddb2c2747f7f6244ee8ffc4ce98b19&encoded=0&v=paper_preview&mkt=zh-cn
[2] 张玥, 石菊芳, 黄慧瑶, 等.中国人群结直肠癌疾病负担分析[J].中华流行病学杂志, 2015, 36(7):709-714. http://d.old.wanfangdata.com.cn/Periodical/zhlxbx201507010 [3] Siegel RL, Miller KD, Fedewa SA, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(3):177-193. http://d.old.wanfangdata.com.cn/Periodical/zhlxbx201701012
[4] Mitry E, Guiu B, Cosconea S, et al. Epidemiology, management and prognosis of colorectal cancer with lung metastases:a 30-year population-based study[J]. Gut, 2010, 59(10):1383-1388. DOI: 10.1136-gut.2010.211557/
[5] 邢沫, 王凤玲, 王丹.我院建立肿瘤多学科诊疗模式的探讨[J].中国医院管理, 2015, 35(6):29-31. http://d.old.wanfangdata.com.cn/Periodical/zgyygl201506011 [6] 中国医师协会外科医师分会多学科综合治疗专业委员会, 中国抗癌协会大肠癌专业委员会.结直肠癌肺转移多学科综合治疗专家共识(2018版)[J].中国肿瘤临床, 2019, 46(2):51-63. http://journal11.magtechjournal.com/Jwk_zgzllc/CN/abstract/abstract14071.shtml [7] Prasanna T, Karapetis CS, Roder D, et al. The survival outcome of patients with metastatic colorectal cancer based on the site of metastases and the impact of molecular markers and site of primary cancer on metastatic pattern[J]. Acta Oncol, 2018, 57(11):1438-1444. http://cn.bing.com/academic/profile?id=ef4d8796eb2d7d43000a106b7ab6df44&encoded=0&v=paper_preview&mkt=zh-cn
[8] Glynne-Jones R, Wyrwicz L, Tiret E, et al. Rectal cancer:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2017, 28(suppl_4):22-40.
[9] Benson AB, Venook AP, Al-Hawary MM, et al. Rectal cancer, version 2.2018, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2018, 16(7):874-901. https://www.researchgate.net/publication/326388340_Rectal_Cancer_Version_22018_NCCN_Clinical_Practice_Guidelines_in_Oncology
[10] 中华人民共和国卫生和计划生育委员会医政医管局, 中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2017年版)[J].中华外科杂志, 2018, 56(4):241-258. http://d.old.wanfangdata.com.cn/Periodical/zhwk201804001 [11] 国家卫生计生委医政医管局, 中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2015版)[J].中华胃肠外科杂志, 2015, 18(10):961-973. http://d.old.wanfangdata.com.cn/Periodical/zhwk201804001 [12] 卫生部医政司制定, 卫生部办公厅印发.结直肠癌诊疗规范(2010年版)[J].中华外科杂志, 2011, 49(2):97-104. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhwk201102001 [13] Van Cutsem E, Cervantes A, Nordlinger B, et al. Metastatic colorectal cancer:ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2014, 25(suppl 3):1-9. http://cn.bing.com/academic/profile?id=a31f1846627198ad077e17cb36748dbf&encoded=0&v=paper_preview&mkt=zh-cn
[14] Blazeby JM, Wilson L, Metcalfe C, et al. Analysis of clinical decisionmaking in multi-disciplinary cancer teams[J]. Ann Oncol, 2006, 17(3):457-460. https://www.ncbi.nlm.nih.gov/pubmed/16322114
[15] Munro A, Brown M, Niblock P, et al. Do Multidisciplinary Team (MDT) processes influence survival in patients with colorectal cancer? A population-based experience[J]. BMC cancer, 2015, 15:686. http://cn.bing.com/academic/profile?id=52e669bbb5c73e5ab0edd284f6ebfc35&encoded=0&v=paper_preview&mkt=zh-cn
[16] Hsu YH, Kung PT, Wang ST, et al. Improved patient survivals with colorectal cancer under multidisciplinary team care:A nationwide cohort study of 25, 766 patients in Taiwan[J]. Health policy, 2016, 120(6):674-681. http://cn.bing.com/academic/profile?id=4bcc26756169050d6e74656a040446e4&encoded=0&v=paper_preview&mkt=zh-cn
-
期刊类型引用(4)
1. 李国锋. 新辅助化疗联合腹腔镜下直肠癌根治术治疗直肠癌患者的疗效观察. 临床普外科电子杂志. 2023(01): 49-52 .  百度学术
百度学术
2. 哈肖别克·卡斯木,季学闻,吐尔逊江·托乎地外力,白磊,李涛. 血清CEA、CRP、IL-6对中晚期直肠癌新辅助放化疗治疗反应的预测价值. 疑难病杂志. 2023(07): 691-696 .  百度学术
百度学术
3. 巴雅尔,张美云,高辉,吕艺华,闫志虹. 新辅助放化疗在直肠癌患者中的应用效果分析. 基层医学论坛. 2021(01): 57-59 .  百度学术
百度学术
4. 顾芳慧,仲西瑶,孙光宇,王剑英,管九苹,薛冬. 整合医学模式在肿瘤专科医院管理中的应用实践. 中国医院管理. 2021(04): 91-93 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: