Expression and significance of lactate dehydrogenase A in different grades of gastroenteropancreatic neuroendocrine tumors
-
摘要:目的 探讨乳酸脱氢酶A(lactate dehydrogenase A,LDHA)在不同病理分级的胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine tumors,GEP-NETs)患者组织中的表达及临床病理特征。方法 收集青岛大学附属医院2013年1月至2018年12月经内镜及手术切除的112例GEP-NETs患者的临床资料。根据肿瘤Ki-67增殖指数及核分裂像数分为G1级43例、G2级17例、G3级52例。通过免疫组织化学方法检测不同分级GEP-NETs组织中LDHA表达情况,并分析LDHA表达水平与患者临床病理特征、经典神经内分泌标志物、血清乳酸脱氢酶(lactate dehydrogenase,LDH)及生存预后的关系。采用χ2检验进行统计分析,Kaplan-Meier曲线进行生存分析,Log-rank检验进行生存分析组间比较。结果 不同病理分级GEP-NETs组织中的LDHA表达水平差异具有统计学意义(P < 0.001),且分级越高,阳性表达率越高,G1、G2及G3级阳性表达率分别为48.8%、70.6%和86.5%。临床病理特征分析显示,LDHA在GEP-NETs中的表达与性别、肿瘤大小、TNM分期、浸润深度及淋巴结转移相关(均P < 0.05)。KaplanMeier生存分析及Log-rank检验结果显示LDHA高表达患者生存率较低表达组差异具有统计学意义(P=0.005)。结论 LDHA表达水平在不同分级GEP-NETs患者存在差异,LDHA高表达提示患者预后不良。Abstract:Objective To investigate the expression and clinicopathological significance of lactate dehydrogenase A (LDHA) in different grades of gastroenteropancreatic neuroendocrine tumors (GEP-NETs).Methods Totally, 112 patients with GEP-NETs, who underwent endoscopic and surgical resection from January 2013 to December 2018, were recruited at the Affiliated Hospital of Qingdao University. The patients were designated as grade 1 (G1, n=43), grade 2 (G2, n=17), grade 3 (G3, n=52) according to Ki-67 index and mitotic rate. LDHA expression in the different grades of GEP-NET tissue was determined by immunohistochemistry. The correlation between LDHA expression in GEP-NET tissue and clinicopathological characteristics, in addition to survival time, was analyzed. The data were also analyzed for correlations between LDHA expression and both serum LDH and classic neuroendocrine markers. All analyses were performed using the Chi-squared test and Kaplan-Meier survival curves. The log-rank test was used for comparison of survival between groups.Results LDHA expression levels in GEP-NET tissues were different for the three grades (P < 0.001), and there was a positive correlation between grade and expression level. The positive expression rate of G1 was 48.8%, that of G2 was 70.6%, and of G3 was 86.5%. Clinicopathological analysis showed that LDHA expression in GEP-NETs was correlated with gender, tumor size, TNM staging, infiltration depth, and lymph node metastasis (all P < 0.05). Kaplan-Meier survival curves and the log-rank test showed that the survival rate in patients with high LDHA expression was significantly lower than that in the low- expression group (P=0.005).Conclusions LDHA expression level is different in GEP-NET patients with different grades, and increased expression level indicates poor patient prognosis.
-
Keywords:
- neuroendocrine tumors /
- lactate dehydrogenase A /
- invasion /
- metastasis /
- prognosis
-
胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine tumors, GEP-NETs)是一组罕见的高度异质性肿瘤, 发病率为3.56/100 000, 占神经内分泌肿瘤的70%, 目前在消化道肿瘤中居第2位[1-2]。由于肿瘤的异质性和非特异性临床表现, 多于体检过程中偶然发现。尽管其发病率升高, 但其相关临床及分子机制的研究尚不足。
乳酸脱氢酶A(lactate dehydrogenase A, LDHA)是糖酵解的关键酶之一, 可促进丙酮酸生成乳酸。研究发现, LDHA在乳腺癌、胰腺癌、膀胱癌等多种肿瘤组织中表达水平上调[3-5]。此外, 沉默或抑制LDHA可抑制肿瘤生长和转移[6-7]。上述研究提示LDHA在肿瘤发生发展中发挥重要作用。目前对LDHA与GEP-NETs关系的研究及生存预后的影响尚且不足。
本研究通过免疫组织化学方法检测112例不同分级GEP-NETs组织中的LDHA表达差异, 通过分析临床病例资料及患者预后随访信息, 探讨LDHA表达在GEP-NETs临床诊治中的意义。
1. 材料与方法
1.1 病例资料
选取青岛大学附属医院2013年1月至2018年12月经内镜及手术切除的GEP-NETs病例112例, 纳入患者经病理确诊, 术前未接受放疗、化疗及激素治疗且临床病理资料完整。其中男性76例, 女性36例; 年龄≤ 60岁为46例, >60岁为66例; 胃部肿瘤66例, 肠27例, 胰腺19例。按照2019年世界卫生组织(WHO)消化系统肿瘤分类方案[8], 根据其Ki-67增殖指数及核分裂像分级, G1级为43例, G2级为17例, G3级为52例。本研究通过青岛大学附属医院伦理委员会审核批准, 并获得患者及家属知情同意。
1.2 方法
1.2.1 免疫组织化学法
将符合纳入标准的石蜡包埋组织切片为4 μm, 采用PV-6000法行免疫组织化学检测LDHA蛋白表达。二甲苯脱蜡, 梯度酒精溶液复水, 抗原修复, 阻断内源性过氧化物酶, 滴加一抗, 以1:300稀释, 37℃恒温孵育1 h, 缓冲液冲洗, 二抗反应, 再次缓冲液冲洗, DAB显色, 苏木素复染, 切片脱水, 中性树胶封片, 显微镜下判读。LDHA兔抗人单克隆抗体购自美国Cell Signaling Technology (CST)公司; 一抗稀释液、二氨基联苯胺(diaminobenzidine, DAB)浓缩试剂盒等均购自北京中杉金桥生物有限公司。
1.2.2 免疫组织化学结果判读
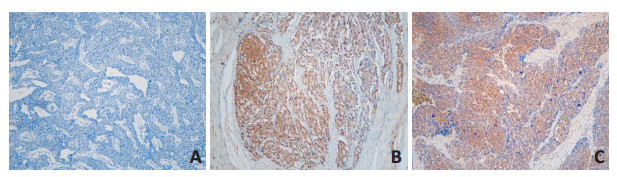
LDHA为浆阳性表达, 胞浆内出现黄至棕黄色颗粒为染色阳性表现。以阳性细胞百分率×染色强度进行评分。以缓冲液替代一抗为阴性对照。细胞阳性百分率评分:无阳性细胞数为0分, 阳性细胞数 < 10%为1分, 10%~ 50%为2分, 51%~80%为3分, >80%为4分; 染色强度评分:细胞未染色为0分, 轻度染色为1分, 中度染色为2分, 强染色为3分; 计算得分, 0~3分为低表达, >3分为高表达。最终乘积得分范围为0~12分, < 4为低表达, ≥ 4为高表达。每张切片随机选择10个高倍镜视野, 分别由两名病理科医师对进行独立阅片评分, 取平均值, 结果有差异者重新评分。
1.2.3 随访
通过门诊及电话对患者进行随访, 随访时间截至2019年5月, 生存时间为手术当日至末次随访时间或患者死亡日期。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。正态分布的计量资料以

2. 结果
2.1 GEP-NETs组织中的LDHA表达
LDHA呈胞浆表达, 染色呈棕黄色或棕褐色(图 1)。在112例患者组织中, 32例呈低表达, 80例呈高表达, 表达阳性率为71.43% (80/112)。其中, G1级阳性表达率为48.8% (21/43), G2级为70.6% (12/17), G3级86.5%(47/52)。LDHA在G1~G3级GEP-NETs中的表达差异具有统计学意义(χ2=19.915, P < 0.05)。
2.2 LDHA表达与GEP-NETs患者的临床病理特征的关系
GEP-NETs男性患者的LDHA表达情况与女性患者之间差异具有统计学意义(χ2=9.043, P=0.003);肿瘤最大直径≥ 3 cm的LDHA高表达水平较直径 < 3 cm者差异有统计学意义(χ2=5.164, P=0.023); LDHA高表达在浸润深度、TNM分期及淋巴结转移中的差异具有统计学意义(χ2=15.120、16.804、14.316, 均P < 0.001)。患者年龄、肿瘤位置、是否伴有远处转移与LDHA表达无相关性(均P>0.05)。此外, 组织中LDHA的表达与血清乳酸脱氢酶(lactate dehydroge- nase, LDH)表达量及经典神经内分泌标志物突触素(synaptophysin, Syn)、嗜铬粒蛋白A(chromogranin A, CgA)的表达无相关性(均P>0.05)(表 1)。
表 1 GEP-NETs组织LDHA表达与患者临床病理特征的关系
2.3 LDHA表达与GEP-NETs患者的生存分析
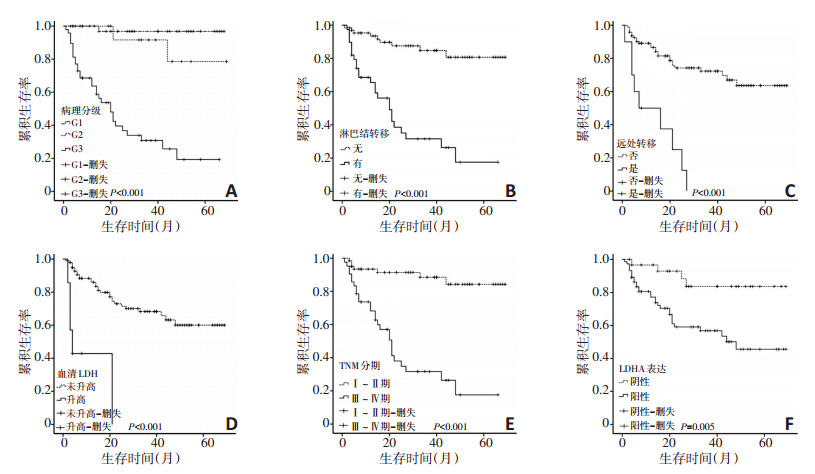
112例GEP-NETs患者随访时间为1~69个月, 中位随访时间为48个月。单因素生存分析显示, 病理分级、淋巴结转移、远处转移、血清LDH及TNM分期与较差的生存预后相关(均P < 0.001, 图 2)。将对单因素分析有意义的指标进行Cox回归分析, 结果显示肿瘤病理分级(P=0.001; HR=0.064, 95%CI:0.013~0.307)、远处转移(P=0.006; HR=0.326, 95%CI:0.146~0.729)及LDH (P < 0.001; HR=0.106, 95%CI:0.035~0.325)是提示患者预后差的独立预后因素(图 2A~E)。按照LDHA在组织中的表达情况分为高表达组和低表达组, 采用KaplanMeier法分析LDHA表达情况与患者生存率的差异(图 2F)。高表达LDHA患者生存结果较低表达LDHA患者差, Log-rank检验显示差异具有统计学意义(χ2=8.026, P=0.005)。
3. 讨论
GEP-NETs较腺癌患者相比, 生存期相对较长, 但生存质量不佳, 易发生转移, 常见转移部位为肝脏, 预后差[9]。目前针对GEP-NETs的发病机制及侵袭转移的研究较少。本研究根据增殖指数及核分裂像数对纳入GEP-NETs病例进行分类, 包括G1级和G2级神经内分泌瘤、G3级神经内分泌癌。由于混合性神经内分泌-非神经内分泌瘤(mixed neuroendo- crine-non-neuroendocrine neoplasm, MiNEN)构成成分的多样性和复杂性, 且同一肿瘤内的不同成分分级不同, 故将MiNEN病例排除。GEP-NETs病理分级与患者预后及治疗相关, 进一步探讨不同分级GEPNETs临床病理特征等相关内容, 对临床治疗发挥重要指导作用。
LDHA通过催化无氧糖酵解最后一步, 在调节糖酵解过程中发挥重要作用, 其表达上调有利于提高肿瘤细胞的无氧糖酵解效率, 降低肿瘤细胞对氧的依赖性。多项研究提示, LDHA在肿瘤组织中的表达较正常组织升高, 包括胆管癌、胃癌、大肠癌、乳腺癌等, 并提示预后不佳[10-13]。本研究通过免疫组织化学方法检测到不同分级的GEP-NETs中LDHA的表达差异。肿瘤分级越高, LDHA的表达阳性率也越高。提示LDHA表达或可与GEP-NETs增殖及肿瘤进展相关。通过进一步进行临床病理特征分析发现组织LDHA表达水平与患者性别、肿瘤大小、TNM分期、浸润深度及淋巴结转移相关, 其高表达提示患者生存结果较差。
血清LDH水平是结直肠癌、肺癌、前列腺癌等多种实体肿瘤的预后指标[14]。Koukourakis等[15]发现, 在71%的LDHA阳性表达大肠癌病例中, 血清LDH水平与组织LDHA水平无相关。虽然低LDHA在肿瘤特异性中的表达与低血清LDH水平相一致(< 450 U/L), 但在高LDHA水平表达中, 只有29%患者血清LDH>450 U/L。本研究中, 仅8例患者血清LDH升高, 其中, 血清LDH升高患者中组织LDHA高表达者占87.5%(7/8)。由于病例数相对较少, 且患者血清LDH的正常水平差异较大等原因, 可能会出现血清LDH升高而检测值处于正常范围的情况。Koukourakis等[16]认为血清LDH水平与肿瘤负荷相关, 而LDHA表达是在原发肿瘤中进行评估的, 故两者缺乏显著相关性。在本组病例的GEP-NETs中, 肿瘤直径≥ 3 cm组织LDHA高表达且伴血清LDH高表达者占75% (6/8)。Lamarca等[17]通过队列研究将LDH作为评估胃肠神经内分泌癌预后的因素之一, 提示其可预测总体生存期。这表明血清LDH和组织LDHA表达水平两者互补, 联合使用可能更好地表达肿瘤中LDH活性谱[16]。CgA和Syn是神经内分泌肿瘤病理诊断的必要指标, 本研究发现组织LDHA表达水平与经典神经内分泌标志物无相关性, 但或可作为补充检测指标, 为GEP-NETs生存预后提供预测价值。
多种肿瘤组织中LDHA高表达与肿瘤的侵袭、转移和预后不佳相关。本研究中, 伴淋巴结转移者组织LDHA表达较无转移者明显升高, 提示LDHA参与GEP-NETs患者淋巴结转移, 且提示预后不佳。LDHA可为细胞提供能量, 当LDHA在细胞中表达受到抑制时, 三磷酸腺苷产生减少, 细胞生长变缓。LDHA表达受抑, 会诱导活性氧产生, 引起线粒体损伤, 最终导致细胞凋亡。活性氧的累积还可导致线粒体原肌球蛋白结构改变, 进而导致肌动蛋白重构能力受损, 最终导致肿瘤转移受抑[18]。LDHA导致细胞乳酸分泌增加是其调控细胞侵袭及转移的另一重要机制。高浓度乳酸与肿瘤的早期远处转移相关, 乳酸通过改变细胞微环境、影响基质金属蛋白酶、组织蛋白酶、血管内皮生长因子及缺氧诱导因子-1α等发挥作用[19-20]。此外, 乳酸可通过调节肿瘤细胞微环境, 抑制免疫监测, 促进肿瘤的发生发展[21]。上皮间质转化也是LDHA促进肿瘤转移的基础之一。Zhao等[22]研究表明, LDHA通过促进肾细胞癌上皮-间质转化促进肿瘤转移, 且与E-钙黏蛋白表达呈负相关, 与N-钙黏蛋白呈正相关。本研究中, LDHA表达量与患者TNM分期及淋巴结转移相关, 可能提示LDHA参与神经内分泌肿瘤的转移。本研究同时发现, LDHA在不同分级GEP-NETs中的表达与患者生存期较低相关, 具体作用机制及其诊治价值有待进一步探究。
综上所述, LDHA在GEP-NETs组织中的表达与肿瘤分级相关, 分级越高, 其表达越高, 且其高表达预示患者预后不佳。此外, LDHA的表达与患者性别、肿瘤大小、TNM分期、浸润深度及淋巴结转移存在相关性。由于肿瘤的高度异质性, LDHA在GEP-NETs不同病理类型以及在侵袭及转移中的具体作用机制有待进一步研究。
-
表 1 GEP-NETs组织LDHA表达与患者临床病理特征的关系

-
[1] Dasari A, Shen C, Halperin D, et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States[J]. JAMA Oncol, 2017, 3(10):1335-1342. DOI: 10.1001/jamaoncol.2017.0589
[2] Yao J C, Hassan M, Phan A, et al. One hundred years after "carcinoid":epidemiology of and prognostic factors for neuroendocrine tumors in 35, 825 cases in the United States[J]. J Clin Oncol, 2008, 26(18):3063-72. DOI: 10.1200/JCO.2007.15.4377
[3] Huang X, Li X, Xie X, et al. High expressions of LDHA and AMPK as prognostic biomarkers for breast cancer[J]. Breast, 2016, 30:39-46. DOI: 10.1016/j.breast.2016.08.014
[4] Cui XG, Han ZT, He SH, et al. HIF1/2alpha mediates hypoxia-induced LDHA expression in human pancreatic cancer cells[J]. Oncotarget, 2017, 8(15):24840-24852. https://www.ncbi.nlm.nih.gov/pubmed/28193910
[5] Yuan D, Zheng S, Wang L, et al. MiR-200c inhibits bladder cancer progression by targeting lactate dehydrogenase A[J]. Oncotarget, 2017, 8(40):67663-67669. http://cn.bing.com/academic/profile?id=d6b8fe75f7b7ceb73b067b546c1fbc23&encoded=0&v=paper_preview&mkt=zh-cn
[6] Qiu H, Jackson AL, Kilgore JE, et al. JQ1 suppresses tumor growth through downregulating LDHA in ovarian cancer[J]. Oncotarget, 2015, 6(9):6915-30. http://cn.bing.com/academic/profile?id=4972ee20ebc75f860fb80ee54a456b01&encoded=0&v=paper_preview&mkt=zh-cn
[7] Yao F, Zhao T, Zhong C, et al. LDHA is necessary for the tumorigenicity of esophageal squamous cell carcinoma[J]. Tumour Biol, 2013, 34(1):25-31. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=f803bfd5fd1fd30cc0a18d2a9e89b19d
[8] Nagtegaal ID, Odze RD, Klimstra D, et al. The 2019 WHO classification of tumours of the digestive system[J]. Histopathology, 2020, 76(2):182-188. DOI: 10.1111/his.13975
[9] Zhang M, Zhao P, Shi X, et al. Clinicopathological features and prognosis of gastroenteropancreatic neuroendocrine neoplasms in a Chinese population:a large, retrospective single-centre study[J]. BMC Endocr Disord, 2017, 17(1):39. DOI: 10.1186/s12902-017-0190-6
[10] Yu Y, Liao M, Liu R, et al. Overexpression of lactate dehydrogenaseA in human intrahepatic cholangiocarcinoma:its implication for treatment[J]. World J Surg Oncol, 2014, 12:78. DOI: 10.1186/1477-7819-12-78
[11] Sun X, Sun Z, Zhu Z, et al. Expression of SIP1 is strongly correlated with LDHA and shows a significantly poor outcome in gastric cancer[J]. Tumour Biol, 2015, 36(10):7521-7530. DOI: 10.1007/s13277-015-3470-7
[12] Wang J, Wang H, Liu A, et al. Lactate dehydrogenase A negatively regulated by miRNAs promotes aerobic glycolysis and is increased in colorectal cancer[J]. Oncotarget, 2015, 6(23):19456-19468. http://cn.bing.com/academic/profile?id=72d7d247aad5dea4fd066ed5b504155e&encoded=0&v=paper_preview&mkt=zh-cn
[13] Li L, Kang L, Zhao W, et al. miR-30a-5p suppresses breast tumor growth and metastasis through inhibition of LDHA-mediated Warburg effect[J]. Cancer Lett, 2017, 400:89-98. DOI: 10.1016/j.canlet.2017.04.034
[14] Mishra D, Banerjee D. Lactate Dehydrogenases as Metabolic Links between Tumor and Stroma in the Tumor Microenvironment[J]. Cancers (Basel), 2019, 11(6):750. DOI: 10.3390/cancers11060750
[15] Koukourakis MI, Giatromanolaki A, Sivridis E, et al. Lactate dehydrogenase 5 expression in operable colorectal cancer:strong association with survival and activated vascular endothelial growth factor pathway——a report of the Tumour Angiogenesis Research Group[J]. J Clin Oncol, 2006, 24(26):4301-4308. DOI: 10.1200/JCO.2006.05.9501
[16] Koukourakis MI, Giatromanolaki A, Sivridis E, et al. Prognostic and predictive role of lactate dehydrogenase 5 expression in colorectal cancer patients treated with PTK787/ZK 222584(vatalanib) antiangiogenic therapy[J]. Clin Cancer Res, 2011, 17(14):4892-4900. DOI: 10.1158/1078-0432.CCR-10-2918
[17] Lamarca A, Walter T, Pavel M, et al. Design and validation of the giNEC score to prognosticate overall survival in patients with highgrade gastrointestinal neuroendocrine carcinomas[J]. J Natl Cancer Inst, 2017, 109(5):djw277. DOI: 10.1093/jnci/djw277
[18] Arseneault R, Chien A, Newington JT, et al. Attenuation of LDHA expression in cancer cells leads to redox-dependent alterations in cytoskeletal structure and cell migration[J]. Cancer Lett, 2013, 338(2):255-266. DOI: 10.1016/j.canlet.2013.03.034
[19] Marchiq I, Pouyssegur J. Hypoxia, cancer metabolism and the therapeutic benefit of targeting lactate/H(+) symporters[J]. J Mol Med (Berl), 2016, 94(2):155-171. DOI: 10.1007/s00109-015-1307-x
[20] San-Millan I, Brooks G A. Reexamining cancer metabolism:lactate production for carcinogenesis could be the purpose and explanation of the Warburg Effect[J]. Carcinogenesis, 2017, 38(2):119-133. http://cn.bing.com/academic/profile?id=2642c5ad80d80614e0ea9e6056949604&encoded=0&v=paper_preview&mkt=zh-cn
[21] O'Sullivan D, Sanin DE, Pearce EJ, et al. Metabolic interventions in the immune response to cancer[J]. Nat Rev Immunol, 2019, 19(5):324-335. DOI: 10.1038/s41577-019-0140-9
[22] Zhao J, Huang X, Xu Z, et al. LDHA promotes tumor metastasis by facilitating epithelialmesenchymal transition in renal cell carcinoma[J]. Mol Med Rep, 2017, 16(6):8335-8344. DOI: 10.3892/mmr.2017.7637
-
期刊类型引用(2)
1. 闫隔,赵娜,张营. 胃肠胰神经内分泌肿瘤中GSK-3β、LDHA表达及其与临床病理特征的关系. 河南医学研究. 2023(09): 1616-1619 .  百度学术
百度学术
2. 彭翠,贺惠琴,佘芹,成志,曾木兰,温穗文. 子痫前期并发胎儿生长受限的妊娠结局和危险因素分析. 中国计划生育和妇产科. 2022(01): 70-75 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: