Predictive value of postoperative lymph node status for adjuvant therapy in esophageal cancer patients after radical resection
-
摘要:目的 分析食管癌患者术后的淋巴结状态对术后辅助治疗方案选择的预测价值及与预后的关系。方法 分析2007年1月至2010年12月河北医科大学第四医院354例食管癌根治术后患者,对其淋巴结各相关参数与术后辅助治疗进行预后分析。单因素生存分析采用Kaplan-Meier法和Log-rank检验,多因素生存分析采用Cox回归模型。结果 全组患者1、3、5年生存率分别为84.46%、64.12%和54.06%,中位生存期为86.49个月。N0、N1、N2、N3期患者的5年生存率分别为93.13%、55.50%、19.80%和3.45%,不同N分期之间的差异具有统计学意义(χ2=225.161,P < 0.001)。通过ROC曲线获取阳性淋巴结数目与清扫总淋巴结数目的比值(LNR)为分组界值8.51%将其分为两组并进行生存分析,LNR≤8.51%组及LNR>8.51%组患者的5年生存率分别为81.63%和23.40%,两组之间的差异具有统计学意义(χ2=143.504,P < 0.001)。单因素预后分析显示术后T分期、N分期、LNR、阴性淋巴结数目与患者的生存预后均相关(均P < 0.05)。多因素预后分析显示术后N分期、LNR为生存预后的独立影响因素(均P < 0.05)。N2组及LNR>8.51%组接受术后辅助治疗的患者生存显著优于单纯手术组(χ2=12.609,P < 0.001;χ2=13.171,P < 0.001)。联合N分期及LNR进行分析,在LNR>8.51%组的N2期患者接受术后辅助治疗组生存显著优于单纯手术组(χ2=12.609,P < 0.001)。结论 LNR可以协同N分期更好地提示预后并指导食管癌根治术后患者辅助治疗的选择。对N2期同时伴有高LNR的患者应该积极选择术后辅助治疗。Abstract:Objective To analyze the predictive value of postoperative lymph node status for adjuvant therapy in esophageal cancer patients after radical resection.Methods The indexes related to postoperative lymph node of 354 patients with esophageal carcinoma, who underwent radical surgery during a period between January 2007 and December 2010, were retrospectively analyzed. Univariate analysis was performed by Log-rank test and multivariate analysis by a Cox regression model.Results The 1-, 3-and 5-year overall survival (OS) rates were 84.46%, 64.12% and 54.06%, respectively, and the median survival time was 86.49 months. The 5-year OS rate of N0, N1, N2 and N3 stage patients were 93.13%, 55.50%, 19.80% and 3.45%, respectively. And it is obviously different from each other in PN stage (χ2=225.161, P < 0.001). We used the cut-off value of LNR 8.51% which was obtained by ROC curve to divide the patients into two groups. The 5-year survival rates of the group with LNR ≤ 8.51% and the group with LNR>8.51% were 81.63% and 23.40%, respectively. There were significant differences between the two groups (χ2=143.504, P < 0.001). The results of univariate analysis showed that PT stage, PN stage, LNR and number of negative lymph nodes were significantly correlated with OS (all P < 0.05). Multivariate analysis showed that the PN stage and LNR were independent factors for OS (all P < 0.05). The patients in the PN2 and LNR >8.51% groups with adjuvant therapy showed a significantly better survival than those with surgery alone and without adjuvant therapy (χ2=12.609, P < 0.001; χ2=13.171, P < 0.001). The patients in the group with PN2 stage as well as LNR >8.51% who had undergone adjuvant therapy showed a significantly better survival than those with simple surgery and without adjuvant therapy (χ2=12.609, P < 0.001).Conclusions The combination of PN stage and LNR as a better factor for predicting the prognosis of patients with esophageal cancer after radical resection can predict the value of adjuvant therapy. The patients with PN2 stage and higher LNR should choose postoperative adjuvant therapy.
-
Keywords:
- esophageal cancer /
- surgery /
- lymph node status /
- adjuvant therapy /
- prognosis
-
食管癌是常见的消化系统恶性肿瘤之一, 包括中国在内的亚洲地区尤其高发。近期流行病学调查显示, 食管癌发病率和死亡率在全球恶性肿瘤中分别位居第七位和第六位[1]。手术切除目前仍是其主要治疗手段, 术后治疗失败的主要模式为区域性复发和(或)远处转移, 其中以区域性复发最为常见, 可达40%~60%[2-4]。因此, 术后辅助治疗对特定食管癌术后人群非常重要[4-6], 但术后辅助治疗方案的选择尚存争议。有研究报道术后淋巴结状态作为预后独立因素, 可以指导术后辅助治疗的选择[7-8]。本研究分析食管鳞癌术后患者的淋巴结状态对术后辅助治疗方案选择的预测价值及与预后的关系, 评估目前淋巴结分期标准的有效性, 为临床治疗方案的制定提供参考。
1. 材料与方法
1.1 病例资料
入组标准:1)首程治疗为在河北医科大学第四医院行根治性切除术(R0术); 2)术后病理类型为鳞状细胞癌且切缘阴性; 3)手术清扫淋巴结数目≥ 12枚; 4)术前未接受新辅助化疗、放疗或放化疗; 5)接受术后放疗均为三维适形调强放疗技术且完成放疗; 6)术后接受化疗者周期数均≥ 2个周期。
1.2 方法
2007年1月至2010年12月共354例患者符合入组标准。其中男性220例、女性134例, 中位年龄60 (40~78)岁。见表 1。
表 1 患者一般临床病理资料及单因素预后分析
1.2.1 手术治疗
食管胸中下段癌绝大多数采用左胸入路经典的胸腹两野淋巴结清扫及食管癌切除、主动脉弓上或主动脉弓下吻合术; 胸上段或少数胸中段癌采用右胸入路两野或三野淋巴结清扫及食管癌切除、主动脉弓上或颈部吻合术。手术医师按照2009年美国癌症联合委员会(AJCC)第7版食管癌分期报告标注清扫淋巴结部位及数量于标本袋并送检病理科。病理科医师检查核对所有送检标本, 通过读取病理切片来明确并记录原发肿瘤浸润深度、淋巴结数目及转移状况。淋巴结计数标准:病理医师显微镜下观察到完整淋巴结结构或存在生发中心则计数为1枚淋巴结。全组患者中左侧开胸250例, 右侧开胸82例, 颈+右胸+上腹22例; 颈部吻合31例, 弓上吻合296例, 弓下吻合27例。共切除淋巴结5 648枚, 中位淋巴结数15(12~32)枚, 阳性淋巴结791枚, 淋巴结转移率14.00%。入组患者阳性淋巴结数与清扫总淋巴结数比值(LNR)范围0~66.67%, 中位数8.33%。
1.2.2 放疗方案
术后辅助放疗于术后1个月后开始实行。患者经热塑体膜固定体位, 于CT模拟机下扫描定位, 所得图像传输进入治疗计划系统(ADAC Pinnacle3 8.0 m, Philips Medical Systems, USA)。临床靶体积(clinical target volume, CTV)包括原瘤床区及相应淋巴引流区(依据美国胸科协会对胸部淋巴结的分组进行淋巴结引流区的勾画)。胸上段癌淋巴结引流区包括双侧锁骨上、2区、食管旁、4区、5区、7区及8区, 下界为气管隆突下2~3 cm; 胸中段癌淋巴结引流区包括2区、食管旁、4区、5区、7区、8区及9区, 下界为贲门旁淋巴结区; 胸下段癌引流区包括食管旁、4区、5区、7区、8区、9区、贲门旁、胃左及腹腔干淋巴结区。勾画靶区定义为CTV, 在CTV基础上前后左右方向各外放0.3~ 0.5 cm, 上下方向各外放0.5~1.0 cm为计划靶体积((planning tumor volume, PTV), 要求95%PTV接受剂量为48~54 Gy, 1.8~2.0 Gy/次, 5次/周。正常组织剂量限制:双肺V5 ≤ 55%~60%、V20 ≤ 28%~30%、V30 ≤ 18%~20%, 脊髓 < 45Gy, 心脏Dmean < 30 Gy、V30 < 40%、V40 < 30%。
1.2.3 术后化疗
LFP方案(亚叶酸钙200 mg/d d1~5+替加氟1 g/d, d1~5+顺铂20 mg/d, d1~5), 或TP方案(紫杉醇135 mg/m2, d1+顺铂75 mg/m2, d1)。术后中位化疗周期为4个周期, 范围2~6个周期。
1.2.4 术后放化疗
术后放化疗均采用序贯放化疗, 即术后先行放疗, 放疗结束后再进行化疗。放疗方案同1.3中所述方案, 化疗方案同1.4中所述方案。
1.3 随访
患者术后或者末次辅助治疗后, 每3个月复查胸腹部CT和食管造影, 2年后改为每6个月复查1次; 复发的诊断主要依据胸腹CT, 其次是食管造影、头颅MRI、全身骨扫描等检查。随访期内出现局部复发和(或)远处转移, 定义为疾病进展。随访以电话随访及门诊复查为主。本研究病例随访截至2016年5月, 失访9例, 失访率为2.54%。
1.4 统计学分析
采用SPSS 13.0软件进行统计学分析。LNR的分组界值通过绘制ROC曲线获取最佳Cut-off值, 单因素生存分析采用Kaplan-Meier法和Log-rank检验, 多因素生存分析采用Cox回归模型。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 患者生存分析
354例患者随访截至2016年5月, 失访9例, 死亡172例。死亡患者中死于远处转移者59例, 局部复发者78例, 远转同时局部复发者27例, 死于食管癌以外疾病者6例, 死因不明者2例。全组患者1、3、5年生存率分别为84.46%、64.12%和54.06%, 中位生存期为86.49个月。
2.2 术后不同淋巴结状态的生存分析
2.2.1 不同N分期生存预后分析
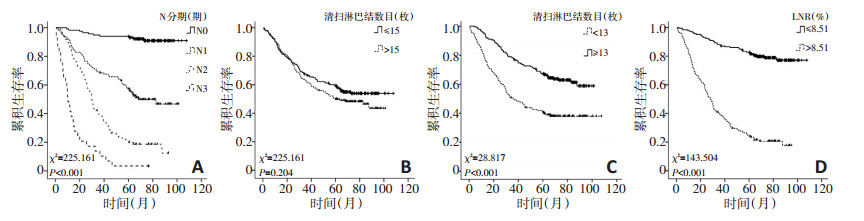
N0期患者的1、3、5年生存率分别为98.29%、94.02%和93.13%, 中位生存期为106.00个月。N1期患者的1、3、5年生存率分别为85.59%、68.46%和55.50%, 中位生存期为69.66个月; N2期患者的1、3、5年生存率分别为80.41%、39.14%和19.80%, 中位生存期为29.88个月; N3期患者的1、3、5年生存率分别为37.93%、10.34%和3.45%, 中位生存期为10.50个月。对N分期行生存分析, 差异具有统计学意义(χ2=225.161, P < 0.001), 见图 1A。
2.2.2 清扫淋巴结数目与预后的关系
清扫淋巴结数目≤ 15枚组患者的1、3、5年生存率分别为83.77%、66.48%和57.89%, 中位生存期为106个月; 清扫淋巴结数目> 15枚组患者的1、3、5年生存率分别为85.28%、61.35%和49.59%, 中位生存期为60.75个月。生存分析两组之间差异无统计学意义(χ2=1.613, P=0.204), 见图 1B。
2.2.3 阴性淋巴结数与预后关系
阴性淋巴结数目 < 13枚组患者的1、3、5年生存率分别为75.61%、49.38%和39.36%, 中位生存期为36个月; 阴性淋巴结数目≥ 13枚组患者的1、3、5年生存率分别为92.11%、76.84%和66.73%, 中位生存期为100个月; 生存分析中, 两组之间比较差异具有统计学意义(χ2= 28.817, P < 0.001), 见图 1C。
2.2.4 阳性淋巴结数目与清扫总淋巴结数目的比值
与预后的关系 通过绘制阳性淋巴结数目与清扫总淋结数目的比值(LNR)的ROC曲线, 获得其最佳分组界值为8.51%, LNR ≤ 8.51%组患者的1、3、5年生存率分别为96.24%、87.09%和81.63%, 中位生存期为106个月; LNR>8.51%组患者的1、3、5年生存率分别为71.43%、38.67%和23.40%, 中位生存期为28.44个月。生存分析后, 两组之间具有统计学意义(χ2= 143.504, P < 0.001), 见图 1D。
2.3 术后生存时间的影响因素预后分析
将临床、病理因素与术后淋巴结相关因素纳入单因素分析, 显示术后T分期、N分期、LNR、阴性淋巴结数与患者的生存预后均相关(χ2=13.392, P=0.004;χ2= 225.161, P < 0.001;χ2=143.504, P < 0.001;χ2=28.817, P < 0.001), 见表 1。将上述单因素分析有统计学意义的指标纳入多因素分析, 最终术后N分期、LNR为影响生存预后的独立危险因素。(χ2=43.488, P < 0.001;χ2=3.860, P=0.049), 见表 2。
表 2 食管癌术后患者总生存预后的Cox多因素分析
2.4 淋巴结状态与术后辅助治疗的关系及预后分析
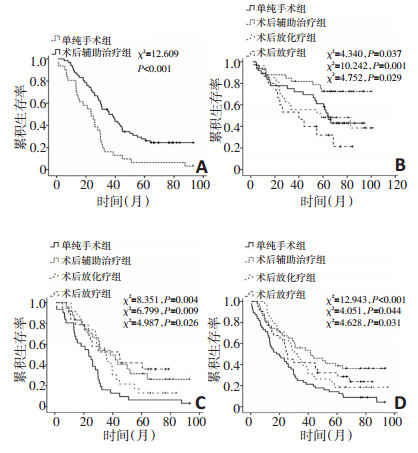
按照是否接受术后辅助治疗, 对N分期进行亚组分析。N2组接受术后辅助治疗的患者生存显著优于单纯手术者(χ2=12.609, P < 0.001), 见图 2A; N0、N1组及N3组患者生存分析差异无统计学意义(χ2=0.773, P=0.379; χ2=0.341, P=0.559;χ2=0.638, P=0.424)。进一步分析不同的术后辅助治疗方案与预后的关系。N1组患者组间两两比较显示, 术后化疗组预后优于单纯手术组、术后放疗组及术后放化疗组(χ2=4.340, P=0.037;χ2=10.242, P=0.001;χ2=4.752, P=0.029), 剩余组间比较差异无统计学意义, 见图 2B。N2组患者组间两两比较显示, 术后化疗组、术后放疗组及术后放化疗组预后均优于单纯手术组(χ2=8.351, P=0.004;χ2=6.799, P=0.009;χ2=4.987, P=0.026), 组间比较差异无统计学意义, 见图 2C。N3组患者组间两两比较差异无统计学意义。
按照是否接受术后辅助治疗对LNR进行亚组分析, LNR ≤ 8.51%组患者生存分析差异无统计学意义(χ2=1.058, P=0.304)。LNR>8.51%组患者生存分析差异具有统计学意义(χ2=13.171, P < 0.001), 组间两两比较显示, 术后化疗组、术后放疗组及术后放化疗组预后均优于单纯手术组(χ2=12.943, P < 0.001;χ2= 4.051, P=0.044;χ2=4.628, P=0.031), 组间比较差异均无统计学意义, 见图 2D。
按照是否接受术后辅助治疗联合N分期及LNR进行分析, 在LNR ≤ 8.51%组(本组无N2、N3期患者), N0期、N1期两组患者间进行生存分析, 差异均无统计学意义(χ2=0.773, P=0.379;χ2=0.054, P=0.816)。在LNR>8.51%组(本组无N0期患者), N1、N3期两组患者间进行生存分析, 差异均无统计学意义(χ2= 2.137, P=0.144;χ2=0.638, P=0.424)。其中, N1期患者接受术后辅助治疗组较单纯手术组可见生存获益趋势, 平均生存期分别为(57.36±6.92)个月和(42.26± 8.06)个月。N2期患者接受术后辅助治疗组生存显著优于单纯手术组(χ2=12.609, P < 0.001)。
3. 讨论
目前在食管癌治疗中, 大部分患者即使采取包括手术的多学科综合治疗, 仍不能获得满意的预后。因此, 有效且准确的分期系统对于评估预后及指导临床治疗尤为重要。淋巴结状态在TNM分期系统中至关重要, 食管癌第7版UICC/AJCC分期系统重新改进了以阳性淋巴结数目进行分类的N分期, 并建议至少清扫12枚及以上淋巴结来获得准确分期[9]。但是, 单纯依靠阳性淋巴结数目进行的N分期可能因清扫淋巴结数目不足而出现分期偏倚, 导致病情评估不足, 由此提出了LNR指标。
相关研究已报道证实了LNR在恶性肿瘤中作为预后指标的预测价值[10-13]。Li等[14]报道298例食管鳞癌术根治后患者的淋巴结状态与预后关系, 入组患者清扫淋巴结数目均≥ 15枚, 以LNR中位数4.17%为界值分组。研究发现, N分期、清扫淋巴结总数、LNR均与预后显著相关, 为预后的独立影响因素。其中, 较高LNR组患者的预后较差。Zhang等[15]入组387例接受食管鳞癌根治术的患者, 通过X-title软件获得LNR的分组界值0和25%, 将LNR分3组为0、1%~ 25%、26%~100%。统计分析发现, N分期及LNR与预后显著相关, 且高LNR为预后不良因素。Tan等[16]通过分析1988年至2008年接受食管癌三野根治术的700例患者淋巴结状态与预后关系, 根据四分位数及生存率相似原则, 将全组患者LNR分4组为0、1%~20%、21%~40%和>40%。统计分析发现, N分期、清扫淋巴结数目、LNR均与预后相关, 其中较高LNR为预后的独立危险因素。本研究结果同样显示, 较晚的N分期、较高的LNR为影响预后的独立危险因素。因此, LNR作为阳性淋巴结数目与清扫总淋巴结数目的比值, 反映了阳性淋巴结的转移程度, 更具全面性及稳定性, 可作为N分期的有效补充, 共同提示预后。
食管癌术后辅助化、放疗可以通过消灭术后亚临床病灶以降低局部复发及远处转移而改善患者的长期生存。Qin等[17]研究认为, 术后化疗可延长N1期食管癌手术患者的无病生存期。齐战等[18]通过分析329例接受食管癌根治术患者发现, 术后化疗可改善N2期患者的生存预后。同样有研究结果[4, 19]显示, 术后放疗可改善术后淋巴结阳性食管癌患者的局部控制及长期生存。本研究将食管癌术后阳性淋巴结患者进一步分层分析, 结果显示, N1期患者术后接受辅助化疗组患者的生存预后优于其他各组患者; N2期患者术后接受辅助治疗的各组患者其生存预后均优于单纯手术组患者, 而N3期患者术后接受辅助治疗组与单纯手术组的差异无统计学意义。LNR较高患者接受术后辅助放、化疗可以改善食管癌患者的生存预后。联合N分期及LNR指标分析发现, 具有较高水平LNR的N2患者可以从术后辅助治疗中生存获益。同本研究的结果相似, Li等[14]分析发现, 高LNR同时清扫淋巴结数目较少的患者可以从术后辅助治疗中生存获益。因此, 基于本研究对于N2期同时伴有高LNR的患者应积极选择术后辅助治疗, 可能术后化疗为N1期患者的更佳选择。N0期患者可定期复查随访, 而对于N3期的患者要综合考虑后慎重选择术后辅助治疗。
总之, LNR可以协助N分期更好地提示预后并指导术后辅助治疗的选择。对于N2期同时伴有高LNR的患者, 应积极选择术后辅助治疗。基于本研究为单中心回顾性分析, 相关结论还亟需前瞻性研究的证实。
-
表 1 患者一般临床病理资料及单因素预后分析

表 2 食管癌术后患者总生存预后的Cox多因素分析

-
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. http://cn.bing.com/academic/profile?id=72ddb2c2747f7f6244ee8ffc4ce98b19&encoded=0&v=paper_preview&mkt=zh-cn
[2] Li CL, Zhang Fl, Wang YD, et al. Characteristics of recurrence after radical esophagectomy with two-field lymph node dissection for thoracic esophageal cancer[J]. Oncol Lett, 2013, 5(1):355-359. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=51e1803e290a8ac6b2d80c85f7344ffe
[3] Smit JK, Pultrum BB, van Dullemen HM, et al. Prognostic factors and patterns of recurrence in esophageal cancer assert arguments for extended two-field transthoracic esophagectomy[J]. Am J Surg, 2010, 200(4):446-453. DOI: 10.1016-j.amjsurg.2009.12.006/
[4] 宋春洋, 李腾, 赵彦, 等.ⅡB-Ⅲ期食管癌根治术后预防性放疗疗效分析[J].肿瘤防治研究, 2018, 45(6):404-409. http://d.old.wanfangdata.com.cn/Periodical/zlfzyj201806012 [5] Ohashi S, Miyamoto S, Kikuchi O, et al. Recent advances from basic and clinical studies of esophageal squamous cell carcinoma[J]. Gastroenterol, 2015, 149(7):1700-1715. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fb2d2a832ab868c32327e94b2a1a8c7c
[6] Schreiber D, Rineer J, Dan Vongtama, et al. Impact of postoperative radiation after esophagectomy for esophageal cancer[J]. J Thorac Oncol, 2010, 5(2):244-250. DOI: 10.1097-JTO.0b013e3181c5e34f/
[7] Guo X, Mao T, Gu ZT, et al. Clinical study on postoperative recurrence in patients with pN1 esophageal squamous cell carcinoma[J]. Thorac Cancer, 2015, 6(2):146-150. http://cn.bing.com/academic/profile?id=d920913930400780ef26feeba8cf4149&encoded=0&v=paper_preview&mkt=zh-cn
[8] Qin RQ, Wen YS, Wang WP, et al. The role of postoperative adjuvant chemotherapy for lymph node-positive esophageal squamous cell carcinoma:a propensity score-matching analysis[J]. Med Oncol, 2016, 33(4):31. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=10.1177/0272989X04274093
[9] Edge SB, Compton CC. The american joint committee on cancer:the 7th edition of the ajcc cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6):1471-1474. DOI: 10.1245-s10434-010-0985-4/
[10] Kwon TS, Choi SB, Lee YS, et al. Novel methods of lymph node evaluation for predicting the prognosis of colorectal cancer patients with inadequate lymph node harvest[J]. Cancer Res Treat, 2016, 48(1):216-224. http://cn.bing.com/academic/profile?id=c9d6681e4c610bf3fbdf3fd086defed8&encoded=0&v=paper_preview&mkt=zh-cn
[11] Liao GS, Chou YC, Golshan M, et al. Prognostic value of the lymph node ratio in breast cancer subtypes[J]. Am J Surg, 2015, 210(4):749-754. http://d.old.wanfangdata.com.cn/Periodical/zgjjssxzz201901001
[12] Sun GY, Xue L, Wang MD, et al. Lymph node ratio is a prognostic factor for non-small cell lung cancer[J]. Oncotarget, 2015, 6(32):33912-33918. http://cn.bing.com/academic/profile?id=e1a91a8740c3bbb36bc9451ab8547233&encoded=0&v=paper_preview&mkt=zh-cn
[13] Birnbaum DJ, Viganò L, Russolillo N, et al. Lymph node metastases in patients undergoing surgery for a gallbladder cancer. Extension of the lymph node dissection and prognostic value of the lymph node ratio[J]. Ann Surg Oncol, 2015, 22(3):811-818. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=edaa6176954e4314f5b01f2923db5e30
[14] Li YD, Zhao WX, Ni JJ, et al. Predicting the value of adjuvant therapy in esophageal squamous cell carcinoma by combining the total number of examined lymph nodes with the positive lymph node ratio[J]. Ann Surg Oncol, 2019, 26(8):2367-2374. http://cn.bing.com/academic/profile?id=12b1c203aec4a9c53904fb75075c5557&encoded=0&v=paper_preview&mkt=zh-cn
[15] Zhang HD, Liang HG, Gao YY, et al. Metastatic lymph node ratio demonstrates better prognostic stratification than pN staging in patients with esophageal squamous cell carcinoma after esophagec-tomy[J]. Sci Rep, 2016, 6(1):38804. https://www.researchgate.net/publication/311769094_Metastatic_lymph_node_ratio_demonstrates_better_prognostic_stratification_than_pN_staging_in_patients_with_esophageal_squamous_cell_carcinoma_after_esophagectomy
[16] Tan ZH, Ma GW, Yang HX, et al. Can lymph node ratio replace pN categories in the tumor-node-metastasis classification system for esophageal cancer[J]? J Thorac Oncol, 2014, 9(8):1214-1221. http://cn.bing.com/academic/profile?id=143025a27684318f73b442418859b22e&encoded=0&v=paper_preview&mkt=zh-cn
[17] Qin RQ, Wen YS, Wang WP, et al. The role of postoperative adjuvant chemotherapy for lymph node-positive esophageal squamous cell carcinoma:a propensity score matching analysis[J]. Med Oncol, 2016, 33(4):31. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=10.1177/0272989X04274093
[18] 齐战, 王玉祥, 杨琼, 等.食管鳞癌术后病理淋巴结阳性患者的预后及其术后化疗的作用[J].中华肿瘤杂志, 2017, 39(8):628-634. http://d.old.wanfangdata.com.cn/Periodical/zhzl201708014 [19] Zhang WC, Liu X, Xiao ZF, et al. Postoperative intensity-modulated radiotherapy improved survival in lymph node-positive or stage Ⅲ thoracic esophageal squamous cell carcinoma[J]. Oncol Res Treat, 2015, 38(3):97-102. http://pubmed.cn/25792080
-
期刊类型引用(5)
1. 余育贤,张龙泉,朱明阳,李晓林. 三维适形和调强放射治疗在食管癌术后患者辅助治疗中的应用效果. 医疗装备. 2023(04): 90-93 .  百度学术
百度学术
2. 傅博,吴建语,沈佳鹏,阮必顺,许锦慧,龙泉先,何玉凤,彭志刚. IMRT、sIMRT及3DCRT在胸中段食管癌放疗中的应用比较. 中国医学物理学杂志. 2022(10): 1208-1212 .  百度学术
百度学术
3. 田涛,杨俊省. 血清NSE、CA-50、proGRP在食管癌术后淋巴结转移中的水平变化及联合检测价值. 国际检验医学杂志. 2022(24): 2977-2981+2986 .  百度学术
百度学术
4. 陈婷婷,谢汝慧. 基于4C模式的延续性护理在食管癌根治术后患者中的应用. 中国医药导报. 2021(17): 169-172 .  百度学术
百度学术
5. 邱晓莉,朱龑,刘清梅. 胸段食管鳞癌患者预后影响的多因素Cox回归分析. 中外医学研究. 2021(25): 61-64 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载: