Factors influencing the efficacy of neoadjuvant chemoradiotherapy on rectal adenocarcinoma and the effect of pathologic complete response on prognosis
-
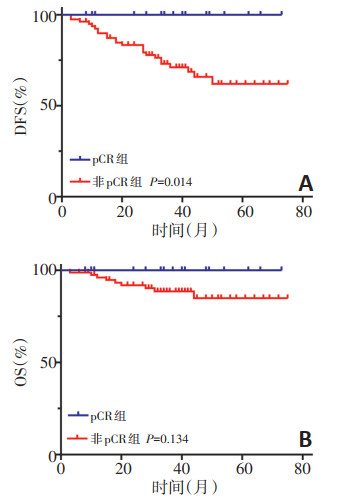
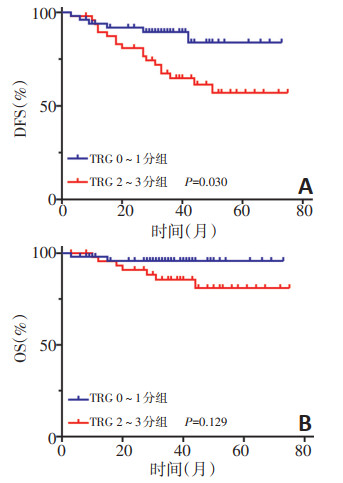
摘要:目的 探讨直肠腺癌新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT)后病理完全缓解(pathologic complete response,pCR)的影响因素及pCR对生存的影响。方法 回顾性分析2014年1月至2017年12月郑州大学附属肿瘤医院收治的98例直肠腺癌NCRT患者的临床病理资料,分析临床病理特征与pCR的关系以及pCR对预后的影响。结果 98例患者NCRT后19例(19.4%)获得pCR。单因素分析显示,术前淋巴结转移情况、治疗前CEA水平、肿瘤大小、肿瘤侵犯肠壁周径程度以及KRAS基因状态与直肠腺癌NCRT后pCR相关。Logistic回归多因素分析显示,治疗前CEA≤5 μg/L(OR=4.095,95%CI:1.131~14.823,P=0.032)和肿瘤侵犯肠壁周径(≤1/2)(OR=3.268,95%CI:1.015~10.527,P=0.047)是影响直肠腺癌NCRT后pCR的独立因素。生存分析显示非pCR患者的3年无病生存率(disease-free survival,DFS)为71.1%,显著低于pCR患者100%(P < 0.05);两者3年总生存率(overall survival,OS)分别为100%和88.5%,差异无统计学意义(P>0.05)。结论 治疗前检测CEA以及评估肿瘤侵犯肠壁周径程度有助于预测直肠腺癌NCRT后pCR率,提示两者可作为新辅助放化疗疗效的评价指标,并指导临床进行个体化治疗。与pCR患者相比,非pCR直肠癌患者DFS较短。Abstract:Objective To investigate the factors influencing the achievement of pathologic complete response (pCR) after neoadjuvant chemoradiotherapy (NCRT) for rectal adenocarcinoma and to investigate the effect of pCR on survival outcome.Methods A total of 98 patients with rectal adenocarcinoma who underwent NCRT combined with curative resection between January 2014 and December 2017 at The Affiliated Cancer Hospital of Zhengzhou University & Henan Cancer Hospital were retrospectively enrolled. The correlations of clinicopathological features with pCR were evaluated, and the influence of pCR on prognosis was analyzed.Results :Of the 98 patients, 19 (19.4%) achieved pCR after NCRT. Univariate analysis showed that preoperative lymph node status, pre-chemoradiotherapy carcinoembryonic antigen (CEA) levels, tumor size, invasion of the circumference of intestinal wall, and KRAS mutation status were significant influencing factors. Logistic regression revealed that pre-chemoradiotherapy CEA levels (≤5 μg/L) [odds ratio (OR)=4.095, 95% confidence interval (CI): 1.131-14.823, P=0.032] and invasion of the circumference of intestinal wall (≤1/2) (OR=3.268, 95% CI: 1.015-10.527, P=0.047) were independent factors influencing the achievement of pCR after NCRT for rectal cancer. Univariate survival analysis showed that the 3-year disease-free survival (DFS) rate in the non-pCR group was 71.1%, which was significantly lower than that in the pCR group (100.0%, P < 0.05). There was no significant difference in the 3- year overall survival rate between the pCR (100.0%) and non-pCR (88.5%) groups (P>0.05).Conclusions Pre-treatment CEA levels and invasion of the circumference of intestinal wall are helpful in predicting the achievement of pCR. It is suggested that both can be used as indicators for evaluating tumor response after radical resection and neoadjuvant therapy. Therefore, the evaluation of these factors will be helpful in guiding individualized treatment. The DFS rate in the non-pCR group was worse than that in the pCR group.
-
结直肠癌(colorectal cancer,CRC)是消化道常见的恶性肿瘤,其中直肠癌约占所有CRC的30%[1]。与西方国家相比,中国直肠癌比例更高,占半数以上[2]。以5-氟尿嘧啶(5-FU)或卡培他滨为基础的术前放化疗联合全直肠系膜切除术(total mesorectal ex⁃ cision,TME)是局部进展期直肠癌(locally advanced rectal cancer,LARC)患者的标准治疗方法[3]。与单纯手术相比,新辅助放化疗(neoadjuvant chemoradiother⁃ apy,NCRT)可显著降低局部复发率,增加根治性手术的可能性[4]。有研究显示,患者对NCRT的治疗反应不一致,从病理完全缓解(pathologic complete re⁃ sponse,pCR)到完全耐药不等[5-6]。目前,临床工作中仍缺乏足够的证据来预测直肠癌对新辅助治疗的耐药性。本研究旨在探讨临床生物学指标与NCRT疗效的关系以及pCR对预后的影响,以期为该类患者个体化治疗提供依据。
1. 材料与方法
1.1 病例资料
回顾性分析2014年1月至2017年12月于郑州大学附属肿瘤医院收治的115例LARC患者的临床病理资料,其中失访10例,7例临床病理资料不完整,最终98例纳入本研究。根据第8版美国癌症联合委员会(AJCC)标准[7]进行TNM分期,所有患者新辅助治疗前均行胸部CT、全腹部CT以及直肠MRI。纳入标准:1)术前肠镜检查经病理确诊为直肠腺癌;2)经直肠MRI或胸腹部CT或超声内镜等检查证实,治疗前临床分期为进展期直肠癌(T3、T4期或N1~2);3)肿瘤下缘距肛缘10 cm以下;4)无放化疗和手术禁忌证;5)临床病理及随访资料完整。排除标准:1)复发性直肠癌;2)术前有远处转移;3)合并其他肿瘤既往史。
1.2 方法
1.2.1 治疗方法
新辅助化疗方案:1)XELOX:卡培他滨1 000 mg/m2,口服,2次/d,d1~14;奥沙利铂130 mg/m2,持续静脉滴注2 h,d1、22。每21天为1个周期。2)FOLFOX:奥沙利铂85 mg/m2,持续静脉滴注2 h,d1;亚叶酸钙400 mg/m2,持续静脉滴注2 h,d1;5-FU 400 mg/m2,静脉推注,d1,随后以2 400 mg/m2持续静脉滴48 h,d1、2。14 d为1个周期。化疗期间同步放疗。
放疗方案:利用调强放射治疗技术(intensitymodulated radiation therapy,IMRT)对直肠瘤床、亚临床病灶及盆腔区域淋巴引流区给予放疗,总剂量40~50 Gy,2.0 Gy/次,分20~25次完成。所有患者均按计划完成新辅助治疗,NCRT后6~8周内按TME标准进行手术。
根据术后病理情况以及患者意愿决定是否行辅助化疗,其中化疗以氟尿嘧啶类药物为基础的方案,包括FOLFOX、XELOX或卡培他滨单药。
1.2.2 肿瘤消退评价
采用改良Ryan“0~3级”评分法[8]对肿瘤消退程度(TRG)评分:0分:肿瘤完全消退,标本中无可见的癌细胞;1分:明显消退,仅可见单个癌细胞,伴有明显组织纤维变性;2分:部分反应,尚有残留肿瘤;3分:肿瘤组织反应差或者无反应,几乎无肿瘤退缩。TRG 0~1分:肿瘤反应良好,TRG 2~3分:肿瘤反应不佳。pCR的定义是直肠癌NCRT后手术切除的肿瘤标本和淋巴结在显微镜下肿瘤细胞完全消失(ypT0N0)。
1.2.3 DNA检测方法
术前活检组织或术后离体标本用4%甲醛溶液固定、石蜡包埋、切片及H&E染色,选取富于肿瘤细胞的区域,保证肿瘤成分在80%以上。使用DNA提取试剂盒(德国QIAGEN公司),通过DNA纯化,提取石蜡切片中肿瘤组织基因组DNA,聚合酶链反应和焦磷酸测序检测KRAS基因第12、13和61密码子,NRAS基因第12、13、59和61密码子及BRAF基因第468、596和600密码子突变,然后利用ABI PRISM 3730DNA分析仪(美国应用生物系统公司)直接测序,测定KRAS、NRAS及BRAF突变状态。
1.2.4 随访
定期复查和电话随访。复查内容包括体格检查、生化指标、胸片及腹部彩超,当怀疑有活动性肿瘤,行CT或MRI检查。以手术日起为随访开始时间,每3个月进行1次随访,随访截止日期为2020年4月,中位随访时间为36(3~75)个月。无病生存时间(disease-free survival,DFS)按从手术日开始至疾病首次复发的时间进行计算。总生存时间(overall survival,OS)定义为手术至患者死亡或随访截止的时间。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析,GraphPad 8.0.2软件绘制生存曲线。分类变量比较采用χ2检验,采用二元Logistic回归分析影响pCR的独立危险因素。Spearman等级相关分析变量共线性。单因素生存分析采用Kaplan-Meier法,组间比较应用Logrank检验。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 临床病理、基因突变及肿瘤消退特点
98例患者中男性62例、女性36例,中位年龄55(23~ 81)岁;腺癌77例,黏液腺癌21例;高中分化60例,低分化38例;肿瘤距肛缘中位距离5.0(3.0~10.0)cm。术前分期(cTNM):Ⅱa期30例,Ⅱb期19例,Ⅱc期12例,Ⅲb期26例,Ⅲc期11例。KRAS和BRAF基因突变率分别是33.7%(33/98)、6.1%(6/98)。NCRT后,19例患者获得pCR,pCR率为19.4%。其中TRG 0分19例,TRG 1分31例,TRG 2分38例,TRG 3分10例,肿瘤消退良好者(TRG 0~1分)和反应不佳者(TRG 2~3分)分别占51.0%和49.0%。
2.2 临床病理学指标与pCR之间的关系
单因素分析显示,术前淋巴结转移情况、治疗前CEA水平、肿瘤大小、肿瘤侵犯肠壁周径程度、KRAS基因状态与直肠腺癌NCRT后pCR率高低有关(均P < 0.05,表 1)。选择NCRT后pCR作为因变量,将单因素分析有意义的cN分期、治疗前CEA(μg/L)、肿瘤大小(cm)、肿瘤侵犯肠壁周径和KRAS基因状态指标为自变量,多因素二元Logistic回归分析显示,治疗前CEA≤5 μg/L以及肿瘤侵犯肠壁周径(≤1/2)是影响直肠腺癌NCRT后pCR的独立因素(均P < 0.05,表 2)。
表 1 临床病理特征与术前放化疗后pCR的相关性 表 2 LARC患者术前放化疗后病理完全缓解的Logistic回归多因素分析
表 2 LARC患者术前放化疗后病理完全缓解的Logistic回归多因素分析
2.3 生存分析
截至随访结束共复发24例,其中局部复发8例、远处转移16例,包括肝转移12例、肺转移3例、骨与腹膜同时转移1例;死亡9例。98例LARC患者3年DFS为76.2%,3年OS为90.7%。pCR组的3年DFS(100%)显著高于非pCR组(71.1%),两组患者无病生存比较差异具有统计学意义(P < 0.05,图 1A)。pCR组的3年OS(100%)高于非pCR组(88.5%),两组患者累积生存比较差异无统计学意义(P>0.05,图 1B)。
98例患者中,肿瘤反应良好(TRG 0~1分)组和肿瘤反应不佳(TRG 2~3分)组3年DFS分别为89.5%和64.8%,两组患者无病生存比较差异具有统计学意义(P < 0.05,图 2A);两组3年OS分别为95.8%和85.5%,差异无统计学意义(P>0.05,图 2B)。
3. 讨论
术前放化疗是LARC患者的标准治疗方法,目的是降低分期,缩小肿瘤体积,提高保肛率,改善患者生存质量[9]。行NCRT后达到pCR的患者比例不高,大部分患者仅获得部分退缩。对于获得pCR的患者,可减少局部复发率及远处转移率,提高生存率[10]。目前,对LARC行NCRT疗效预测的报道较少,且结论尚未达成统一,因此探索并寻找能够准确预测NCRT疗效的指标以优化个体治疗,具有重要的临床指导意义。
血清癌胚抗原(CEA)是一种糖蛋白、具有不同糖基化作用的主要肿瘤标志物,在直肠癌诊断、监测治疗反应、预后等方面有着重要的临床价值[11]。最近有多项研究针对血清CEA水平与肿瘤退缩程度和pCR关系的进行预测。Kim等[12]回顾分析117例直肠癌患者发现,治疗前血清CEA水平和组织CEA/GAP⁃ DH比值与肿瘤退缩程度相关,CEA能作为肿瘤对放化疗反应的独立预测因子。Bozkaya等[13]研究结果表明,新辅助治疗前CEA水平升高(>5 μg/L)的直肠癌患者获得pCR率较低。此外,Yang等[14]分析了531例接受术前放化疗的直肠癌患者发现,放化疗前CEA降低与较高的pCR率有明显的相关性,且进一步分层分析显示低CEA(≤5 μg/L)与非吸烟患者病理缓解程度密切相关,而与有吸烟患者无关。本研究回顾了98例LARC患者NCRT前血清CEA的水平以及放化疗后肿瘤病理缓解程度,并分析了pCR与治疗前CEA水平的相关性,结果显示pCR组患者的CEA水平明显低于非pCR组。多因素分析发现,新辅助治疗前CEA水平>5 μg/L是影响直肠癌pCR的独立危险因素,提示CEA升高可能反应了肿瘤对NCRT敏感性较差。CEA水平高低与NCRT后肿瘤耐药性的相关机制尚未确定,可以从以下几个方面进行解释:1)CEA通过M2巨噬细胞刺激GADD45G mRNA表达,而GADD45G是与抗辐射反应密切相关的DNA损伤反应基因[15]。2)有研究表明[16-17],5-FU可诱导癌胚抗原在肿瘤细胞系中过表达,癌胚抗原的过度表达通过阻碍caspase-8介导的细胞凋亡,从而降低癌细胞对化疗药物的敏感性。临床上,血清CEA动态检测较容易实现,进一步明确新辅助治疗前后血清CEA的水平变化情况与直肠癌放化疗反应相关性,具有重要现实意义。
本研究多因素分析显示,肿瘤侵犯肠壁周径(≤1/2)是直肠癌高pCR率的独立影响因素,肿瘤侵犯肠壁周径程度越低,新辅助治疗后出现pCR的可能性越大。Das等[18]对562例直肠癌患者的临床资料进行分析发现,肿瘤侵犯肠壁周径与pCR率和肿瘤降期率显著相关,且肿瘤侵犯肠壁周径范围>50%是低pCR率的独立预测因素。以上结果均表明,肿瘤侵犯肠壁周径程度与肿瘤负荷呈正相关,比例越小,越容易从NCRT中获益。
术前新辅助治疗可显著降低局部复发率并且减轻药物带来的不良反应。本研究显示pCR率为19.4%,与既往报道范围相一致[13, 19]。与有肿瘤残存的患者相比,术后获得pCR的患者OS以及DFS显著延长[20]。本研究结果显示,98例LARC患者的3年DFS和OS分别为76.2%和90.7%,与文献报道一致[21]。Wasmuth等[22]通过分析147例NCRT后获得pCR的LARC的研究发现,与未获得pCR的患者相比,其OS明显提高,可达87%,局部复发和远处转移率均显著降低。本研究中位随访时间为36个月,Log-rank检验显示pCR组和非pCR组患者、肿瘤反应良好(TRG 0~1分)组和肿瘤反应不佳(TRG 2~ 3分)组3年DFS存在显著性差异,而与3年OS无关。
综上所述,NCRT前血清CEA水平和肿瘤侵犯肠壁周径程度是直肠腺癌NCRT后pCR的重要预测指标,可作为预测直肠癌NCRT疗效的标志物。pCR与直肠癌患者高DFS有关,是影响预后的因素之一。本研究也存在一定局限性,如样本量少、随访时间有限以及单中心的回顾性研究,更确切的关系需要前瞻性、多中心、大样本研究来进一步验证。
-
表 1 临床病理特征与术前放化疗后pCR的相关性

表 2 LARC患者术前放化疗后病理完全缓解的Logistic回归多因素分析

-
[1] Yang J, Lin Y, Huang Y, et al. Genome landscapes of rectal cancer before and after preoperative chemoradiotherapy[J]. Theranostics, 2019, 9(23):6856-6866. DOI: 10.7150/thno.37794
[2] 陈万青, 李贺, 孙可欣, 等.2014年中国恶性肿瘤发病和死亡分析[J].中华肿瘤杂志, 2018, 40(1):5-13. http://med.wanfangdata.com.cn/Paper/Detail?dbid=WF_QK&id=PeriodicalPaper_zhzl201801002 [3] Douglas JK, Callahan RE, Hothem ZA, et al. Genomic variation as a marker of response to neoadjuvant therapy in locally advanced rectal cancer[J]. Mol Cell Oncol, 2020, 7(3):1716618. DOI: 10.1080/23723556.2020.1716618
[4] Machackova T, Prochazka V, Kala Z, et al. Translational potential of micrornas for preoperative staging and prediction of chemoradiotherapy response in rectal cancer[J]. Cancers (Basel), 2019, 11(10): 1545. DOI: 10.3390/cancers11101545
[5] Kamran SC, Lennerz JK, Reardon B, et al. Genomic evolution and acquired resistance to pre-operative chemoradiation therapy in locally advanced rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2017, 99 (2):22-23. http://www.sciencedirect.com/science/article/pii/S036030161731115X
[6] Dayde D, Tanaka I, Jain R, et al. Predictive and prognostic molecular biomarkers for response to neoadjuvant chemoradiation in rectal cancer[J]. Int J Mol Sci, 2017, 18(3):573. DOI: 10.3390/ijms18030573
[7] Weiser MR. AJCC 8th edition: Colorectal cancer[J]. Ann Surg Oncol, 2018, 25(6):1454-1455. DOI: 10.1245/s10434-018-6462-1
[8] Ryan R, Gibbons D, Hyland JM, et al. Pathological response following long- course neoadjuvant chemoradiotherapy for locally advanced rectal cancer[J]. Histopathology, 2005, 47(2):141-146. DOI: 10.1111/j.1365-2559.2005.02176.x
[9] Shinto E, Omata J, Sikina A, et al. Predictive immunohistochemical features for tumour response to chemoradiotherapy in rectal cancer[J]. BJS Open, 2020, 4(2):301-309. DOI: 10.1002/bjs5.50251
[10] Wan T, Zhang XF, Liang C, et al. The prognostic value of a pathologic complete response after neoadjuvant therapy for digestive cancer: systematic review and meta-analysis of 21 studies[J]. Ann Surg Oncol, 2019, 26(5):1412-1420. DOI: 10.1245/s10434-018-07147-0
[11] Ibáñez-Pérez R, Guerrero-Ochoa P, Al-Wasaby S, et al. Anti-tumoral potential of a human granulysin-based, CEA-targeted cytolytic immunotoxin[J]. Oncoimmunology, 2019, 8(11):1641392. DOI: 10.1080/2162402X.2019.1641392
[12] Kim CH, Huh JW, Yeom SS, et al. Predictive value of serum and tissue carcinoembryonic antigens for radiologic response and oncologic outcome of rectal cancer[J]. Pathol Res Pract, 2020, 216(3): 152834. DOI: 10.1016/j.prp.2020.152834
[13] Bozkaya Y, Özdemir NY, Erdem GU, et al. Clinical predictive factors associated with pathologic complete response in locally advanced rectal cancer[J]. J Oncol Sci, 2018, 4(1):5. DOI: 10.1016/j.jons.2017.12.004
[14] Yang J, Ling X, Tang W, et al. Analyses of predictive factors for pathological complete remission in neoadjuvant therapy for locally ad-vanced rectal cancer[J]. J BUON, 2019, 24(1):77-83. http://www.ncbi.nlm.nih.gov/pubmed/30941954
[15] Huang EY, Chang JC, Chen HH, et al. Carcinoembryonic antigen as a marker of radioresistance in colorectal cancer: a potential role of macrophages[J]. BMC Cancer, 2018, 18(1):321. DOI: 10.1186/s12885-018-4254-4
[16] Eftekhar E, Naghibalhossaini F. Carcinoembryonic antigen expression level as a predictive factor for response to 5- fluorouracil in colorectal cancer[J]. Mol Biol Rep, 2014, 41(1):459-466. DOI: 10.1007/s11033-013-2880-0
[17] Lee JH, Lee SW. Enhancement of chemosensitivity in 5-fluorouracilresistant colon cancer cells with carcinoembryonic antigen-specific RNA aptamer[J]. Mol Biol Rep, 2019, 46(4):3835-3842. DOI: 10.1007/s11033-019-04826-3
[18] Das P, Skibber JM, Rodriguez-Bigas MA, et al. Predictors of tumor response and downstaging in patients who receive preoperative chemoradiation for rectal cancer[J]. Cancer, 2007, 109(9):1750-1755. DOI: 10.1002/cncr.22625
[19] 邹伟静, 邹敏, 吴峥, 等.肿瘤体积对局部进展期直肠癌预后的影响[J].中国肿瘤临床, 2020, 47(12):626-632. DOI: 10.3969/j.issn.1000-8179.2020.12.491 [20] Polanco PM, Mokdad Ali A, Hong Z, et al. Association of adjuvant chemotherapy with overall survival in patients with rectal cancer and pathologic complete response following neoadjuvant chemotherapy and resection[J]. JAMA Oncol, 2018, 4(7):938-943. http://www.ncbi.nlm.nih.gov/pubmed/29710272
[21] Armstrong D, Raissouni S, Price Hiller J, et al. Predictors of pathologic complete response after neoadjuvant treatment for rectal cancer: a multicenter study[J]. Clin Colorectal Cancer, 2015, 14(4):291- 295. http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_PM26433487
[22] Wasmuth HH, Rekstad LC, Tranø G. The outcome and the frequency of pathological complete response after neoadjuvant radiotherapy in curative resections for advanced rectal cancer: a populationbased study[J]. Colorectal Dis, 2016, 18(1):67-72. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_PM26201935
-
期刊类型引用(5)
1. 汪泓,罗文广,张红雁,宁骏豪,钱东. 直肠癌新辅助放化疗后病理完全缓解的临床预测因素分析. 安徽医学. 2024(09): 1100-1105 .  百度学术
百度学术
2. 吴树剑,张虎,范莉芳,亚胜男,徐静雅. 临床-影像组学列线图术前预测直肠癌T分期. 沈阳医学院学报. 2023(05): 463-469+474 .  百度学术
百度学术
3. 翟鸿斌. 高分辨MRI检查在直肠腺癌TN分期中的应用价值. 航空航天医学杂志. 2023(12): 1431-1433 .  百度学术
百度学术
4. 严玲,伊艳,李喆,郑春燕,冯蕾,张俊鹏,尹晓阳,刘聪荷,李宝生. 食管鳞状细胞癌新辅助放化疗病理完全缓解预测列线图建立与验证. 中华肿瘤防治杂志. 2022(07): 494-500 .  百度学术
百度学术
5. 于丹丹,王湄,许礼平,王丹丹. 3T MRI在直肠癌术前分期中的准确性和临床价值研究. 中国肿瘤外科杂志. 2021(05): 454-457 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: