Prevention of moderate chemotherapy-induced nausea and vomiting in patients with gastrointestinal cancer using an individualized treatment model
-
摘要:目的 分析真实世界中化疗引起的恶心和呕吐(chemotherapy-induced nausea and vomiting,CINV)的个体化诊疗模式对胃肠道恶性肿瘤患者的CINV控制效果及对生存质量的影响。方法 选取2018年10月至2020年10月就诊于河北医科大学第四医院接受中度致吐风险化疗方案的289例胃肠道恶性肿瘤患者,按照CINV评估治疗方法分为CINV个体化诊疗组(A组)和医师选择诊疗组(B组),分析比较两组CINV控制效果及对生存质量的影响。结果 289例患者中A组146例,B组143例。A组全程恶心(74.66% vs.34.27%,P < 0.001)、呕吐(87.67% vs.55.94%,P < 0.001)完全控制率均明显优于B组,A组急性期及延迟期恶心、呕吐完全控制率优于B组。同时,A组患者在生存质量的功能领域(躯体功能、角色功能、社会功能),症状领域(恶心呕吐、疲倦、失眠、厌食),以及总体健康状况方面均表现出显著的优势。结论 个体化CINV诊疗模式可显著改善真实世界中胃肠道恶性肿瘤患者的CINV控制率和生存质量。Abstract:Objective To analyze the effect of individualized diagnosis and treatment of chemotherapy-induced nausea and vomiting (CINV) in the real world on the control rate of CINV and quality of life in patients with gastrointestinal cancer.Methods From October 2018 to October 2020, 289 patients with gastrointestinal cancer who were admitted to the Fourth Hospital of Hebei Medical University and received a chemotherapy regimen with moderate CINV risk were recruited.Patients were assigned into an individualized CINV treatment group (group A) and a doctor evaluation treatment group (group B).The control rate of CINV and its influence on quality of life were compared between the two groups.Results There were 146 and 143 cases in groups A and B, respectively.The complete control rates of nausea(74.66% vs.34.27%, P < 0.001)and vomiting(87.67% vs.55.94%, P < 0.001)were significantly better in group A than in group B.The complete control rates of nausea and vomiting during the acute and delayed phases in group A were significantly better than those in group B.Meanwhile, patients in group A showed significant advantages in terms of quality of life, with respect to functional domains(physical function, role function, and social function), symptom domains(nausea and vomiting, fatigue, insomnia, and anorexia), and overall health status.Conclusions Individualized CINV treatment can significantly improve the CINV control rate and quality of life in patients with gastrointestinal cancer.
-
Keywords:
- chemotherapy /
- nausea /
- vomiting /
- individual /
- quality of life /
- gastric cancer /
- colorectal cancer
-
尽管近年来止吐药物在新药研发和临床应用方面取得了重要进展,但化疗引起的恶心和呕吐(chemotherapy-induced nausea and vomiting,CINV)仍然是恶性肿瘤治疗中最严重的不良反应之一,控制不佳的CINV会对患者生存质量的多个维度产生负面影响,并降低其治疗依从性[1-2]。因此,临床医师在临床实践中应努力做到对CINV的有效预防和控制[3-4]。
在循证医学基础上,多国癌症支持治疗协会(MASCC)/欧洲肿瘤学会(ESMO)、美国临床肿瘤学会(ASCO),美国国立综合癌症网络(NCCN)以及中国临床肿瘤学会(CSCO)分别制定了CINV管理指南[4-6],这些指南的建议主要基于化疗药物在没有任何止吐治疗的情况下的致吐潜力。指南明确建议接受高度致吐风险方案(high emetic chemotherapy,HEC)治疗的患者应至少采用3种药物的止吐方案,包括1种神经激肽-1受体拮抗剂(NK1RA)/奥氮平,1种5-羟色胺3受体拮抗剂(5-HT3RA)以及地塞米松。而接受中度致吐风险方案(moderate emetic chemotherapy,MEC)患者的止吐方案,指南建议并不统一。肿瘤药物治疗相关恶心呕吐防治中国专家共识(2019年版)推荐常规应用5-HT3RA和地塞米松的双药方案治疗接受MEC的患者,对于伴有其他风险因素或既往使用双药方案治疗失败的患者,应加用NK1RA组成三药方案[6]。但指南对于风险因素如何评估未给出具体的指导,这使得临床医师在实际操作中存在较大的差异。
胃肠道恶性肿瘤最常用的化疗药物氟尿嘧啶、奥沙利铂、伊立替康等,均被定义为中度致吐风险药物,其组合方案也为中度致吐风险方案,总体CINV控制率低于45%,且不同患者应用同一方案的反应区别较大[7-8],这在很大程度上是因患者的个体化因素所致,而现行的CINV指南尚未为不同的临床患者提供能够平衡治疗有效性及药物不良反应的适当的个体化建议[4-6]。
Dranitsaris等[9]基于5项CINV研究中1 200余例患者的数据研究开发了一项患者个体化CINV预测模型量表。本研究借用此模型基础上,分析了真实世界中采用个体化CINV诊疗模式或医师选择CINV诊疗方案对于胃肠道肿瘤患者的CINV的控制效果及对生存质量的影响。
1. 材料与方法
1.1 一般资料
本研究为真实世界临床中非干预性队列研究,选取2018年10月至2020年10月就诊于河北医科大学第四医院的胃肠道恶性肿瘤患者289例。纳入标准:1)年龄≥18岁;2)美国东部肿瘤协作组(ECOG)体力状况(PS)评分0~2分。排除标准:1)化疗前24 h内患出现恶心、呕吐的患者;2)化疗前48 h内使用过任何可能致吐药物的患者;3)有症状的脑转移患者;4)长期服用有止吐作用药物的患者。研究获得所有患者的知情同意,并签署知情同意书。本研究获医院伦理委员会批准施行(2017MEC075)。
1.2 方法
1.2.1 患者分组及CINV诊疗模式
CINV个体化诊疗组(A组),按照个体化评估模式给予相应止吐药物治疗。将准备接受化疗患者的基线分定为10分,然后根据患者的自身个体化因素进行分数的加减计算。患者危险因素包括:1)年龄 < 60岁(+1分);2)预期性恶心、呕吐(+1分);3)化疗前一天睡眠 < 7 h(+1分);4)孕吐史(+1分);5)接受铂类或蒽环类化疗(+2分);6)既往使用非处方止吐药(+3分);7)在先前化疗中发生CINV(+5分);8)接受2个周期化疗(-5分);9)接受≥3个周期化疗(-6分)。系统评分介于0~32分,分值越高,CINV发生率越高,评分≥16分界定为“高危风险”,给予三药止吐方案(地塞米松+5-HT3RA+阿瑞匹坦;n=68,46.58%);其他患者给予双药止吐方案(地塞米松联合5-HT3RA;n=78,53.42%)。医师选择诊疗组(B组),均由主管医师按照CINV指南中“中度风险”给予双药止吐方案(地塞米松联合5-HT3RA)(表 1)。
表 1 患者止吐药物使用情况
1.2.2 患者化疗方案
治疗方案以奥沙利铂联合氟尿嘧啶类药物为主(73.9%)。患者的化疗方案主要为mFOLFOX6,XELOX/SOX,FOLFIRI及XELIRI方案(表 2)。
表 2 患者使用化疗方案
1.2.3 疗效评价
本研究主要研究终点是患者的恶心、呕吐全程完全控制率(0~120 h,无恶心、呕吐,符合常见不良反应事件评价标准(common terminologycriteria adverse events,CTCAE)4.0版恶心呕吐分级0级),次要研究终点为急性期(0~24 h)和延迟期(24~120 h)的完全控制率(无明显恶心及无呕吐,符合CACAE 4.0版恶心呕吐分级0级),以及患者的生存质量。
参考美国国家癌症研究院不良事件常见分类标准(CACAE 4.0版)对患者的恶心、呕吐进行分级。恶心分为3级:1级,食欲降低,不伴进食习惯改变;2级:经口摄食减少不伴明显的体质量下降,脱水或营养不良;3级:经口摄入能量和水分不足,需要鼻饲,全肠外营养或者住院。呕吐分为5级:1级,24 h内发生1~2次呕吐(至少间隔5 min);2级,24 h内发生3~5次呕吐(至少间隔5 min);3级,24 h内发生6次或以上呕吐(至少间隔5 min),或需鼻饲、静脉营养或住院治疗;4级,危及生命,需要紧急处理;5级,死亡。应用欧洲癌症治疗研究组织癌症生命质量核心量表(EORTC QLQ-C30)在化疗结束后第2天收集患者生存质量数据,功能领域和总体健康状况领域得分越高说明功能状况和生存质量越好,症状领域得分越高表明症状或生存质量越差。
1.3 统计学分析
采用IBM SPSS 24.0软件进行统计学分析。采用描述性统计方法计算恶心呕吐的发生率,等级资料的比较采用秩和检验。采用Spearman相关性分析法分析不同CINV诊疗模式与生存质量的相关性。采用Logistic回归分析预测患者恶心、呕吐的影响因素。P < 0.05为差异具有统计学意义。
2. 结果
研究共纳入289例患者,中位年龄60(21~87)岁,胃癌患者113例(44.40%),结直肠癌患者176例(55.60%)。按照CINV诊疗模式分为:A组为CINV个体化诊疗组(n=146),B组为医师选择诊疗组(n=143)。除疾病类型外,两组患者一般情况分布均衡(表3)。
表 3 患者的基本特征
2.1 恶心呕吐控制情况
所有患者的恶心全程完全控制率为55.02%(159/289),呕吐全程完全控制率为71.97%(208/289)。A组恶心(74.66% vs.34.27%,P < 0.001)、呕吐(87.67% vs.55.94%,P < 0.001)完全控制率均明显高于B组(表 4)。
表 4 患者全程恶心、呕吐控制情况例 (%)
A组急性期恶心、呕吐及延迟期恶心、呕吐的完全控制率均明显高于B组(表 5)。
表 5 患者急性期及延迟期恶心、呕吐控制情况
2.2 不同CINV诊疗模式下患者生存质量相关性分析
患者的CINV诊疗模式与生存质量的多个领域有明显的相关性,CINV个体化诊疗组患者在功能领域(躯体功能、角色功能、社会功能),症状领域(恶心呕吐、疲倦、失眠、厌食),以及总体健康状况方面均表现出一定的优势(表 6)。
表 6 不同CINV诊疗方案与患者生存质量的相关性分析
2.3 恶心、呕吐的影响因素分析
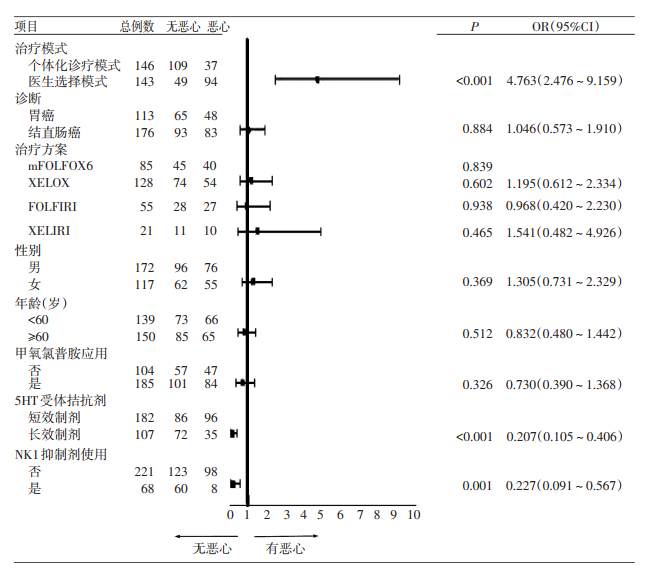
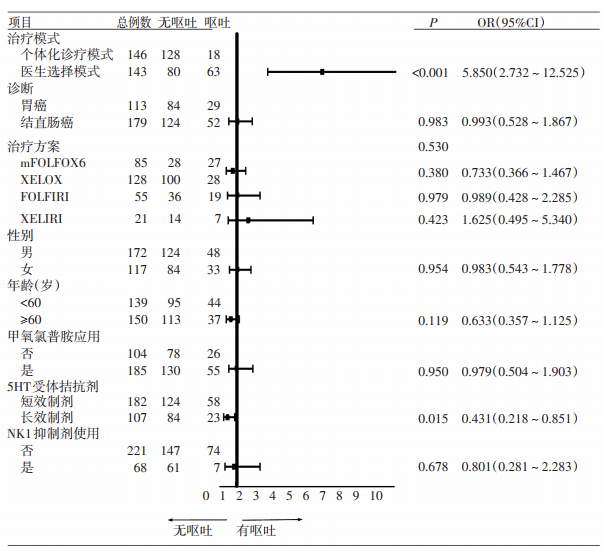
采用CINV个体化诊疗模式,应用长效5-HT3RA及NK1RA的患者发生恶心的风险较小,为其独立风险因素(图 1);采用CINV个体化诊疗模式,应用长效5-HT3RA的患者发生呕吐的风险较小,为其独立风险因素(图 2)。
3. 讨论
CINV控制不当会导致额外的止吐抢救治疗,抗肿瘤治疗延迟或减量,甚至提前停止化疗而影响疗效和整体生存质量[10]。既往研究发现如果在第1个周期化疗中控制不当,在随后的周期中CINV风险至少会增加3倍[11],甚至后续发生预期性和难治性恶心呕吐。因此,在化疗的初始便有效地预防CINV的发生极为重要,减少对患者的全程管理的影响。
国内外CINV预防和管理指南制定的主要依据是基于未采取任何止吐预防措施的情况下化疗药物的致吐潜力,对于接受HEC治疗患者的止吐治疗的建议基本一致,应至少采用包括3种药物的止吐方案(地塞米松,5-HT3RA,联合NK1RA或奥氮平)[4-5]。而对于接受MEC治疗患者的止吐治疗推荐目前尚存争议,地塞米松联合5-HT3RA是公认的可选标准治疗方案之一,同时是否加用NK1RA或奥氮平成为争论的焦点[12-15]。截止2021年2月,在国内阿瑞匹坦或福沙匹坦为非医保药物,奥氮平暂无无治疗CINV的适应症,面对MEC患者,是否应该加用NK1RA或奥氮平成为很多临床医师面临的困惑。为了避免过多使用自费药物或超适应症用药,很多临床医师面对MEC患者时会放弃应用NK1RA或奥氮平。尽管这样并不违背指南的推荐,但治疗效果却往往不如人意[14]。同时,很多临床医师会选择加用甲氧氯普胺治疗[16],但各指南均无优先推荐,其疗效也有待进一步评估。
目前,临床中不同患者接受MEC治疗的致吐风险的范围广泛(30%~90%的呕吐风险),一些学者认为除了化疗药物本身致吐风险差异较大外,这与医师或患者一定程度上与未能遵循指南而采用不同的止吐方案有关,然而本研究中,医师选择组即使遵循这些指导原则对所有MEC患者采用双药止吐方案,但许多患者仍然未得到有效的CINV控制。
MEC的致吐风险的范围广泛,很大程度上是因为患者的个体化因素所致,个体化评估的过程中会综合考虑这些因素,将临床上采用MEC方案的患者评估为高度CINV风险组,建议应用教高级别的止吐治疗。为进一步提高CINV的控制率,需要改变策略,不仅关注致吐治疗方案的风险分级,而且需要根据患者的个体化风险对其进行个体化管理。
肿瘤药物治疗相关恶心呕吐防治中国专家共识(2019年版)[6]推荐常规应用5-HT3RA和地塞米松的双药方案治疗接受MEC的患者,对于伴有其他风险因素或既往使用双药方案治疗失败的患者,应加用NK1RA组成三药方案。已确定的与患者相关的危险因素包括年轻、女性、低酒精摄入史、晕车和孕期呕吐史等,患者的焦虑、预期性呕吐、代谢异常、体质量指数、胃肠道刺激和颅内压会增加CINV的发生风险。另外,影响CINV发生的相关因素还包括化疗药物剂量、治疗计划、给药途径以及与其他致吐药物或放疗的联合使用等[16-20]。现行的各版本CINV共识指南尚没有给出简单易行的评估危险因素的方法,很难为患者提供适当的个体化建议[4-5]。
目前已有医疗团队开发了CINV风险预测模型,用于预测急性期和延迟期CINV的风险[9, 21]。Dranitsaris等[9]对5项CINV研究共约1 200例患者的数据进行分析,发现8个危险因素与CINV风险显著相关,包括年龄 < 60岁,预期性恶心和呕吐,化疗前一晚睡眠 < 7 h,有孕吐史,使用非处方止吐药,接受铂或蒽环类药物化疗,化疗次数,以及前一个化疗周期中发生CINV。该团队基于此开发了一项患者个体化CINV风险预测模型[9],并已提供了免费的在线工具以方便临床医师和患者使用(http://www.cinvrisk.org)。
本研究借用Dranitsaris教授团队个体化CINV诊疗模型,分析真实世界中CINV个体化诊疗组与医师选择诊疗组的CINV控制率及对生存质量的影响。研究纳入的患者主要为胃癌及结直肠癌患者,胃癌化疗方案主要为氟尿嘧啶类药物(注射用氟尿嘧啶、卡培他滨、替吉奥)联合奥沙利铂,结直肠癌的化疗方案主要为氟尿嘧啶类药物联合奥沙利铂或伊立替康。胃癌和结直肠癌的化疗方案相对统一,这些药物及其组成的双药方案在各版本指南的化疗药物致吐风险评级中均为中度致吐风险药物/方案。
在既往已发表的一些大型研究中,胃肠道恶性肿瘤化疗后恶心发生率为45%~66%,呕吐发生率为39%~70%。其中,含奥沙利铂的方案的呕吐发生率为39%~70%,恶心发生率为60.9%~66.0%;含伊立替康化疗方案的呕吐发生率为44.0%~60.1%,恶心率为45%~58%。总体CINV控制率低于45%[8, 22-24]。
本研究中,医师选择诊疗模式下,恶心发生率为63.73%,呕吐的发生率为44.06%,这与既往研究数据相似;而在个体化诊疗模式下,患者恶心发生率为23.89%,呕吐发生率为11.21%,明显低于既往研究及本研究中医师选择诊疗模式的数据,急性期及延迟期恶心呕吐分析得出了类似的结果,证实了该个体化诊疗模式的有效性。
临床实践中医护人员往往关注的是患者住院期间的急性期呕吐,而忽略了患者的院外出现的延迟期呕吐和恶心症状,而这会严重影响患者的生存质量。本研究采用全程的恶心呕吐完全控制率而非完全缓解率(定义为无呕吐和无挽救治疗使用的患者)做为主要观察指标,可以更全面地评估患者全程的恶心呕吐发生情况及对生存质量的影响。既往研究发现患者恶心呕吐的控制率提高,生存质量也会相应改善[2, 4]。本研究中,CINV个体化诊疗组的生存质量也明显提高,功能领域(躯体功能、角色功能、社会功能),症状领域(恶心呕吐、疲倦、失眠、厌食),以及总体健康状况方面均表现出一定的优势。同时,本研究中多因素回归分析显示CINV诊疗模式为恶心、呕吐发生的显著风险因素,相较医师选择诊疗模式,CINV个体化诊疗模式可以显著提高恶心呕吐的控制率。本研究从多个角度分析了个体化诊疗模式对胃肠道恶性肿瘤患者接受中度致吐风险化疗方案所致CINV的控制效果,表明个体化诊疗模式可以更好地控制CINV,进而改善患者的生存质量,使得患者更好地配合后续的治疗,最终临床获益。
同时,本研究发现帕洛诺司琼较其他短效5-HT3RA可以显著改善患者的恶心及呕吐控制率,阿瑞匹坦可以显著改善患者的恶心控制率,而甲氧氯普胺的应用并没有改善患者的恶心呕吐控制率,这与既往一些研究结论相似[15, 19, 25-29]。另外,既往研究发现胃肠道恶性肿瘤患者化疗后呕吐的发生率不同,在含奥沙利铂方案治疗胃癌的研究中,呕吐的发生率为39%~48%[9, 22],而结直肠癌患者呕吐的发生率为53%~70%[23-24]。但在本研究中未发现明显差别,可能与手术情况不同,药物应用不同等混杂因素较多相关,需要在后续大样本量的随机对照研究中进行深入分析。
本研究为真实世界研究,存在较多混杂因素,会在一定程度上影响研究结果。研究所采用的CINV风险预测模型只考虑到患者本身的临床病理特征数据,而未考虑其他潜在的重要预测因素,如患者基因组及药物基因组信息等[4, 30],需要更多临床数据及基因组学数据对该模型进行进一步的补充和完善。后续需要开发纳入分子生物学因素,符合中国临床的更精准的CINV个体化评估管理模型,并设计开展前瞻性随机对照研究行进一步探索。
本研究中应用的CINV个体化诊疗模式充分考虑到了患者个人风险因素,可以有效预测CINV发生风险等级,并给予适当的预防治疗指导,进而显著改善胃肠道恶性肿瘤的CINV管理效果。随着分子生物学的发展,除了一般临床病理特征,基因分子因素也逐步纳入风险模型的探索,以期建立具有高灵敏度和高特异性的CINV评估管理模型,帮助医师制定更为经济有效的个体化治疗决策,进一步改善CINV的控制,提高患者的生存质量,在肿瘤学临床实践中将有广泛的应用前景。同时,需要大规模前瞻性随机对照研究来验证不同的个体化CINV评估管理模型在不同肿瘤和治疗方案中的有效性。
-
表 1 患者止吐药物使用情况

表 2 患者使用化疗方案

表 3 患者的基本特征

表 4 患者全程恶心、呕吐控制情况例 (%)

表 5 患者急性期及延迟期恶心、呕吐控制情况

表 6 不同CINV诊疗方案与患者生存质量的相关性分析

-
[1] Kuchuk I, Bouganim N, Beusterien K, et al. Preference weights for chemotherapy side effects from the perspective of women with breast cancer[J]. Breast Cancer Res Treat, 2013, 142(1):101-107. DOI: 10.1007/s10549-013-2727-3
[2] Rusthoven JJ, Osoba D, Butts CA, et al. The impact of postchemotherapy nausea and vomiting on quality of life after moderately emetogenic chemotherapy[J]. Supportive Care Cancer, 1998, 6(4):389- 395. DOI: 10.1007/s005200050182
[3] Hernandez Torres C, Mazzarello S, Ng T, et al. Defining optimal control of chemotherapy-induced nausea and vomiting-based on patients experience[J]. Support Care Cancer, 2015, 23(11):3341-3359. DOI: 10.1007/s00520-015-2801-y
[4] Roila F, Molassiotis A, Herrstedt J, et al. 2016 MASCC and ESMO guideline update for the prevention of chemotherapy- and radiotherapy-induced nausea and vomiting and of nausea and vomiting in advanced cancer patients[J]. Ann Oncol, 2016, 27(5): v119-v133.
[5] Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American society of clinical oncology clinical practice guideline update[J]. J Clin Oncol, 2017, 35(28):3240-3261. DOI: 10.1200/JCO.2017.74.4789
[6] 姜文奇, 巴一, 冯继锋, 等.肿瘤药物治疗相关恶心呕吐防治中国专家共识(2019年版)[J].中国医学前沿杂志(电子版), 2019, 11(11):16-26. https://www.cnki.com.cn/Article/CJFDTOTAL-YXQY201911004.htm [7] Cassidy J, Clarke S, Díaz-Rubio E, et al. Randomized phase Ⅲ study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first line therapy for metastatic colorectal cancer[J]. J Clin Oncol, 2008, 26(12): 2006-2012. DOI: 10.1200/JCO.2007.14.9898
[8] Heinemann V, von Weikersthal LF, Decker T, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2014, 15(10): 1065-1075. DOI: 10.1016/S1470-2045(14)70330-4
[9] Dranitsaris G, Molassiotis A, Clemons M, et al. The development of a prediction tool to identify cancer patients at high risk for chemotherapy-induced nausea and vomiting[J]. Ann Oncol, 2017, 28(6):1260- 1267. DOI: 10.1093/annonc/mdx100
[10] Aapro1 M, Molassiotis A, Dicato M, et al. The effect of guidelineconsistent antiemetic therapy on chemotherapy-induced nausea and vomiting (CINV): the Pan European Emesis Registry (PEER)[J]. Ann Oncol, 2012, 23(8):1986-1992. DOI: 10.1093/annonc/mds021
[11] Molassiotis A, Lee PH, Burke TA, et al. Anticipatory nausea, risk factors, and its impact on chemotherapy-induced nausea and vomiting: results from the pan european emesis registry study[J]. J Pain Symptom Manag, 2016, 51(6): 987-993. DOI: 10.1016/j.jpainsymman.2015.12.317
[12] Chow R, Tsao M, Chiu L, et al. Efficacy of the combination neurokinin- 1 receptor antagonist, palonosetron, and dexamethasone compared to others for the prophylaxis of chemotherapy-induced nausea and vomiting: a systematic review and meta- analysis of randomized controlled trials[J]. Ann Palliat Med, 2018, 7(2):221-233. DOI: 10.21037/apm.2018.03.09
[13] Matsui R, Suzuki K, Takiguchi T, et al. 5-Hydroxytryptamine-3 receptor antagonist and dexamethasone as prophylaxis for chemotherapyinduced nausea and vomiting during moderately emetic chemotherapy for solid tumors: a multicenter, prospective, observational study[J]. BMC Pharmacol Toxico, 2020, 21(1):72. DOI: 10.1186/s40360-020-00445-y
[14] Jordan K, Blättermann L, Hinke A, et al. Is the addition of a neurokinin- 1 receptor antagonist beneficial in moderately emetogenic chemotherapy?- a systematic review and meta- analysis[J]. Support Care Cancer, 2018, 26(1):21-32. DOI: 10.1007/s00520-017-3857-7
[15] Schwartzberg LS, Marks SM, Gabrail NY, et al. Real-world effectiveness of palonosetron- based antiemetic regimens: preventing chemotherapy-induced nausea and vomiting[J]. J Comp Effect Res, 2019, 8(5): 657-670. http://www.ncbi.nlm.nih.gov/pubmed/31070042
[16] Ebrahimi M, Mehrzad V, Moghaddas A. Adherence to ASCO for prophylaxis of acute chemotherapy- induced nausea and vomiting in iran [J]. Asian Pac J Cancer P, 2020, 21(6):1567-1572. DOI: 10.31557/APJCP.2020.21.6.1567
[17] Hayashi M, Nakazawa K, Hasegawa Y, et al. Risk analysis for chemotherapy-induced nausea and vomiting (CINV) in patients receiving FEC100 treatment[J]. Anticancer Res, 2019, 39(8):4305-4314. DOI: 10.21873/anticanres.13596
[18] Singh K, Kober KM, Paul SM, et al. Gastrointestinal symptoms are associated with trajectories of chemotherapy- induced nausea[J]. Support Care Cancer, 2020, 28(5):2205-2215. DOI: 10.1007/s00520-019-05031-5
[19] Tsuji D, Suzuki K, Kawasaki Y, et al. Risk factors associated with chemotherapy-induced nausea and vomiting in the triplet antiemetic regimen including palonosetron or granisetron for cisplatin-based chemotherapy: analysis of a randomized, double-blind controlled trial [J]. Support Care Cancer, 2019, 27(3):1139-1147. DOI: 10.1007/s00520-018-4403-y
[20] Kawazoe H, Murakami A, Yamashita M, et al. Patient-related risk factors for nausea and vomiting with standard antiemetics in patients with breast cancer receiving anthracycline-based chemotherapy: a retrospective observational study[J]. Clin Ther, 2018, 40(12):2170-2179. DOI: 10.1016/j.clinthera.2018.10.004
[21] Clemons M, Bouganim N, Smith S, et al. Risk model-guided antiemetic prophylaxis vs physician's choice in patients receiving chemotherapy for early- stage breast cancer: A randomized clinical trial[J]. Jama Oncol, 2016, 2(2):225-231. DOI: 10.1001/jamaoncol.2015.3730
[22] Bang YJ, Kim YW, Yang HK, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 openlabel, randomized controlled trial[J]. Lancet, 2012, 379(9813): 315-321. DOI: 10.1016/S0140-6736(11)61873-4
[23] Cssidy J, Clarks S, Diaz-Rubio E, et al. XELOX vs FOLFOX-4 as first-line therapy for metastatic colorectal cancer: N016966 updated results[J]. Br J Cancer, 2011, 105(1): 58-64. DOI: 10.1038/bjc.2011.201
[24] Wasan H, Meade AM, Adams R, et al. Intermittent chemotherapy plus either intermittent or continuous cetuximab for first-line treatment of patients with KRAS wild-type advanced colorectal cancer (CION-B): a randomized phase 2 trial[J]. Lancet Oncol, 2014, 15(6): 631-639. DOI: 10.1016/S1470-2045(14)70106-8
[25] Chaudhary NK, John RR, Boddu D, et al. Palonosetron is a better choice compared with ondansetron for the prevention of chemotherapyinduced nausea and vomiting (CINV) in a resource-limited pediatric oncology center: results from a randomized control trial[J]. J Pediatr Hematol Oncol, 2019, 41(4):294-297. DOI: 10.1097/MPH.0000000000001357
[26] Gamble M, Carroll E, Wright GC, et al. Comparison of two different intravenous serotonin antagonists used for chemotherapy-induced nausea and vomiting prophylaxis in patients treated with moderately emetogenic risk regimens: A retrospective analysis from a large academic medical center[J]. J Oncol Pharm Pract, 2020, 26(8):1964-1969. DOI: 10.1177/1078155220938847
[27] Takahashi T, Okada T, Ikejiri F, et al. A prospective study of palonosetron for prevention of chemotherapy- induced nausea and vomiting in malignant lymphoma patients following highly emetogenic chemotherapy[J]. Int J Clin Oncol, 2018, 23(1):189-194. DOI: 10.1007/s10147-017-1173-3
[28] Popovic M, Warr DG, Deangelis C, et al. Efficacy and safety of palonosetron for the prophylaxis of chemotherapy-induced nausea and vomiting (CINV): a systematic review and meta-analysis of randomized controlled trials[J]. Support Care Cancer, 2014, 22(6):1685-1697. DOI: 10.1007/s00520-014-2175-6
[29] Okada Y, Oba K, Furukawa N, et al. One-Day Versus Three-day dexamethasone in combination with palonosetron for the prevention of chemotherapy-induced nausea and vomiting: A systematic review and individual patient data-based meta-analysis[J]. Oncologist, 2019, 24 (12):1593-1600. DOI: 10.1634/theoncologist.2019-0133
[30] Yokoi M, Tsuji D, Suzuki K, et al. Genetic risk factors for chemotherapy-induced nausea and vomiting in patients with cancer receiving cisplatin-based chemotherapy[J]. Support Care Cancer, 2018, 26(5): 1505-1513. http://www.ncbi.nlm.nih.gov/pubmed/29177570
-
期刊类型引用(3)
1. 宁智,周戴,戴新军,王丹,伍明辉,彭越,李翠英. 香砂六君子贴敷联合昂丹司琼在预防和治疗mFOLFOX6方案化疗后不良反应的临床研究. 湖南师范大学学报(医学版). 2024(04): 145-149 .  百度学术
百度学术
2. 赵曼伊. 肠内营养泵在胃肠道恶性肿瘤化疗患者早期营养支持中的应用效果. 中国医疗器械信息. 2023(12): 77-79 .  百度学术
百度学术
3. 夏秋燕,杨超,丁鹏. 杜尼式微笑服务在胃肠道恶性肿瘤患者围手术期心理护理中的应用效果. 中国当代医药. 2023(24): 168-172 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: