Clinical characteristics and prognostic factors of patients less than 40 years old with malignant phyllodes tumor of the breast
-
摘要:目的 探讨年龄≤40岁的乳腺恶性叶状肿瘤(malignant phyllodes tumors,MPTs)患者临床特征及预后因素。方法 回顾性分析2006年1月至2020年10月188例于天津医科大学肿瘤医院收治的乳腺MPTs患者的临床资料,按照年龄≤40岁和年龄>40岁分为年轻组54例和年长组134例。采用χ2检验或Fisher确切概率法、Kaplan–Meier法、Cox比例风险回归模型进行统计学分析。结果 年轻组乳腺MPTs患者5年和10年无复发生存(recurrence- free survival, RFS)率分别为55.8%和46.6%。年轻组患者的肿瘤直径>5 cm占59.3%(32/54)、年长组的占35.8%(48/134),两组比较差异具有统计学意义(P=0.031);年轻组患者的手术切缘<1 cm和术后化疗的比例分别为50.0%(27/54)和20.4%(11/54),较年长组的35.8%(48/134)和7.5%(10/134)高(P=0.048,P=0.024);年轻组中的患者行肿块切除术且保证手术切缘≥1 cm与乳腺全乳切除术相比,RFS差异无统计学意义(P=0.410)。Cox比例风险回归模型多因素分析显示,年龄(P=0.034)和手术切缘(P<0.001)是影响术后RFS的独立预后因素。结论 年龄和手术切缘影响乳腺MPTs预后,年龄≤40岁患者较>40岁预后更差,对于年龄≤40岁患者在保证手术切缘至少1 cm情况下行肿块切除术可行。Abstract:Objective To investigate the clinical characteristics and prognostic factors of malignant phyllodes tumors (MPTs) of the breast in patients below the age of 40.Methods We conducted a retrospective review of 188 MPT patients treated from January 2006 to October 2020 at the Tianjin Medical University Cancer Institute and Hospital. The patients were divided into two groups according to age: 54 patients were assigned to the young group (age ≤40 years) and 134 to the old group (age >40 years). The Chi-square test or Fisher’s exact test, the Kaplan-Meier method, and the Cox proportional hazard regression model were used for statistical analysis.Results The 5-year and 10-year cumulative recurrence-free survival, (RFS) rates were 55.8% and 46.6%, respectively, in the young group. In 59.3% (32/54) of cases in the young group and 35.8% (48/134) of cases in the old group, the size of the tumors was greater than 5 cm, with the difference in tumor size between the two groups being statistically significant (P=0.031). The proportions of participants with surgical margin <1 cm (50.0% vs. 35.8%, P=0.048) and participants placed on postoperative chemotherapy (20.4% vs. 7.5%, P=0.024) in the young group were significantly higher than those in the old group. Multivariate analysis revealed that age (P=0.034) and surgical margins (P<0.001) were independent prognostic factors for predicting RFS, and there was no statistically significant difference in RFS in the young group between participants who underwent lumpectomy with surgical margins ≥1 cm and those who underwent mastectomy (P=0.410).Conclusion Age and surgical margins are important prognostic factors of MPTs. Patients aged ≤40 years had worse prognoses than those aged >40 years. For young patients, lumpectomy might be feasible with a surgical margin of at least 1 cm.
-
Keywords:
- breast neoplasm /
- malignant phyllodes tumors (MPTs) /
- age /
- recurrence-free survival
-
乳腺恶性叶状肿瘤(malignant phyllodes tumors,MPTs)是罕见的纤维上皮性肿瘤,常见于45~49岁女性患者,患者的平均年发病率为每百万分之2.1[1],复发率可高达23%~30%,且诊断时的平均年龄小于乳腺癌[2-3]。目前,鉴于乳腺MPTs低发病率、高复发性以及对年轻患者更需兼顾美观的需求,在患者的治疗方式及影响预后的因素方面尚存在争议。本研究旨在通过对乳腺MPTs患者的年龄进行分组分析,为临床治疗及预后提供参考。
1. 材料与方法
1.1 病例资料
回顾性分析2006年1月至2020年10月188例于天津医科大学肿瘤医院就诊并经病理切片检查确诊的乳腺MPTs患者的临床病例资料,根据年龄分为年轻组(年龄≤40岁)54例和年长组(年龄>40岁)134例。纳入标准:1)经病理学确诊;2)无其他恶性肿瘤病史。排除标准:1)病理证实病灶含有浸润性导管癌成分;2)患者有既往乳腺良性或交界性叶状肿瘤病史,同一部位复发为MPTs。
1.2 方法
1.2.1 诊断方法
参照2012年世界卫生组织(WHO)制定的乳腺肿瘤组织学分类标准,MPTs定义为细胞核多形性明显、间质过度增生、间质细胞弥漫性增多、浸润性边界及核分裂像≥10个/10高倍镜视野(high power field,HPF)[2],所有患者的术后病理均由本院至少2名病理医师检查并审核通过。
1.2.2 随访
术后通过电话或门诊复查记录患者术后复发转移及辅助治疗情况。总生存(overall survival, OS)时间定义为手术结束至死亡或最后随访时间;无复发生存(recurrence-free survival,RFS)时间为手术结束至疾病复发转移时间或最后随访时间;无远处转移(distant relapse-free survival,DRFS)时间为术后至远处转移或最后随访时间,随访截止至2020年10月。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。计数资料采用频数及百分比表示,组间差异采用χ2检验或Fisher确切概率法,Kaplan–Meier法计算RFS、OS及DRFS率并采用Log-rank法进行检验,采用Cox比例风险回归模型进行多因素分析。P<0.05为差异具有统计学意义。
2. 结果
2.1 临床特征
188例患者中137例行肿块切除术,51例全乳切除术。年轻组患者诊断时未生育比例为33.3%(18/54),较年长组的3.0%(4/134)高,两组比较差异具有统计学意义(P<0.001);年轻组患者术前行针吸活检检查为18.5%(10/54)、年长组的为33.6%(45/134),两组比较差异具有统计学意义(P=0.040);年轻组中的肿瘤直径>5 cm占59.3%(32/54),年长组为35.8%(48/134),两组比较差异具有统计学意义(P=0.031);年轻组患者手术切缘<1 cm比例为50.0%(27/54),较年长组的35.8%(48/134)高,两组比较差异具有统计学意义(P=0.048)。21例患者行术后化疗,年轻组中占20.4%(11/54),年长组中占7.5%(10/134),年轻女性术后更易接受化疗(P=0.024)。见表1。
表 1 根据年龄比较乳腺MPTs临床特征参数 年轻组(n=54) 年长组(n=134) P 乳腺癌家族史 0.664 有 3(5.6) 7(5.2) 无 51(94.4) 125(93.3) 未知 0(0) 2(1.5) 生育史 <0.001 有 35(64.8) 129(96.3) 无 18(33.3) 4(3.0) 未知 1(1.9) 1(0.7) 哺乳史 <0.001 有 30(55.6) 116(86.6) 无 23(42.6) 17(12.7) 未知 1(1.8) 1(0.7) 临床症状 0.894 乳房肿块 26(48.1) 69(51.5) 乳房肿块缓慢增大 13(24.1) 24(17.9) 乳房肿块迅速增大 3(5.6) 8(6.0) 乳房肿块伴疼痛 9(16.7) 25(18.7) 乳房肿块侵犯皮肤 1(1.8) 5(3.7) 乳房肿块伴溢液 2(3.7) 3(2.2) 乳腺纤维瘤病史 0.396 有 17(31.5) 33(24.6) 无 34(63.0) 97(72.4) 未知 3(5.5) 4(3.0) 针吸活检 0.040 有 10(18.5) 45(33.6) 无 44(81.5) 89(66.4) 乳腺手术 0.814 肿块切除术 40(74.1) 97(72.4) 全切术 14(25.9) 37(27.6) 肿瘤大小(cm) 0.031 ≤2 3(5.5) 9(6.7) 2~5 17(31.5) 71(53.0) >5 32(59.3) 48(35.8) 未知 2(3.7) 6(4.5) 手术切缘(cm) 0.048 <1 27(50.0) 48(35.8) ≥1 26(48.1) 86(64.2) 未知 1(1.9) 0(0) 辅助化疗 0.024 有 11(20.4) 10(7.5) 无 43(79.6) 121(90.3) 未知 0(0) 3(2.2) 辅助放疗 0.780 有 2(3.7) 3(2.2) 无 51(94.4) 127(94.8) 未知 1(1.9) 4(3.0) ()内单位为% 2.2 复发转移
截至随访结束,188例患者中56例复发、47例局部复发、11例远处转移、10例死亡,术后至复发中位时间为11.5(1~107)个月。54例年轻组患者中局部复发20例均发生在乳腺,远处转移4例中3例肺脏转移、1例肺脏合并骨骼转移;134例年长组患者中局部复发24例发生在乳腺,3例发生在胸壁,远处转移7例中6例肺脏转移、1例肺脏合并肝脏转移(表2)。
表 2 乳腺MPTs复发转移情况参数 年轻组(n=54) 年长组(n=134) 复发 有 24(44.4) 34(25.4) 无 30(55.6) 100(74.6) 局部复发 有 20(37.0) 27(20.1) 无 34(63.0) 107(79.9) 远处转移 有 4(7.4) 7(5.2) 无 50(92.6) 127(94.8) ()内单位为% 单因素分析显示,乳腺MPTs患者在年龄、既往乳腺纤维瘤手术史、手术切缘方面的RFS差异均具有统计学意义(P<0.050,表3)。将单因素分析中具有统计学意义变量纳入Cox比例风险回归多因素分析中,年龄(HR为1.804,95%CI为1.047~3.108,P=0.034)及手术切缘(HR为0.248,95%CI为0.128~0.481,P<0.001)是影响乳腺MPTs患者术后RFS的独立预后因素(表4)。
表 3 影响乳腺MPTs的RFS单因素分析参数 RFS(%) χ2 P 年龄(岁) 9.160 0.002 ≤40 46.6 >40 72.4 乳腺癌家族史 0.469 0.791 有 63.5 无 65.5 生育史 0.791 0.673 有 65.4 无 66.1 哺乳史 1.560 0.459 有 68.3 无 51.5 临床症状 7.447 0.189 乳房肿块 64.3 乳房肿块缓慢增大 69.9 乳房肿块迅速增大 72.7 乳房肿块伴疼痛 68.7 乳房肿块侵犯皮肤 83.3 乳房肿块伴溢液 20.0 乳腺纤维瘤病史 7.817 0.020 有 46.5 无 71.2 针吸活检 1.313 0.252 有 68.7 无 63.9 乳腺手术 3.610 0.057 肿块切除术 60.2 全切术 78.9 肿瘤大小(cm) 3.693 0.158 ≤2 91.7 2~5 65.7 >5 58.5 手术切缘(cm) 29.907 <0.001 <1 39.1 ≥1 82.9 辅助化疗 1.196 0.550 有 68.9 无 64.1 辅助放疗 1.945 0.378 有 100 无 64.1 表 4 影响乳腺MPTs的RFS的Cox比例风险回归模型多因素分析参数 HR 95%CI P 年龄(岁) 0.034 ≤40 1.804 1.047~3.108 >40 1.000 乳腺纤维瘤病史 0.107 有 1.733 1.003~2.993 无 1.000 乳腺手术 0.807 肿块切除术 1.000 全切术 1.102 0.503~2.415 手术切缘(cm) <0.001 <1 1.000 ≥1 0.248 0.128~0.481 2.3 预后分析
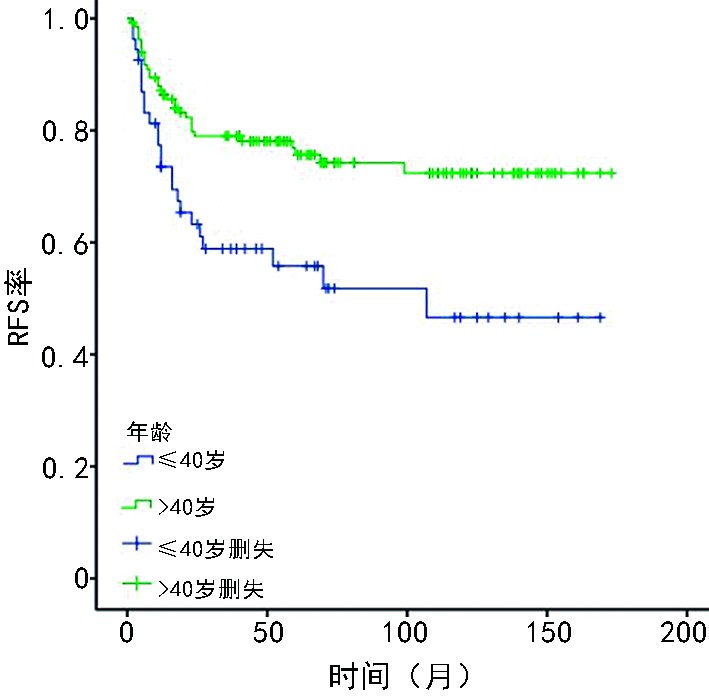
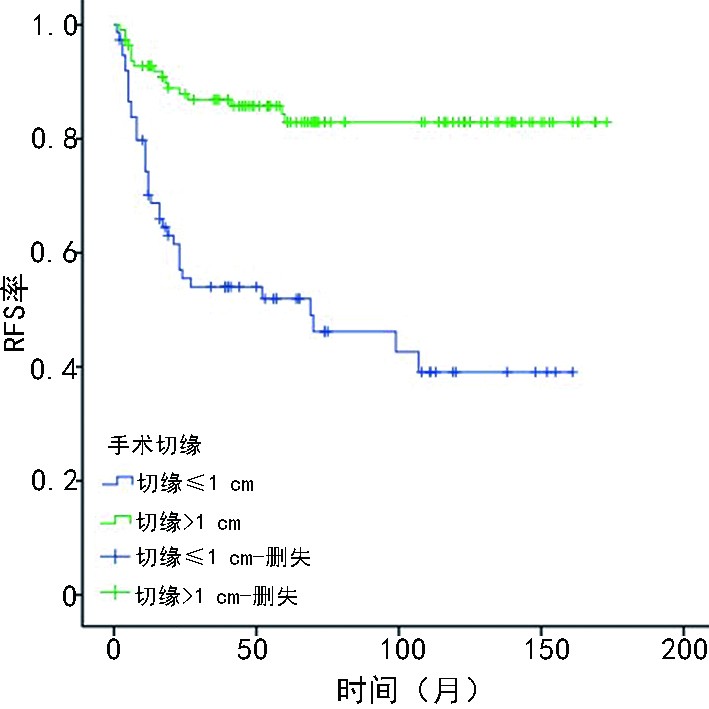
188例乳腺MPTs患者的10年累积OS率和RFS率分别为92.8%和70.1%,年轻组5年和10年RFS率分别为55.8%和46.6%、年长组的为76.9%和72.4%(P=0.002,图1),年轻组和年长组10年DRFS率分别为91.8%和94%(P=0.533)。患者的手术切缘<1 cm较切缘≥1 cm的RFS低(P<0.001,图2)。因年轻组患者的肿块切除术预后较乳腺全乳切除术差(P=0.045),考虑肿块切除术中手术切缘<1 cm患者占比更多,进一步分析手术切缘≥1 cm行肿块切除术的年轻患者发现其与全乳切除术相比,RFS差异无统计学意义(P=0.410)。
2.4 年轻组与年长组的分层RFS比较
对手术切缘分层分析发现,在手术切缘<1 cm患者中,年龄是影响乳腺MPTs的独立预后因素(P=0.005),且年轻组患者的预后较年长组的差(HR为2.462,95%CI为1.30~4.641);在手术切缘≥1 cm患者中,年轻组与年长组预后差异无统计学意义(HR为1.070,95%CI为0.34~3.283,P=0.906),年龄并不是影响RFS的预后因素。
3. 讨论
本研究结果提示,年龄影响乳腺MPTs患者的预后,年龄≤40岁患者的预后较年龄>40岁的更差。Spanheimer等[4]通过分析124例乳腺恶性和交界性叶状肿瘤患者发现,年龄<40岁与局部区域复发(locoregional recurrence,LRR)风险显著增加有关,Choi等[5]研究发现年龄<35岁的乳腺MPTs患者的局部复发(local recurrence,LR)率较年龄≥35岁高,与本研究结果基本一致。然而Zhou等[6]研究发现,年龄<38岁的年轻患者与年长患者相比LR率差异无统计学意义(P=0.091),该研究中乳腺MPTs患者仅52例。本研究发现,年轻乳腺MPTs患者术后复发率较高,应该提高对年轻患者此类疾病的认识,术后进行定期复查。
本研究还发现,年轻乳腺MPTs患者与年长者相比,肿瘤直径更大、手术切缘<1 cm及术后化疗比例更高。Guillot等[7]研究显示,在165例乳腺叶状肿瘤患者中MPTs患者仅为14例(8.5%),患病年龄与手术切缘无相关性(P=0.12),165例患者中切缘>1 cm的中位年龄为44岁,切缘<1 cm为46.5岁;Leraas等[8]报道了儿童与成人叶状肿瘤临床特征的差异,发现两者在肿瘤大小、手术干预类型、手术切缘阳性率、术后化疗等方面无显著性差异;Xiao等[9]利用SEER数据库提出在乳腺MPTs中,年轻者较年长者行保乳术比例更高,同Leraas等[8]研究一致,但该研究在肿瘤大小及术后化疗方面差异无统计学意义。本研究中乳腺MPTs年轻患者的术后化疗比例高于年长者,原因可能是年轻患者的肿瘤较大、手术切缘<1 cm占比高,并通过对年轻与年长患者临床特征差异的较大样本分析,可为临床医生提供参考。
本研究行Cox比例风险回归模型多因素分析发现,手术切缘是影响乳腺MPTs患者预后的独立因素。研究显示,对于良性叶状肿瘤手术切缘阳性或切缘<1 cm患者,术后需密切随访以代替再切除的可行性[10]。目前,对于乳腺MPTs的手术切缘尚存在争议,有研究表明手术切缘>1 cm可降低术后复发率[5, 11],但也有研究指出手术切缘<1 cm患者的预后并不劣于切缘≥1 cm者[12-13]。Spanheimer等[4]通过分析124例乳腺恶性和交界性叶状肿瘤患者中的86例乳腺MPTs患者发现,手术切缘<1 mm增加LRR风险,但因局部复发例数较少,无法进行多因素分析。本研究通过对188例乳腺MPTs患者分析提出,手术切缘<1 cm有更佳预后获益。
因年轻患者对美观需求更多,本研究对54例年龄≤40岁年轻患者的亚组行肿块切除术的可行性进行分析发现,肿块切除术后RFS率较全乳切除术低,术后切缘<1 cm患者占比较高(P<0.001),排除手术切缘因素对预后可能造成的影响,手术切缘≥1 cm患者行肿块切除术的预后与全乳切除术相比差异无统计学意义(P=0.410)。Choi等[14]通过对206例乳腺MPTs患者进行多因素分析发现,行肿块切除术是导致LR风险增加的独立因素。该研究有13.2%患者手术切缘阳性,可能是造成该术式预后较差的原因。该研究团队在随后研究中发现,行肿块切除术的切缘阳性和阴性患者,术后5年累计LR率分别为35.9%和14.7%,手术切缘<1 cm患者的年龄较小或肿瘤较大为乳腺MPTs的危险因素,应考虑放疗[5]。另有研究提出,乳腺MPTs患者行肿块切除术的切缘<1 cm应考虑辅助放疗[15],本研究因术后放疗样本量较少,无法进一步分析肿块切除术切缘<1 cm患者的术后放疗的可行性。本研究显示,乳腺MPTs年轻患者在保证手术切缘≥1 cm情况下,可行肿块切除手术,对预后无影响。
综上所述,乳腺MPTs年轻患者较年长者肿瘤更大、手术切缘<1 cm占比更高,因术后复发率高更倾向于化疗,对于年轻患者行肿块切除术并且保证手术切缘≥1 cm是可行的。
-
表 1 根据年龄比较乳腺MPTs临床特征
参数 年轻组(n=54) 年长组(n=134) P 乳腺癌家族史 0.664 有 3(5.6) 7(5.2) 无 51(94.4) 125(93.3) 未知 0(0) 2(1.5) 生育史 <0.001 有 35(64.8) 129(96.3) 无 18(33.3) 4(3.0) 未知 1(1.9) 1(0.7) 哺乳史 <0.001 有 30(55.6) 116(86.6) 无 23(42.6) 17(12.7) 未知 1(1.8) 1(0.7) 临床症状 0.894 乳房肿块 26(48.1) 69(51.5) 乳房肿块缓慢增大 13(24.1) 24(17.9) 乳房肿块迅速增大 3(5.6) 8(6.0) 乳房肿块伴疼痛 9(16.7) 25(18.7) 乳房肿块侵犯皮肤 1(1.8) 5(3.7) 乳房肿块伴溢液 2(3.7) 3(2.2) 乳腺纤维瘤病史 0.396 有 17(31.5) 33(24.6) 无 34(63.0) 97(72.4) 未知 3(5.5) 4(3.0) 针吸活检 0.040 有 10(18.5) 45(33.6) 无 44(81.5) 89(66.4) 乳腺手术 0.814 肿块切除术 40(74.1) 97(72.4) 全切术 14(25.9) 37(27.6) 肿瘤大小(cm) 0.031 ≤2 3(5.5) 9(6.7) 2~5 17(31.5) 71(53.0) >5 32(59.3) 48(35.8) 未知 2(3.7) 6(4.5) 手术切缘(cm) 0.048 <1 27(50.0) 48(35.8) ≥1 26(48.1) 86(64.2) 未知 1(1.9) 0(0) 辅助化疗 0.024 有 11(20.4) 10(7.5) 无 43(79.6) 121(90.3) 未知 0(0) 3(2.2) 辅助放疗 0.780 有 2(3.7) 3(2.2) 无 51(94.4) 127(94.8) 未知 1(1.9) 4(3.0) ()内单位为% 表 2 乳腺MPTs复发转移情况
参数 年轻组(n=54) 年长组(n=134) 复发 有 24(44.4) 34(25.4) 无 30(55.6) 100(74.6) 局部复发 有 20(37.0) 27(20.1) 无 34(63.0) 107(79.9) 远处转移 有 4(7.4) 7(5.2) 无 50(92.6) 127(94.8) ()内单位为% 表 3 影响乳腺MPTs的RFS单因素分析
参数 RFS(%) χ2 P 年龄(岁) 9.160 0.002 ≤40 46.6 >40 72.4 乳腺癌家族史 0.469 0.791 有 63.5 无 65.5 生育史 0.791 0.673 有 65.4 无 66.1 哺乳史 1.560 0.459 有 68.3 无 51.5 临床症状 7.447 0.189 乳房肿块 64.3 乳房肿块缓慢增大 69.9 乳房肿块迅速增大 72.7 乳房肿块伴疼痛 68.7 乳房肿块侵犯皮肤 83.3 乳房肿块伴溢液 20.0 乳腺纤维瘤病史 7.817 0.020 有 46.5 无 71.2 针吸活检 1.313 0.252 有 68.7 无 63.9 乳腺手术 3.610 0.057 肿块切除术 60.2 全切术 78.9 肿瘤大小(cm) 3.693 0.158 ≤2 91.7 2~5 65.7 >5 58.5 手术切缘(cm) 29.907 <0.001 <1 39.1 ≥1 82.9 辅助化疗 1.196 0.550 有 68.9 无 64.1 辅助放疗 1.945 0.378 有 100 无 64.1 表 4 影响乳腺MPTs的RFS的Cox比例风险回归模型多因素分析
参数 HR 95%CI P 年龄(岁) 0.034 ≤40 1.804 1.047~3.108 >40 1.000 乳腺纤维瘤病史 0.107 有 1.733 1.003~2.993 无 1.000 乳腺手术 0.807 肿块切除术 1.000 全切术 1.102 0.503~2.415 手术切缘(cm) <0.001 <1 1.000 ≥1 0.248 0.128~0.481 -
[1] Bernstein L, Deapen D, Ross RK, et al. The descriptive epidemiology of malignant cystosarcoma phyllodes tumors of the breast[J]. Cancer, 1993, 71(10):3020-3024.
[2] Lakhani S, Ellis I, Schnitt S, et al. World health organisation classification of tumors of the breast[M]. Lyon: IARC, 2012.
[3] Strode M, Khoury T, Mangieri C, et al. Update on the diagnosis and management of malignant phyllodes tumors of the breast[J]. Breast, 2017, 33:91-96. DOI: 10.1016/j.breast.2017.03.001
[4] Spanheimer PM, Murray MP, Zabor EC, et al. Long-term outcomes after surgical treatment of malignant/borderline phyllodes tumors of the breast[J]. Ann Surg Oncol, 2019, 26(7):2136-2143. DOI: 10.1245/s10434-019-07210-4
[5] Choi N, Kim K, Shin KH, et al. The characteristics of local recurrence after breast-conserving surgery alone for malignant and borderline phyllodes tumors of the breast (KROG 16-08)[J]. Clin Breast Cancer, 2019, 19(5):345-353. DOI: 10.1016/j.clbc.2019.04.003
[6] Zhou ZR, Wang CC, Sun XJ, et al. Prognostic factors in breast phyllodes tumors: a nomogram based on a retrospective cohort study of 404 patients[J]. Cancer Med, 2018, 7(4):1030-1042. DOI: 10.1002/cam4.1327
[7] Guillot E, Couturaud B, Reyal F, et al. Management of phyllodes breast tumors[J]. Breast J, 2011, 17(2):129-137. DOI: 10.1111/j.1524-4741.2010.01045.x
[8] Leraas HJ, Rosenberger LH, Ren Y, et al. Pediatric phyllodes tumors: a review of the national cancer data base and adherence to NCCN guidelines for phyllodes tumor treatment[J]. J Pediatr Surg, 2018, 53(6):1123-1128. DOI: 10.1016/j.jpedsurg.2018.02.070
[9] Xiao Y, Jiang Y, Xiong Y, et al. Pediatric malignant phyllodes tumors of the breast: characteristics and outcomes based on the surveillance epidemiology and end results database[J]. J Surg Res, 2020, 249:205-215. DOI: 10.1016/j.jss.2019.12.031
[10] Noordman PCW, Klioueva NM, Weimann MN, et al. Phyllodes tumors of the breast: a retrospective analysis of 57 cases[J]. Breast Cancer Res Treat, 2020, 181(2):361-367. DOI: 10.1007/s10549-020-05620-7
[11] Toussaint A, Piaget-Rossel R, Stormacq C, et al. Width of margins in phyllodes tumors of the breast: the controversy drags on?-a systematic review and meta-analysis[J]. Breast Cancer Res Treat, 2020, 185(1):21-37.
[12] Neron M, Sajous C, Thezenas S, et al. Surgical margins and adjuvant therapies in malignant phyllodes tumors of the breast: a multicenter retrospective study[J]. Ann Surg Oncol, 2020, 27(6):1818-1827.
[13] Tremblay-LeMay R, Hogue JC, Provencher L, et al. How wide should margins be for phyllodes tumors of the breast[J]? Breast J, 2017, 23(3):315-322.
[14] Choi N, Kim K, Shin KH, et al. Malignant and borderline phyllodes tumors of the breast: a multicenter study of 362 patients (KROG 16-08)[J]. Breast Cancer Res Treat, 2018, 171(2):335-344. DOI: 10.1007/s10549-018-4838-3
[15] Mitus J, Reinfuss M, Mitus JW, et al. Malignant phyllodes tumor of the breast: treatment and prognosis[J]. Breast J, 2014, 20(6):639-644. DOI: 10.1111/tbj.12333
-
期刊类型引用(1)
1. 曹阳阳,张双红,屈欣然,孟欣怡,刘娜. 乳腺叶状肿瘤患者的MRI特征及其与病理学分级的相关性. 海南医学. 2023(16): 2386-2391 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: