Advances in research on the relationship between the complement system and antitumor immune response
-
摘要: 补体系统是先天免疫反应的重要组成部分,但其生物学意义远远超出了简单的非特异性防御。在肿瘤微环境中,补体系统对肿瘤的发生、发展起着双重调控作用,影响免疫应答的结果。通过对免疫系统的调节以及对肿瘤细胞的直接杀伤作用,补体促进了免疫监视并抑制肿瘤进展;然而,过度激活的补体可以通过多种途径影响宿主免疫反应,是炎症、免疫抑制和肿瘤进展之间的重要环节。在抗肿瘤免疫治疗过程中靶向补体系统有助于克服免疫抑制,产生抗肿瘤免疫反应。本文对补体系统与肿瘤免疫的研究进展进行综述,旨在为抗肿瘤免疫治疗提供选择。Abstract: As an important component of the innate immune response, the complement system has biological significance that goes far beyond simple, non-specific, defense mechanisms. In the tumor microenvironment, the complement system plays a dual role in the occurrence and development of tumors, affecting the outcome of the immune response. Through the regulation of immunity and direct killing of tumor cells, the complement system promotes immune surveillance and inhibits tumor progression; however, an over-activated complement system can affect the immunity of the host, which is an important link among inflammation, immunosuppression, and tumor progression. Targeting to complement contributes to overcoming immunosuppression and leads to an antitumor immune response. This article reviews the recent advances in research on the relationship between the complement system and antitumor immune response with the aim of providing choices for antitumor immunotherapy.
-
补体是一个精密调控的蛋白质系统,它由50多种可溶性蛋白和膜结合蛋白组成,包括补体固有成分(如C1~9)、补体受体(如C3aR、C5aR、CR2)和补体调节蛋白(如CFI、CFH)。补体系统是防御病原体的第一道防线并参与维持机体动态平衡。补体对肿瘤的调节作用已在不同类型的癌症中得到证实,一方面,补体可以通过激活机体的免疫反应、参与调理素反应以及直接杀伤作用,在促进免疫监视和抑制肿瘤细胞方面发挥重要作用。另一方面,肿瘤微环境中过度激活的补体是维持慢性局部炎症反应的关键因素并促进肿瘤发展;补体对免疫反应信号通路的干扰也极大地促进肿瘤免疫逃逸以及免疫抑制。
1. 补体的激活与调控
研究证明,在不同的肿瘤类型中补体系统可以通过典型或非典型补体激活途径被激活,在肿瘤的生长调控中起着关键作用。
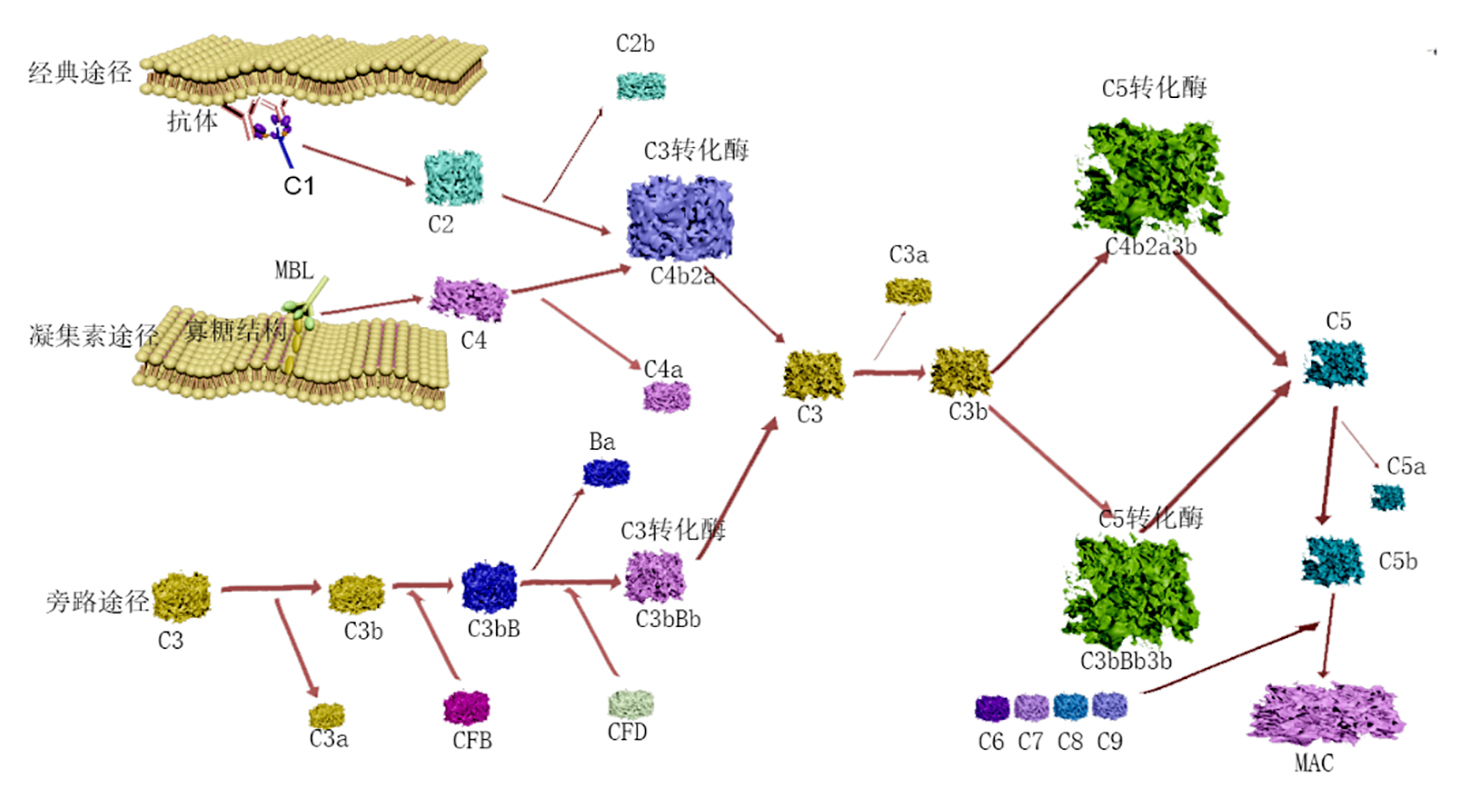
1.1 典型的补体激活途径
补体蛋白通过结合特定分子如抗原-抗体复合物、甘露糖结合凝集素(mannose-binding lectin,MBL)、MBL相关丝氨酸蛋白酶(mannose-binding lectin-asso-ciated serine protease,MASP)、备解素(也称为P因子),对应激信号做出快速反应,从而启动补体蛋白水解级联反应。补体可以通过三种典型途径激活,即经典途径、凝集素途径或旁路途径,具有共同的终末途径。补体激活途径可分为四个主要步骤,即补体激活、C3转化酶形成、C5转化酶生成和膜攻击复合物(membrane attack complex,MAC)组装(图1)。其中,C3a、C5a是重要的炎症介质,调理素C3b还可进一步切割成C3d、C3c、C3dg等小片段,参与获得性免疫应答。此外,膜结合性补体调节蛋白(membrane-bound complement regulatory proteins,mCRPs)及可溶性补体调节蛋白(soluble complement regulatory proteins,sCRPs)可在不同水平对补体级联反应进行精密调控,以调节特定免疫效应和反应强度。
TC-1小鼠证明补体可以通过经典途径被激活[1]。在KRAS突变的CMT167肺癌细胞系的另一个同基因肺癌小鼠模型中,补体也可通过旁路途径被激活从而促进肿瘤发展[2]。此外,有研究报道病原真菌通过MBL途径激活补体并促进胰腺导管腺癌的进展[3]。
1.2 非典型的补体激活途径
补体激活并不局限于细胞外,在细胞内也可以通过组织蛋白酶L、肾素、凝血酶和纤溶酶裂解C3和C5补体,并以自分泌的方式被分泌而不依赖于传统的转化酶途径。非典型补体激活途径在T细胞稳态和效应中发挥关键作用。C3a可通过细胞内组织蛋白酶L(cathepsin L,CTSL)的裂解而产生,并且CTSL可以激活溶酶体上的C3aR受体,导致mTOR的低水平激活,从而维持静止的CD4+T细胞动态平衡[4]。这种细胞内C3非典型激活途径向细胞表面的迁移导致TCR和共刺激分子CD28的激活。C3a和C3b分别触发C3aR和CD46,刺激mTORC1的持续激活。此外,糖酵解和氧化磷酸化可被重新编程,并促进Th1分泌干扰素IFN-γ。当CD4+T细胞被激活时,CD46触发C5在细胞内裂解成C5a,从而诱导细胞内的C5aR1激活,促使C5aR1依赖的活性氧的产生。NLRP3型炎症介质被自分泌的C5a激活,刺激分泌IL-1β,从而维持对Th1细胞的诱导分化。此外,IL-2R和CD46能够诱导IL-10的产生,导致TH1细胞群向收缩期转变[5-9]。
1.3 补体调节蛋白的调控作用
补体调节蛋白存在于多种细胞表面以及血浆中,通过调控MAC组装以及酶活性等而调节补体级联酶促反应,旨在保护宿主细胞免受补体系统的意外裂解。其可分为mCRPs以及sCRPs,前者主要包括膜辅蛋白(membrane cofactor protein,MCP/CD46)、衰变加速因子(decay-accelerating factor,DAF/CD55)和膜反应性溶解抑制因子(membrane inhibitor of reactive lysis,MIRL/CD59);后者主要包括B因子(complement factor B,CFB)、H因子(complement factor H,CFH)。CD46是C3b和C4b裂解的辅助因子,过剩的C3b和C4b可裂解为C3bi、C3f和C4d、C4c;CD55是一种糖基磷脂酰肌醇锚定蛋白(glycosyl- phosphatidyl inositol-anchored protein,GPI-AP),广泛表达于细胞表面,可加速C3转化酶的衰变并抑制C3b沉积,从而限制补体的激活;CD59是另一种GPI-AP,可与C8和C9结合而抑制MAC的形成;CFH与CFB竞争性结合C3b,干扰C3转化酶复合体的生成,此外,它还能促进C3bBb的解离,是旁路途径中不可缺少的可溶性调节补体调节蛋白。
2. 补体系统与肿瘤免疫
肿瘤的发生发展是一个多因素的过程,肿瘤的生长受免疫系统的调控,宿主免疫系统与肿瘤发生发展之间存在着动态而复杂的关系。肿瘤微环境中活化的补体分子可影响多种免疫调节途径,在肿瘤的发生发展中起着非常重要的作用并最终影响肿瘤的命运,部分补体蛋白在肿瘤中的效应功能整理见表1。
表 1 部分重要补体蛋白成分及其功能效应补体蛋白 受体 功能效应 参考文献 C3a C3aR 过敏毒素,激活CD4+T细胞,促进肿瘤转移,促进肿瘤相关血管生成 [10-11] C5a C5aR1,C5aR2 过敏毒素,激活CD4+T细胞,促进肿瘤转移,促进肿瘤相关血管生成 [1] C3b CD46,CFH,CR1 调理素,参与形成C3、C5转化酶 [12] Factor H C3b,C3d 裂解C3b,促进旁路途径C3转化酶灭活 [13] Factor I CFH,CR1,CD46, C3b,C4b 裂解C3b,裂解C4b [14] Factor B C3b 参与C3转化酶、C5转化酶形成,凋亡诱导因子 [15-16] CD46 C3b,C4b 裂解 C3b 和 C4b,促进C3转化酶的灭活,激活CD4+T细胞 [17-18] CD55 C4b2a,C3bBb 促进C3转化酶的灭活 [19] CD59 C8 抑制MAC组装 [20] CR1(CD35) C3b,iC3b,C1q,C4b 裂解iC3b为C3dg,清除免疫复合物,促进吞噬作用,抑制T细胞增殖 [21] CR2(CD21) iC3b,C3dg,C3d B细胞中有效的共刺激分子,调控B细胞 [22] CR3(CD11b) iC3b,CFH 促进调理作用 [23] CR4(CD11b) iC3b 促进调理作用 [23] 2.1 补体系统对肿瘤的免疫监视作用
补体可以促进免疫监视并抑制肿瘤进展,在抗肿瘤B细胞发挥免疫效应过程中承担重要角色。在CD4+T细胞以及抗原提呈细胞的协同下,补体可以促进B细胞对肿瘤细胞的可溶性抗原或者膜表达抗原做出应答反应,并促进肿瘤抗体的产生。CR2是C3d的受体,可在B淋巴细胞、滤泡树突状细胞、T淋巴细胞和上皮细胞表达。由免疫原性细胞死亡引发的补体CR2信号可以降低激活B细胞阈值进而调节该B细胞亚群。CR2可以在两个层面上调节B细胞的功能:B细胞上的CR2提供直接信号;在亲和成熟过程中,滤泡树突状细胞通过CR2捕获并向B细胞递送C3调理抗原。CD55在肿瘤中的异质性表达决定了B细胞在化疗中的不同效应。补体蛋白及其受体参与抗原提呈细胞(antigen-presenting cell,APC)与T细胞相互作用的不同阶段,APC可产生C3并表达C3aR和C5aR。C3或C3aR缺陷的APC在诱导T细胞免疫反应方面的效力要低得多。当APC呈递抗原给T细胞后,T细胞上的C5aR是其增殖所必需的。C5a与T细胞上的C5aR结合既有抗凋亡作用,又有促增殖作用。补体也可以通过典型的激活途径产生MAC攻膜复合物导致肿瘤细胞的裂解。在卵巢癌小鼠模型中,低水平的C5a参与了M1巨噬细胞和NK细胞的募集。
2.2 补体系统促进肿瘤的免疫抑制效应
2.2.1 补体蛋白对肿瘤微环境中各成分的影响
肿瘤微环境中补体过度激活影响多种免疫调节途径,是炎症、免疫抑制和肿瘤进展之间的关键环节。失衡的补体通过维持局部免疫抑制和慢性炎症在肿瘤促进中起着关键作用[11]。在宫颈癌、结直肠癌、黑色素瘤和肺癌等动物模型中发现,C3aR和C5aR1介导的信号通路通过激活和极化天然免疫细胞、抑制效应T细胞和释放促肿瘤因子来促进肿瘤微环境向有利于肿瘤进展方向转化。不同的补体衍生效应分子及其下游信号参与肿瘤的转化及进展,包括增殖、基质重塑、迁移、血管生成、侵袭和转移等[10]。
肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)可以通过多种途径促进肿瘤的发展[12-13],如调节肿瘤细胞的运动和侵袭力、抑制抗肿瘤免疫、重塑细胞外基质和促进血管生成。有研究证实[14],C5aR1可以抑制Th1的产生,将TAMs转化为M2表型。C1q在体外可以诱导巨噬细胞产生耐受/免疫抑制的表型,即有利于M2极化,这与PD-L1和PD-L2的上调以及T细胞的增殖减少有关。C1q还通过抑制T细胞的增殖和调节CD8+T细胞的线粒体代谢对T细胞产生直接作用。髓源性抑制细胞(myeloid-derived suppressor cell,MDSC)是一种有效的抗肿瘤免疫抑制剂,能促进肿瘤血管生成,影响树突状细胞的抗原提呈能力、T细胞应答、巨噬细胞极化和NK细胞毒作用。C5a/C5aR1对单核细胞的激活和对MDSC的募集可能与C5a良好的趋化性和MDSC表面整合素表达的改变有关,这对肿瘤中MDSC的免疫抑制功能非常重要[14]。在无瘤模型中,C3a和C5a在体外通过转化生长因子β1依赖的机制抑制调节性T细胞(Treg)的诱导[15],然而,在转移性乳腺癌模型中,C5aR1缺乏会导致血液和肺中Treg的数量减少,并降低小鼠的肺转移瘤负荷。在HPV诱导的同基因肿瘤模型中,C5aR1 拮抗剂显著增加了CD8+T细胞对肿瘤杀伤,且这种效应在中和CD8+T细胞抗体后完全消除。在小鼠黑色素瘤和乳腺癌模型中,CD8+T细胞自分泌产生的C3可以抑制IL-10的表达,而IL-10在CD8+T细胞的扩增和杀伤活性中有重要地位。CD4+T细胞包括几个亚群,其中Th1细胞具有抗肿瘤活性而Th2细胞具有促癌特性,Th1/Th2细胞比率是某些恶性肿瘤的预后因素。在乳腺癌小鼠模型中,C5a可以调节CD4+T细胞的极化。此外,小鼠肺癌模型也证实C3a通过与CD4+T细胞表面的C3aR结合而下调CD4+T细胞的抗肿瘤反应[2]。
2.2.2 补体促进肿瘤转移
许多研究证实,软脑膜转移瘤细胞产生的C3可以破坏血脑屏障[16],而且软脑膜转移瘤患者的C3水平高于脑实质转移瘤患者。C3不仅在原发灶肿瘤细胞的免疫调节或信号转导中发挥重要作用,而且在转移前的肿瘤微环境中也发挥重要作用,可以促进肿瘤细胞在转移靶器官中的种植。一些研究证实了VEGFR1和MDSCs也参与此过程,在MDSCs中表达的C5aR1有利于肿瘤细胞转移到不同靶器官,用C5aR1拮抗剂(PMX-53)处理后的野生型或C5aR1缺陷小鼠的肝、肺转移较少。此外,补体可以诱导金属蛋白酶、增加应力纤维和丝状纤维的表达以及降解细胞外基质进而调节肿瘤细胞的运动和侵袭。
2.2.3 补体有利于肿瘤血管生成
肿瘤血管的生成几乎存在于所有肿瘤发展过程中[17],补体与血管生成和肿瘤生长相关。C5aR1和C3aR可以促进MDSC和TAMs分泌多种血管生成因子,而间接促进肿瘤血管生成。C3a和C5a可上调血管内皮生长因子(vascular endothelial growth factor,VEGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,BFGF)等生长因子的表达,从而促进内皮细胞的增殖[11]。在转基因卵巢癌模型中,C3-/-和C5aR-/-会导致肿瘤血管生成受损,血管通透性增加[16],但对微血管密度无影响。C1q可由内皮细胞以一种非典型的方式产生,通过调节 VEGFs及其受体的表达参与肿瘤新生血管的形成[1],C1q缺乏可导致肿瘤微血管密度降低或血管结构紊乱。
3. 靶向补体与肿瘤免疫治疗
靶向补体有助于克服免疫抑制从而产生抗肿瘤免疫反应。事实上,补体效应具有环境依赖性。在效应性T细胞存在的情况下,补体有助于抗肿瘤;而当其他细胞占主导地位时,补体蛋白有利于肿瘤进展[18]。因此,确定补体靶向的特定信号通路、效应分子和肿瘤类型是非常重要的,将指导临床肿瘤免疫治疗。
3.1 补体蛋白与单克隆抗体
在靶向治疗单克隆抗体中,补体通过抗体依赖的细胞毒作用(antibody-dependent cytotoxicity,ADC)、抗体依赖细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)、补体依赖的细胞毒作用(complement dependent cytotoxicity,CDC)[19-20]、补体依赖细胞介导的细胞毒作用(complement dependent cell-mediated cytotoxicity,CDCC)等途径发挥抗肿瘤作用[21]。其中,利妥昔单抗是靶向CD20的人鼠嵌合单抗,主要通过ADCC发挥抗肿瘤作用。编辑只与C1q或其他补体结合而不与FcγRs结合的Fc片段,可以促进CDCC在单克隆抗体治疗中的作用。结果表明,CDCC清除肿瘤细胞的能力与ADCC相近。此外,CDCC作用易受靶细胞表面抗原的密度、补体调节蛋白水平和补体耗竭等多种因素的影响。深入了解补体效应分子的作用机制,合理优化这些效应,可能会提高单抗的临床疗效[22]。奥法木单抗是靶向CD20的人源化单抗,在白血病模型中[23],表现出比利妥昔单抗更强的CDC相关细胞毒作用。
3.2 靶向补体调节蛋白
然而,补体在单克隆抗体治疗中的作用是复杂的,已经观察到mCRPs和sCRPs参与了肿瘤逃避补体攻击过程,这可能会阻碍补体的抗肿瘤作用。一项研究表明套细胞淋巴瘤对利妥昔单抗的耐药性与淋巴瘤细胞表面高水平的CD55和CD59有关[24]。基于此类问题,特异性靶向补体调节蛋白也可能成为安全有效的治疗策略。在多发性骨髓瘤模型中,证实了靶CD46免疫治疗的疗效,并取得显著成果[7]。靶向CD46的免疫治疗可有效地杀伤腺癌细胞和神经内分泌前列腺癌细胞,有望成为治疗转移性去势抵抗性前列腺癌和腺癌的不错选择。
3.3 靶向补体的联合免疫治疗
在肺癌模型,C5aR1拮抗剂与PD-1抑制剂联合应用在提高抗肿瘤免疫方面显示出协同作用[25]。C5aR1单克隆抗体(IPH5401)与抗PDL1德瓦鲁单抗(durvalumab)联合治疗晚期实体肿瘤(STELLA-001,NCT03665129)的I期临床试验已经开展。此外,C5aR1拮抗剂PMX-53在鳞癌化疗模型中促进了抗肿瘤T细胞反应,显示出协同作用[26]。
4. 结语
补体系统可以通过细胞毒作用以及参与适应性免疫等途径对肿瘤实行免疫监视,但大量研究显示补体激活在肿瘤进展、血管生成以及免疫逃逸中有至关重要的作用。本文揭示了补体蛋白与肿瘤免疫之间的相互作用,以及补体作为抗肿瘤潜在免疫治疗靶点的前景。补体调节是补充现有抗肿瘤药物和设计新的抗肿瘤治疗药物的一个很有前途的潜在靶点。虽然有数据显示靶向补体与其他抗肿瘤疗法具有协同作用,但在这些研究中确认联合治疗的安全性还为时过早,需要进一步深入的研究以及大量的临床试验。
-
表 1 部分重要补体蛋白成分及其功能效应
补体蛋白 受体 功能效应 参考文献 C3a C3aR 过敏毒素,激活CD4+T细胞,促进肿瘤转移,促进肿瘤相关血管生成 [10-11] C5a C5aR1,C5aR2 过敏毒素,激活CD4+T细胞,促进肿瘤转移,促进肿瘤相关血管生成 [1] C3b CD46,CFH,CR1 调理素,参与形成C3、C5转化酶 [12] Factor H C3b,C3d 裂解C3b,促进旁路途径C3转化酶灭活 [13] Factor I CFH,CR1,CD46, C3b,C4b 裂解C3b,裂解C4b [14] Factor B C3b 参与C3转化酶、C5转化酶形成,凋亡诱导因子 [15-16] CD46 C3b,C4b 裂解 C3b 和 C4b,促进C3转化酶的灭活,激活CD4+T细胞 [17-18] CD55 C4b2a,C3bBb 促进C3转化酶的灭活 [19] CD59 C8 抑制MAC组装 [20] CR1(CD35) C3b,iC3b,C1q,C4b 裂解iC3b为C3dg,清除免疫复合物,促进吞噬作用,抑制T细胞增殖 [21] CR2(CD21) iC3b,C3dg,C3d B细胞中有效的共刺激分子,调控B细胞 [22] CR3(CD11b) iC3b,CFH 促进调理作用 [23] CR4(CD11b) iC3b 促进调理作用 [23] -
[1] Roumenina LT, Daugan MV, NoéR, et al. Tumor cells hijack macrophage-produced complement C1q to promote tumor growth[J]. Cancer Immunol Res, 2019, 7(7):1091-1105.
[2] Kwak JW, Laskowski J, Li HY, et al. Complement activation via a C3a receptor pathway alters CD4(+) T lymphocytes and mediates lung cancer progression[J]. Cancer Res, 2018, 78(1):143-156. DOI: 10.1158/0008-5472.CAN-17-0240
[3] Aykut B, Pushalkar S, Chen R, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL[J]. Nature, 2019, 574(7777):264-267.
[4] Hajishengallis G, Reis ES, Mastellos DC, et al. Novel mechanisms and functions of complement[J]. Nat Immunol, 2017, 18(12):1288-1298. DOI: 10.1038/ni.3858
[5] Szilvia Lukácsi, Tamás Gerecsei, Katalin Balázs, et al. The differential role of CR3(CD11b/CD18) and CR4 (CD11c/CD18) in the adherence, migration and podosome formation of human macrophages and dendritic cells under inflammatory conditions[J]. PLoS One, 2020, 15(5):e0232432. DOI: 10.1371/journal.pone.0232432
[6] Parsons ES, Stanley GJ, Pyne ALB,et al. Single-molecule kinetics of pore assembly by the membrane attack complex[J]. Nat Commun, 2019, 10(1):2066. DOI: 10.1038/s41467-019-10058-7
[7] Sherbenou DW, Aftab BT, Su Y, et al. Antibody-drug conjugate targeting CD46 eliminates multiple myeloma cells[J]. J Clin Invest, 2016, 126(12):4640-4653. DOI: 10.1172/JCI85856
[8] Wagner C, Ochmann C, Schoels M, et al. The complement receptor 1, CR1 (CD35), mediates inhibitory signals in human T-lymphocytes[J]. Mol Immunol, 2006, 43(6):643-651. DOI: 10.1016/j.molimm.2005.04.006
[9] Toapanta FR, Ross TM. Complement-mediated activation of the adaptive immune responses: role of C3d in linking the innate and adaptive immunity[J]. Immunol Res, 2006, 36(1-3):197-210. DOI: 10.1385/IR:36:1:197
[10] Reis ES, Mastellos DC, Ricklin D, et al. Complement in cancer: untangling an intricate relationship[J]. Nat Rev Immunol, 2018, 18(1):5-18. DOI: 10.1038/nri.2017.97
[11] Roumenina LT, Daugan MV, Petitprez F, et al. Context-dependent roles of complement in cancer[J]. Nat Rev Cancer, 2019, 19(12):698-715. DOI: 10.1038/s41568-019-0210-0
[12] Cassetta L, Pollard JW. Targeting macrophages: therapeutic approaches in cancer[J]. Nat Rev Drug Discov, 2018, 17(12):887-904. DOI: 10.1038/nrd.2018.169
[13] Hambardzumyan D, Gutmann DH, Kettenmann H. The role of microglia and macrophages in glioma maintenance and progression[J]. Nat Neurosci, 2016, 19(1):20-27. DOI: 10.1038/nn.4185
[14] Ding P, Li L, Li L, et al. C5aR1 is a master regulator in colorectal tumorigenesis via immune modulation[J]. Theranostics, 2020, 10(19):8619-8632. DOI: 10.7150/thno.45058
[15] Nabizadeh JA, Manthey HD, Panagides N, et al. C5a receptors C5aR1 and C5aR2 mediate opposing pathologies in a mouse model of melanoma[J]. Faseb J, 2019, 33(10):11060-11071. DOI: 10.1096/fj.201800980RR
[16] Boire A, Zou Y, Shieh J, et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis[J]. Cell, 2017, 168(6):1101-1113. DOI: 10.1016/j.cell.2017.02.025
[17] Li Y, Qu X, Cao B, et al. Selectively suppressing tumor angiogenesis for targeted breast cancer therapy by genetically engineered phage[J]. Adv Mater, 2020, 32(29):e2001260. DOI: 10.1002/adma.202001260
[18] Andrea Facciabene, Francesco De Sanctis, Stefano Pierini, et al. Local endothelial complement activation reverses endothelial quiescence, enabling T-cell homing, and tumor control during T-cell immunotherapy[J]. Oncoimmunology, 2017, 6(9):e1326442. DOI: 10.1080/2162402X.2017.1326442
[19] García Muñoz R, Izquierdo-Gil A, Muñoz A,et al. Lymphocyte recovery is impaired in patients with chronic lymphocytic leukemia and indolent non-hodgkin lymphomas treated with bendamustine plus rituximab[J]. Ann Hematol, 2014, 93(11):1879-1887. DOI: 10.1007/s00277-014-2135-8
[20] Oostindie SC, van der Horst HJ, Lindorfer MA, et al. CD20 and CD37 antibodies synergize to activate complement by Fc-mediated clustering[J]. Haematologica, 2019, 104(9):1841-1852. DOI: 10.3324/haematol.2018.207266
[21] Torka P, Barth M, Ferdman R, et al. Mechanisms of resistance to monoclonal antibodies (mAbs) in lymphoid malignancies[J]. Curr Hematol Malig Rep, 2019, 14(5):426-438.
[22] Rob N de Jong, Frank J Beurskens, Sandra Verploegen, et al. A novel platform for the potentiation of therapeutic antibodies based on antigen-dependent formation of IgG hexamers at the cell surface[J]. PLoS Biol, 2016, 14(1):e1002344. DOI: 10.1371/journal.pbio.1002344
[23] Jabbour E, Richard-Carpentier G, Sasaki Y, et al. Hyper-CVAD regimen in combination with ofatumumab as frontline therapy for adults with philadelphia chromosome-egative B-cell acute lymphoblastic leukaemia: a single-arm, phase 2 trial[J]. Lancet Haematol, 2020, 7(7):e523-e533. DOI: 10.1016/S2352-3026(20)30144-7
[24] Barth MJ, Mavis C, Czuczman MS, et al. Ofatumumab exhibits enhanced in vitro and in vivo activity compared to rituximab in preclinical models of mantle cell lymphoma[J]. Clin Cancer Res, 2015, 21(19):4391-4397. DOI: 10.1158/1078-0432.CCR-15-0056
[25] Ajona D, Ortiz-Espinosa S, Moreno H, et al. A combined PD-1/C5a blockade synergistically protects against lung cancer growth and metastasis[J]. Cancer Discov, 2017, 7(7):694-703. DOI: 10.1158/2159-8290.CD-16-1184
[26] Medler TR, Murugan D, Horton W,et al. Complement C5a fosters squamous carcinogenesis and limits T cell response to chemotherapy[J]. Cancer Cell, 2018, 34(4):561-578. DOI: 10.1016/j.ccell.2018.09.003
-
期刊类型引用(9)
1. 朱丽,郑丽文,王广梅,李运曼,蔡宝昌,李文婷,毛旭华. 竹节参皂苷调控核因子κB信号通路对肺癌大鼠的影响. 世界中医药. 2024(02): 166-171 .  百度学术
百度学术
2. 古伟汉,刘剑锋,闫岩,周仁龙. 基于生物信息学研究补体C3在肾透明细胞癌中的表达及临床价值. 生物化工. 2024(04): 62-67 .  百度学术
百度学术
3. 张拓,尹令丝,杨苗苗. 血清C3、C4对多发性骨髓瘤患者预后的预测价值及阈值效应分析. 中国实验血液学杂志. 2024(06): 1764-1770 .  百度学术
百度学术
4. 罗斌,王衍鸿,刘佳君,刘诗卉,陆鑫熠,李佳轩,阙祖俊,田建辉. 肺积方调控补体相关蛋白CFHR5/MBL2/C9抑制肺癌细胞迁移、侵袭及动物模型肺转移. 中国肿瘤生物治疗杂志. 2024(12): 1194-1203 .  百度学术
百度学术
5. 徐紫薇,李菲,陶恒,李雪婷,陆进. 卵巢癌关键基因的筛选及其与免疫细胞浸润的相关性分析. 生物医学转化. 2023(01): 84-92 .  百度学术
百度学术
6. 张琴琴,王俊楠,林厚民,伍莹,谭月梅,李明洲,金俊飞,王宁霞,洪勇. 补体3在乳腺癌中的表达差异及临床意义的生物信息学分析. 中华普通外科学文献(电子版). 2023(04): 271-277 .  百度学术
百度学术
7. 罗仍卓么,王晋鹏,焦鹏,李彦霞,董益闻,魏大为,王兴平. 奶牛乳腺炎模型的建立及炎症相关因子基因mRNA转录水平的分析. 畜牧兽医学报. 2022(08): 2763-2772 .  百度学术
百度学术
8. 杜家笑,刘其伟,卜旺雨,晁玮霞,伍当柔,郭苒,朱巧晴,李孟祥,高社干,齐义军. 食管鳞癌中差异表达的N-连接糖蛋白鉴定. 食管疾病. 2022(03): 177-182 .  百度学术
百度学术
9. 于洋洋,张宗峰. 补体系统在子宫内膜异位症发生机制中的研究进展. 疑难病杂志. 2021(11): 1183-1188 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载:
