Long-term efficacy and factors influencing BCMA chimeric antigen receptor-T cell treatment in relapsed or refractory multiple myeloma
-
摘要:目的
评价靶向B细胞成熟抗原(B cell maturation antigen,BCMA)嵌合抗原受体T细胞(chimeric antigen receptor-T cell,CAR-T)治疗复发/难治性多发性骨髓瘤(relapsed/refractory multiple myeloma,R/R MM)的长期疗效和安全性。
方法回顾性分析2018年7月至2023年7月在南昌大学第一附属医院接受BCMA CAR-T细胞治疗20例R/R MM患者的临床资料,随访日期截至2023年12月31日。应用Kaplan-Meier生存分析评估患者总生存(overall survival,OS)率和无进展生存(progression-free survival,PFS)率,并统计相关不良反应。
结果20例R/R MM患者,既往中位治疗线数为3(2~6)线,客观缓解率(objective response rate,ORR)为75%,完全缓解(complete response,CR)率为50%;中位随访时间29个月,中位PFS为26个月。10例CR的患者中,5例在末次随访时仍处于缓解状态,缓解持续时间最短为6个月,最长48个月。亚组分析中,髓外浸润、17p缺失遗传学异常和肿瘤高负荷患者PFS显著更差(P<0.05)。细胞因子释放综合征(cytokine release syndrome,CRS)是CAR-T细胞治疗最常见的不良反应,发生率为90%,3~4级CRS的发生率为35%;远期不良反应少,未发生CAR-T细胞治疗相关死亡。
结论BCMA CAR-T细胞是当前R/R MM治疗的有效方案,不良反应可控。髓外浸润和肿瘤高负荷的患者治疗有效,但持久反应欠佳,如何进一步巩固和维持患者的疗效,值得进一步设计前瞻性的临床研究并探究其差异性。
-
关键词:
- 嵌合抗原受体修饰T细胞 /
- 复发/难治 /
- 多发性骨髓瘤
Abstract:ObjectiveTo evaluate the long-term efficacy and safety of B cell maturation antigen (BCMA)-chimeric antigen receptor-T (CAR-T) cells in the treatment of recurrent/refractory multiple myeloma (R/R MM).
MethodsA retrospective analysis was conducted on the clinical data of 20 patients with R/R MM who received BCMA CAR-T-cell therapy at The First Affiliated Hospital of Nanchang University between July 2018 and July 2023. The follow-up period was up to December 31, 2023. Overall survival and progression-free survival (PFS) rates were evaluated using Kaplan–Meier analysis, and adverse effects were recorded.
ResultsOf all 20 cases with R/R MM, the median number of previous treatment lines was three (range: two to six), total objective response rate (ORR) was 75%, and complete response (CR) rate was 50%. The median follow-up duration was 29 months, with a median PFS of 26 months. Among ten patients with CR, five were still in remission at the last follow-up, with the shortest duration of remission being 6 months and the longest being 48 months. In the subgroup analysis, PFS was significantly worse in patients with extramedullary infiltration, high tumor burden, and 17p deletion high-risk cytogenetic features (P<0.05). Cytokine release syndrome (CRS) was the most common (90%) adverse event, and it was mostly mild, with an incidence rate of grade 3 or higher of 35%. Few long-term adverse effects occurred and no CAR-T cell treatment-related deaths were observed.
ConclusionsBCMA CAR-T-cell therapy was effective and safe for patients with R/R MM. Patients with extramedullary diseases and high tumor burden can also benefit from this treatment; however, their persistent response is not satisfactory. It is worth exploring the differences and designing prospective clinical studies to consolidate and maintain the efficacy in these patients.
-
多发性骨髓瘤(multiple myeloma,MM)是一种好发于中老年人的骨髓恶性浆细胞克隆增殖性疾病,发病率位居血液系统恶性肿瘤第2位[1]。尽管蛋白酶体抑制剂、免疫调节药物及单克隆抗体等药物的蓬勃发展显著延长了患者的生存期,但MM仍无法治愈,绝大部分患者最终仍死于疾病复发进展[2]。嵌合抗原受体T细胞(chimeric antigen receptor-T cell,CAR-T)作为一种新的免疫细胞治疗方式,在血液系统肿瘤领域取得了突破性进展[3-4]。B细胞成熟抗原(B cell maturation antigen,BCMA)高水平表达于MM细胞,但在浆细胞和正常组织低表达或不表达,是理想的CAR-T治疗靶点。2016年Ali等[5]首次报道了BCMA CAR-T用于治疗复发/难治性MM(relapsed/refractory multiple myeloma,R/R MM),展现了显著的抗肿瘤活性。随后国内外开展了大量BCMA CAR-T细胞治疗R/R MM的临床研究,总体有效率为73%~100%,国内外已有3款BCMA CAR-T产品获批上市[6-9]。尽管BCMACAR-T疗法展现出高度的治疗潜力,然而由于开发时间较晚,针对CAR-T细胞治疗MM的疗效分析多为短期数据,其长期疗效和安全性数据相对有限。南昌大学第一附属医院从2018年7月开始采用BCMA CAR-T细胞疗法治疗R/R MM患者,最长随访时间近5年,近50%病例随访超过2年。本研究分析在本院接受BCMA CAR-T细胞治疗的MM患者的资料,探讨CAR-T细胞治疗MM的长期疗效和安全性,为R/R MM患者的细胞治疗提供参考。
1. 材料与方法
1.1 临床资料
回顾性分析2018年7月至2023年7月在南昌大学第一附属医院接受BCMA CAR-T细胞治疗并且有完整随访资料的20例患者。其中男性12例(60%),女性8例(40%),所有患者均符合国际骨髓瘤工作组(IMWG)制定的R/R MM诊断标准,且肿瘤表面存在BCMA表达。本研究通过本院医学伦理学委员会审批(批号:IIT[2018]医研伦审第027号)。高危遗传学特征定义为染色体1q21扩增、del(17p)、t(4;14)、t(14;16)和t(14;20)。肿瘤高负荷定义为异常克隆性浆细胞的比例>50%。收集下述临床资料:患者姓名、性别、年龄、疾病类型、体能状况(ECOG)、疾病分期、CAR-T前治疗线数、细胞遗传学异常、骨髓中浆细胞比例、是否合并髓外浆细胞瘤、是否接受过自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)、BCMA CAR-T细胞治疗过程中不良反应等(表1)。
表 1 BCMA CAR-T细胞治疗R/R MM患者的临床资料例序 性别 年龄
(岁)疾病
类型体能
评分(分)R-ISS
分期(期)治疗
线数(线)基因
异常骨髓肿瘤
负荷(%)髓外
病灶ASCT CAR-T
剂量 (106/kg)最佳
疗效CRS
分级(级)ICANS PFS
(月)OS
(月)状态 1 男 67 IgG-κ 1 Ⅲ 2 1q21 17.00 无 否 4.0 CR 2 否 48 48 生存 2 男 71 κ 1 Ⅲ 4 None 31.00 无 否 3.0 CR 2 否 47 50 生存 3 男 57 IgG-κ 2 Ⅲ 3 1q21 45.00 无 否 4.0 CR 3 是 39 40 生存 4 男 54 IgA-κ 2 Ⅲ 2 1q21;del(17p) 12.00 存在 否 4.0 SD 1 否 2 4 死亡 5 女 73 不分泌 1 Ⅲ 3 1q21 18.00 无 否 2.0 CR 2 否 39 39 生存 6 男 62 IgA-λ 1 Ⅲ 2 None 26.00 无 否 2.0 CR 3 否 38 38 生存 7 女 54 IgA-κ 1 Ⅲ 3 1q21;del(17p) 2.00 无 否 2.0 CR 2 否 35 35 生存 8 男 68 IgG-λ 2 Ⅱ 3 t(4;14) 15.60 无 否 1.0 CR 2 否 35 35 生存 9 男 43 IgG-κ 2 Ⅱ 3 None 34.00 存在 否 1.8 VGPR 2 否 26 30 生存 10 女 53 IgG-κ 2 Ⅲ 6 1q21;t(11;14) 6.00 存在 是 2.0 CR 3 是 16 28 死亡 11 女 65 IgG-κ 2 Ⅲ 5 1q21;t(11;14) 45.00 存在 否 2.0 PR 0 否 9 10 死亡 12 女 54 IgA-κ 2 Ⅱ 2 1q21;del(17p) 7.00 无 否 2.0 SD 3 否 2 3 死亡 13 男 65 IgA-λ 2 Ⅲ 5 1q21;del(17p) 4.00 存在 否 2.0 CR 3 否 8 20 生存 14 女 53 IgG-λ 2 Ⅱ 4 del(17p) 35.00 存在 否 2.2 CR 3 否 6 15 死亡 15 男 69 IgG-κ 2 Ⅰ 4 None 22.00 存在 否 2.0 VGPR 2 否 6 6 生存 16 男 51 IgD-λ 2 Ⅲ 4 1q21;t(14;20) 28.00 存在 是 2.0 SD 2 否 5 5 生存 17 男 73 IgD-λ 2 Ⅰ 4 None 1.00 存在 否 2.0 PR 2 否 3 6 死亡 18 男 55 IgG-κ 2 Ⅲ 2 1q21;del(17p) 18.50 存在 否 2.0 VGPR 0 否 3 3 生存 19 女 66 IgG-κ 2 Ⅲ 2 del(17p); t(14;16) 65.00 无 否 2.0 SD 3 否 1 3 死亡 20 女 69 IgG-λ 2 Ⅲ 3 del(17p) 21.00 存在 否 2.0 SD 2 否 3 3 生存 CR:完全缓解;SD:疾病稳定;VGPR:非常好的部分缓解;PR:部分缓解 1.2 方法
1.2.1 BCMA CAR-T细胞制备与回输
患者在CAR-T细胞治疗前2~6周进行外周血单个核细胞采集,经过T细胞分选、活化、基因转染、CAR-T细胞扩增等过程,生产具有4-1BB共刺激结构域的人源化BCMA CAR-T细胞(制备于苏州爱康得和上海华道生物科技有限公司)。所有患者输注CAR-T细胞前均接受氟达拉滨 30 mg/m2×3 d,环磷酰胺750 mg/m2×1 d(FC)方案预处理。CAR-T细胞中位输注量为2(1~4)×106/kg。
1.2.2 疗效评估及不良反应判断标准
参照传统IMWG疗效标准进行疗效评估,包括严格意义完全缓解(stringent complete response,sCR)、完全缓解(complete response,CR)、非常好的部分缓解(very good partial response,VGPR)、部分缓解(partial response,PR)、微小缓解(minimal response,MR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),客观缓解率(objective response rate,ORR)=CR+PR。参照美国国家癌症研究所不良事件通用术语评价标准(CTCAE)5.0 版进行临床常见不良反应分级。细胞因子释放综合征(cytokine release syndrome,CRS)和免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity syndrome,ICANS)分级按照美国移植和细胞质量协会分级标准进行评估。
1.2.3 随访
通过电话、查阅门诊/住院病历等方式随访至2023年12月31日,无失访病例。CAR-T输注后1、3、6、12个月及后续每年评估肿瘤情况。总生存期(overall survival,OS)定义为从开始CAR-T输注至任何原因引起死亡或随访终点的时间。无进展生存期(progression-free survival,PFS)定义为CAR-T输注至再次疾病进展、死亡或随访终点的时间间隔。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。应用Kaplan-Meier绘制生存曲线,Log-rank法进行单因素分析。以P<0. 05为差异具有统计学差异。
2. 结果
2.1 患者基线特征
本研究20例R/R MM患者中,男性12例(60%),女性8例(40%),年龄分布在43~73岁,中位年龄为63.5岁。年龄<60岁患者9例(45%),年龄≥60岁患者11例(55%)。按照M蛋白类型分类,IgG-κ型8例,IgG-λ型3例,IgA-κ型3例,IgA-λ型2例,IgD-λ型2例,轻链κ型1例,不分泌型1例。伴髓外病变的MM患者11例(55%)。接受过ASCT患者2例(10%),16例(80%)R-ISS达到Ⅲ期,15例(75%)具有高危细胞遗传学异常,7例具有del(17p)基因异常。接受CAR-T治疗前治疗线数中位数为3(2~6)线。
2.2 患者疗效
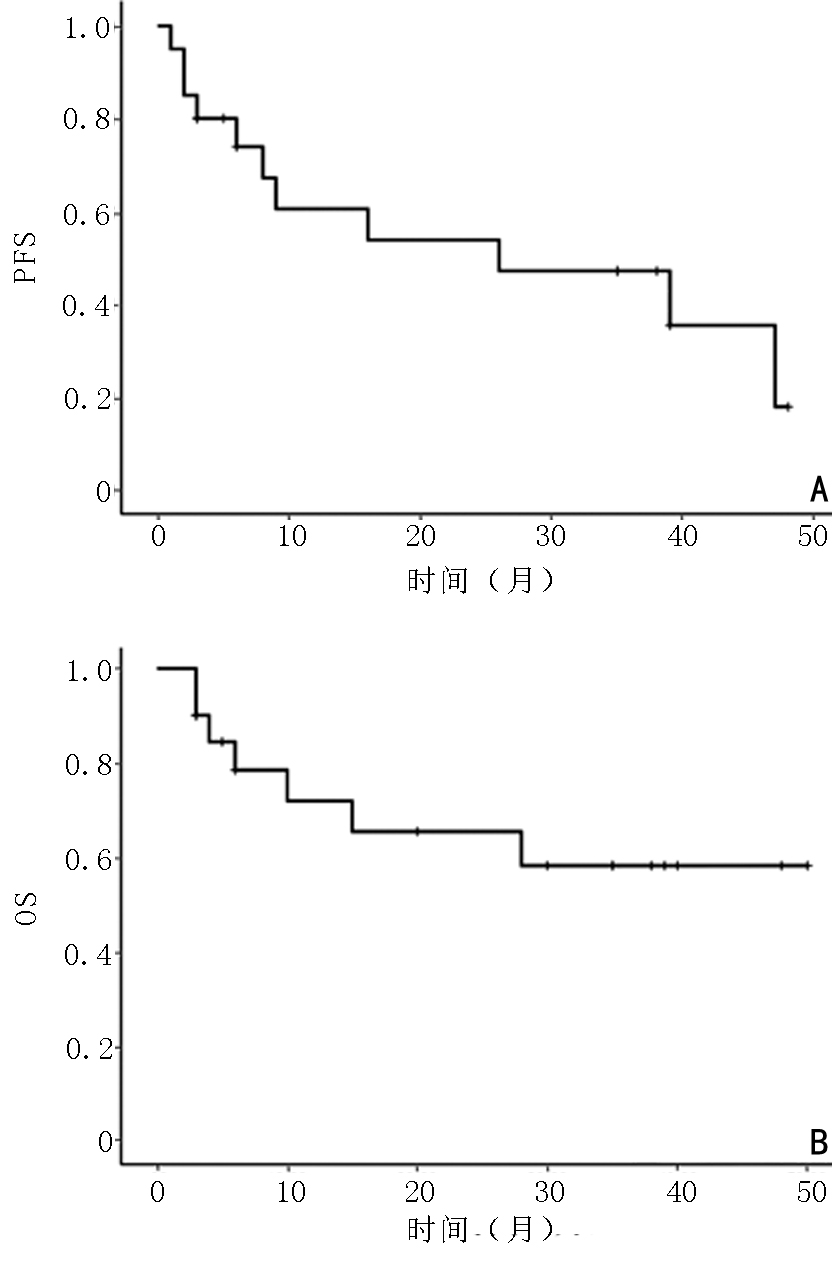
截至2023年12月31日,20例患者中位随访时间为29(3~50)个月,CAR-T细胞治疗的ORR为75%(15/20),CR率为50%(10/20),VGPR率为15%(3/20),PR率为10%(2/20),治疗反应评估为SD或PD患者占25%(5/20),见表1。所有接受BCMA CAR-T细胞治疗的20例患者中位OS尚未达到,中位PFS为26个月,CAR-T细胞治疗后患者6个月 OS为78.3%±9.7%,PFS为73.8%±10.2%;1年总OS为65.3%±11.7%,PFS为53.7%±12.4%;至本次随访结束,OS为58%±12.4%,PFS为35.2%±13.8%(图1)。
2.3 长期生存情况影响因素
至本次随访结束,CAR-T细胞输注后3个月达到≥CR缓解中位PFS为(47.0±14.7)个月,未达CR患者中位PFS为(9.0±4.5)个月;CAR-T细胞输注后3个月达到≥CR缓解患者中位OS未达到,未达到CR患者中位OS为(6.0±2.7)个月。BCMA CAR-T细胞治疗后获得完全缓解与未获完全缓解患者OS和PFS差异均具有统计学意义(均P<0.05)。结果提示,BCMA CAR-T细胞治疗后获得CR的患者OS率和PFS率显著更高。
与无髓外病变患者相比,髓外病变患者的中位PFS[(47.0±6.2)个月 vs. (9.0±1.5)个月,P=0.02]显著更差;肿瘤高负荷患者中位PFS[(39.0±14.6)个月vs. (2.0±0.8)个月,P=0.009]更差;性别、年龄、疾病分期和细胞遗传学高危与PFS无关(P>0.05);但将细胞遗传学危险因素细分,p53缺失遗传学高危患者中位PFS与较短的PFS有关[(6.0±4.1)个月 vs. (39.0±9.6)个月,P=0.011]。高肿瘤负荷患者OS显著更差(P=0.004),未发现其他基线特征(性别、年龄、疾病分期、细胞遗传学高危、髓外情况)与OS存在统计学关联(P>0.05),见表2。。
表 2 20例接受BCMA CAR-T的R/R MM患者预后影响因素分析因素 例数(例) 中位OS(月) P 中位PFS(月) P 性别 0.441 0.528 男 12 NA 39 女 8 28 16 年龄(岁) 0.445 0.197 >60 11 NA 30 ≤60 9 28 20 骨髓肿瘤负荷 0.004 0.009 >50% 3 3 2 ≤50% 17 NA 39 疾病分期(期) 0.387 0.666 Ⅰ~Ⅱ 5 NA 39 Ⅲ 15 NA 16 髓外病灶 0.148 0.020 有 11 15 9 无 9 NA 47 高危遗传学异常 0.387 0.786 有 15 NA 16 无 5 NA 47 del(17p) 0.051 0.011 有 7 15 6 无 13 NA 39 最佳缓解情况 0.007 0.011 ≥CR 10 NA 47 ≤VGPR 10 6 9 NA:不适用;CR:完全缓解;VGPR:非常好的部分缓解 2.4 不良反应情况
CRS(90%)和血液学毒性(80%)是所有级别中最常见的不良事件。CRS的发生率大多为低级别(1/2级:55%),7例患者(35%)出现3级CRS。血液学毒性中性粒细胞减少75%,贫血70%,血小板减少65%,此外发热性中性粒细胞减少20%。3~4级血细胞减少较常见,包括中性粒细胞减少70%,贫血60%和血小板减少45%。10%(2/20)的患者出现1级ICANS,发病的中位时间为2天,中位持续时间为3~10天(范围:1~25天)。ICANS发生与CRS事件重叠或发生在CRS事件开始后1周内。1例患者观察到噬血细胞综合征,通过采用托珠单抗和加大皮质类固醇的剂量得到有效控制。6例(30%)患者明确肺部或胃肠道感染,其余患者无明显感染证据,无因重症感染死亡病例。随访至2023年12月31日,未观察到明显长期不良反应。数据截止时,7例(35%)患者在随访期间死亡,死因均为疾病进展或相关并发症,未见早期和晚期不良事件导致的CAR-T细胞治疗相关死亡。
3. 讨论
BCMA CAR-T疗法长期疗效数据相对有限,但已上市产品idecabtagene vicleucel(bb2121,Ide-Cel)和ciltacabtagene autoleucel(LCAR-B38M,Cilta-Cel)已公布长期随访数据。Ide-Cel临床试验数据(NCT03601078)显示,在100例有效性评价患者中,ORR为73%,CR为33%,中位PFS约为8.8个月;国内自主研发的产品Cilta-Cel临床数据(NCT03548207)显示,80例患者获得了早期、持续、深度的缓解,CR率高达83%,随访27个月时PFS率为55%[10-11]。本研究回顾性分析20例R/R MM患者接受BCMA CAR-T细胞治疗的效果,中位随访29个月,ORR为75%,CR率为50%,这与前期BCMA CAR-T报道基本一致[12]。所有患者中位PFS为26个月,获得CR以上疗效的患者1年持续缓解率为80%,OS率约100%,且长期安全性可控,再次证实CAR-T细胞治疗极大改善R/R MM患者的治疗现状。
本研究显示,在BCMA CAR-T治疗后,患者OS和PFS生存曲线未展示稳定的平台期,提示CAR-T治疗后疾病的复发仍不可避免。CAR-T细胞治疗后获CR患者的OS和PFS均高于未获CR患者,提示CAR-T细胞治疗缓解深度是影响长期预后的重要因素。髓外病灶是MM患者的不良预后因素之一,对常规治疗方案反应欠佳,即使在新药时代,其预后无明显改善[13]。多项研究表明,与伴髓外病变和不伴髓外病变的患者相比,靶向BCMA CAR-T细胞治疗的ORR无差异;然而,伴髓外病变的MM患者仍然表现出不良预后,该组患者在相对较短时间内丧失了最佳反应,中位PFS不足6个月[14-15]。本研究11例患者伴发髓外病灶,ORR为73%,中位PFS仅为 9个月,证实髓外病灶可以短期受益于BCMA CAR-T细胞治疗,但长期疗效不佳,后续需要介入其他治疗方法作为巩固治疗,提高患者生存率。浆细胞白血病(plasma cell leukemia,PCL)为少见的MM侵袭性亚型,外周血中存在大量肿瘤性浆细胞。目前,多数相关临床试验均将PCL排除在外,但小样本病例研究仍报道了BCMA CAR-T细胞治疗PCL的突出疗效[16-18]。本研究入组1例既往接受3线化疗的PCL患者,疗效达CR,PFS持续1年余,为R/R PCL患者治疗带来新的希望。
MM的特征是染色体不稳定,细胞遗传学异常对预后有重要影响,其更容易因残留病灶的持续存在而复发。本研究纳入的15例患者具有遗传学高危因素,其ORR、PFS等疗效指标与非遗传学高危患者相当。这一研究结果与Zhang等[15]的Meta分析结果一致,提示CAR-T治疗能克服大部分细胞遗传学异常导致的预后不良,当然也可能跟本研究收集的病例数量有限,随访时间较短,生存基线不统一有关。p53缺失是最常见影响MM患者生存的独立危险因素,将其单独统计,具有p53异常的患者预后显著差于其他患者,提示p53基因异常特征是接受BCMA CAR-T细胞治疗的R/R MM患者预后不良的预测因素。此外,本研究中观察到部分持续数年的缓解患者,无需巩固或维持治疗,尽管随着时间的推移,疾病仍存在继续进展的风险。
尽管CAR-T治疗R/R MM显示出显著的疗效,然而耐药和疾病复发依然是目前临床管理中需要面对和克服的关键难题。CAR-T细胞治疗后疾病复发机制复杂且多样,靶抗原阴性复发主要与抗原丢失或调变有关,靶抗原阳性复发可能与CAR-T细胞持久性有限、免疫抑制性肿瘤微环境等因素有关[19]。在KarMMa研究中,接受BCMA CAR-T细胞输注后复发患者中,近3%检测到BCMA抗原丢失,提示BCMA抗原调变可能并非耐药的最关键因素[8]。γ-分泌酶可介导BCMA从浆细胞脱落,可溶性BCMA可以通过作用于BCMA外包被的scFv来干扰CAR-T细胞,从而发挥抗原掩蔽作用[20]。在BCMA CAR-T细胞治疗后复发的患者中可检测到抗scFv抗体,强调了开发全人源或人源化scFv的重要性。本研究采用人源化CAR-T细胞,降低了免疫原性,或可延长CAR-T细胞在体内的存留时间,这对于R/R MM治疗具有重要价值,是未来突破的方向。此外,在患者免疫抑制较少的疾病早期阶段,细胞治疗的疗效可能更显著。
CAR-T治疗MM的不良反应与其他B细胞肿瘤相似,主要为CRS、血液学毒性和感染[21]。本研究中,CAR-T不良反应以短期不良反应为主,CRS最常见,发生率达90%,3~4 级CRS的发生率为35%,似乎高于同类研究,这可能与患者肿瘤负荷较高、相对较晚使用托珠单抗等药物干预有关。血细胞减少部分原因是清淋化疗的骨髓毒性,但也可能发生延迟或长期的全血细胞减少,推测这与细胞因子对骨髓干细胞、SDF-1水平和其他因素的影响有关[22]。对于CAR-T相关噬血细胞综合征,重点是早期识别和及时治疗,铁蛋白迅速升高是关键的实验室结果[23]。截至目前,观察到的最常见长期不良反应为B细胞耗竭(发育不良)、低丙种球蛋白血症、细胞减少症和感染。相比CD19 CAR-T细胞、BCMA CAR-T细胞导致的B细胞丢失较少;其再生障碍也可能仅是疗效反应,重要的是通过支持治疗进行管理及对其他潜在的不良反应进行管理。
本研究回顾性分析了20例接受CAR-T 细胞治疗的R/R MM患者的长期随访结果,这些数据进一步证明了BCMA CAR-T细胞治疗R/R MM患者可获得持久应答,且安全性可控。髓外浸润、肿瘤高负荷和p53缺失遗传学高危患者治疗有效,但持久反应不佳。本研究病例数有限,且为回顾性单中心分析,如何进一步巩固和维持这些患者的疗效,亟需开展前瞻性、多中心研究,探寻最优方案。
-
表 1 BCMA CAR-T细胞治疗R/R MM患者的临床资料
例序 性别 年龄
(岁)疾病
类型体能
评分(分)R-ISS
分期(期)治疗
线数(线)基因
异常骨髓肿瘤
负荷(%)髓外
病灶ASCT CAR-T
剂量 (106/kg)最佳
疗效CRS
分级(级)ICANS PFS
(月)OS
(月)状态 1 男 67 IgG-κ 1 Ⅲ 2 1q21 17.00 无 否 4.0 CR 2 否 48 48 生存 2 男 71 κ 1 Ⅲ 4 None 31.00 无 否 3.0 CR 2 否 47 50 生存 3 男 57 IgG-κ 2 Ⅲ 3 1q21 45.00 无 否 4.0 CR 3 是 39 40 生存 4 男 54 IgA-κ 2 Ⅲ 2 1q21;del(17p) 12.00 存在 否 4.0 SD 1 否 2 4 死亡 5 女 73 不分泌 1 Ⅲ 3 1q21 18.00 无 否 2.0 CR 2 否 39 39 生存 6 男 62 IgA-λ 1 Ⅲ 2 None 26.00 无 否 2.0 CR 3 否 38 38 生存 7 女 54 IgA-κ 1 Ⅲ 3 1q21;del(17p) 2.00 无 否 2.0 CR 2 否 35 35 生存 8 男 68 IgG-λ 2 Ⅱ 3 t(4;14) 15.60 无 否 1.0 CR 2 否 35 35 生存 9 男 43 IgG-κ 2 Ⅱ 3 None 34.00 存在 否 1.8 VGPR 2 否 26 30 生存 10 女 53 IgG-κ 2 Ⅲ 6 1q21;t(11;14) 6.00 存在 是 2.0 CR 3 是 16 28 死亡 11 女 65 IgG-κ 2 Ⅲ 5 1q21;t(11;14) 45.00 存在 否 2.0 PR 0 否 9 10 死亡 12 女 54 IgA-κ 2 Ⅱ 2 1q21;del(17p) 7.00 无 否 2.0 SD 3 否 2 3 死亡 13 男 65 IgA-λ 2 Ⅲ 5 1q21;del(17p) 4.00 存在 否 2.0 CR 3 否 8 20 生存 14 女 53 IgG-λ 2 Ⅱ 4 del(17p) 35.00 存在 否 2.2 CR 3 否 6 15 死亡 15 男 69 IgG-κ 2 Ⅰ 4 None 22.00 存在 否 2.0 VGPR 2 否 6 6 生存 16 男 51 IgD-λ 2 Ⅲ 4 1q21;t(14;20) 28.00 存在 是 2.0 SD 2 否 5 5 生存 17 男 73 IgD-λ 2 Ⅰ 4 None 1.00 存在 否 2.0 PR 2 否 3 6 死亡 18 男 55 IgG-κ 2 Ⅲ 2 1q21;del(17p) 18.50 存在 否 2.0 VGPR 0 否 3 3 生存 19 女 66 IgG-κ 2 Ⅲ 2 del(17p); t(14;16) 65.00 无 否 2.0 SD 3 否 1 3 死亡 20 女 69 IgG-λ 2 Ⅲ 3 del(17p) 21.00 存在 否 2.0 SD 2 否 3 3 生存 CR:完全缓解;SD:疾病稳定;VGPR:非常好的部分缓解;PR:部分缓解 表 2 20例接受BCMA CAR-T的R/R MM患者预后影响因素分析
因素 例数(例) 中位OS(月) P 中位PFS(月) P 性别 0.441 0.528 男 12 NA 39 女 8 28 16 年龄(岁) 0.445 0.197 >60 11 NA 30 ≤60 9 28 20 骨髓肿瘤负荷 0.004 0.009 >50% 3 3 2 ≤50% 17 NA 39 疾病分期(期) 0.387 0.666 Ⅰ~Ⅱ 5 NA 39 Ⅲ 15 NA 16 髓外病灶 0.148 0.020 有 11 15 9 无 9 NA 47 高危遗传学异常 0.387 0.786 有 15 NA 16 无 5 NA 47 del(17p) 0.051 0.011 有 7 15 6 无 13 NA 39 最佳缓解情况 0.007 0.011 ≥CR 10 NA 47 ≤VGPR 10 6 9 NA:不适用;CR:完全缓解;VGPR:非常好的部分缓解 -
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249. DOI: 10.3322/caac.21660
[2] Usmani S, Ahmadi T, Ng Y, et al. Analysis of real-world data on overall survival in multiple myeloma patients with ≥3 prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory drug (IMiD), or double refractory to a PI and an IMiD[J]. Oncologist, 2016, 21(11):1355-1361. DOI: 10.1634/theoncologist.2016-0104
[3] Cappell KM, Sherry RM, Yang JC, et al. Long-term follow-up of anti-CD19 chimeric antigen receptor T-cell therapy[J]. J Clin Oncol, 2020, 38(32):3805-3815. DOI: 10.1200/JCO.20.01467
[4] Amber CK, Jennifer SO. Axicabtagene ciloleucel: The first FDA-approved CAR T-cell therapy for relapsed/refractory large B-cell lymphoma[J]. J Adv Pract Oncol, 2019, 10(8):878-882.
[5] Ali SA, Shi V, Maric I, et al. T cells expressing an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma[J]. Blood, 2016, 128(13):1688-1700. DOI: 10.1182/blood-2016-04-711903
[6] Mullard A. FDA approves second BCMA-targeted CAR-T cell therapy[J]. Nat Rev Drug Discov, 2022, 21(4):249.
[7] Zhao WH, Liu J, Wang BY, et al. A phase 1, open-label study of LCAR-B38M, a chimeric antigen receptor T cell therapy directed against B cell maturation antigen, in patients with relapsed or refractory multiple myeloma[J]. J Hematol Oncol, 2018, 11(1):141. DOI: 10.1186/s13045-018-0681-6
[8] Raje N, Berdeja J, Lin Y, et al. Anti-BCMA CAR T-cell therapy bb2121 in relapsed or refractory multiple myeloma[J]. N Engl J Med, 2019, 380(18):1726-1737. DOI: 10.1056/NEJMoa1817226
[9] Wang D, Wang J, Hu G, et al. A phase 1 study of a novel fully human BCMA-targeting CAR (CT103A) in patients with relapsed/refractory multiple myeloma[J]. Blood, 2021, 137(21):2890-2901. DOI: 10.1182/blood.2020008936
[10] Mi JQ, Zhao WH, Jing HM, et al. Phase Ⅱ, open-label study of ciltacabtagene autoleucel, an anti-B-cell maturation antigen chimeric antigen receptor-T-cell therapy, in Chinese patients with relapsed/refractory multiple myeloma (CARTIFAN-1)[J]. J Clin Oncol, 2023, 41(6):1275-1284. DOI: 10.1200/JCO.22.00690
[11] Lin Y, Raje NS, Berdeja JG, et al. Idecabtagene vicleucel for relapsed and refractory multiple myeloma: post hoc 18-month follow-up of a phase Ⅰ trial[J]. Nat Med, 2023, 29(9):2286-2294. DOI: 10.1038/s41591-023-02496-0
[12] Akhtar OS, Sheeba BA, Azad F, et al. Safety and efficacy of anti-BCMA CAR-T cell therapy in older adults with multiple myeloma: a systematic review and meta-analysis[J]. J Geriatr Oncol, 2024, 15(2):101628. DOI: 10.1016/j.jgo.2023.101628
[13] Bhutani M, Foureau DM, Atrash S, et al. Extramedullary multiple myeloma[J]. Leukemia, 2020, 34(1):1-20. DOI: 10.1038/s41375-019-0660-0
[14] Li W, Liu MJ, Yuan T, et al. Efficacy and follow-up of humanized anti-BCMA CAR-T cell therapy in relapsed/refractory multiple myeloma patients with extramedullary-extraosseous, extramedullary-bone related, and without extramedullary disease[J]. Hematol Oncol, 2022, 40(2):223-232. DOI: 10.1002/hon.2958
[15] Zhang LN, Shen XX, Yu WJ, et al. Comprehensive meta-analysis of anti-BCMA chimeric antigen receptor T-cell therapy in relapsed or refractory multiple myeloma[J]. Ann Med, 2021, 53(1):1547-1559. DOI: 10.1080/07853890.2021.1970218
[16] Deng JJ, Lin YH, Zhao DF, et al. Case report: plasma cell leukemia secondary to multiple myeloma successfully treated with anti-BCMA CAR-T cell therapy[J]. Front Oncol, 2022, 12:901266. DOI: 10.3389/fonc.2022.901266
[17] Li CR, Cao WY, Que YM, et al. A phase Ⅰ study of anti-BCMA CAR T cell therapy in relapsed/refractory multiple myeloma and plasma cell leukemia[J]. Clin Transl Med, 2021, 11(3):e346. DOI: 10.1002/ctm2.346
[18] Li X, Guo X, Zhu YQ, et al. Single-cell transcriptomic analysis reveals BCMA CAR-T cell dynamics in a patient with refractory primary plasma cell leukemia[J]. Mol Ther, 2021, 29(2):645-657. DOI: 10.1016/j.ymthe.2020.11.028
[19] Ruella M, Korell F, Porazzi P, et al. Mechanisms of resistance to chimeric antigen receptor-T cells in haematological malignancies[J]. Nat Rev Drug Discov, 2023, 22(12):976-995. DOI: 10.1038/s41573-023-00807-1
[20] Pont MJ, Hill T, Cole GO, et al. γ-Secretase inhibition increases efficacy of BCMA-specific chimeric antigen receptor T cells in multiple myeloma[J]. Blood, 2019, 134(19):1585-1597. DOI: 10.1182/blood.2019000050
[21] Khanam R, Faiman B, Batool S, et al. Management of adverse reactions for BCMA-directed therapy in relapsed multiple myeloma: a focused review[J]. J Clin Med, 2023, 12(17):5539. DOI: 10.3390/jcm12175539
[22] Jain T, Olson TS, Locke FL. How I treat cytopenias after CAR T-cell therapy[J]. Blood, 2023, 141(20):2460-2469.
[23] 喻敏,张倩,孔繁聪,等.CAR-T细胞治疗后噬血细胞综合征2例报告并文献复习[J].中华血液学杂志,2023,44(5):424-426. DOI: 10.3760/cma.j.issn.0253-2727.2023.05.012 -
期刊类型引用(2)
1. 邓渊尹,王淑杨,杨婷婷,黄河,胡永仙. 中国嵌合抗原受体T细胞治疗恶性血液病临床研究进展. 内科急危重症杂志. 2025(02): 102-107 .  百度学术
百度学术
2. 马涛,蓝颖. 卡非佐米联合地塞米松与泊马度胺治疗复发难治性多发性骨髓瘤的效果及不良反应. 临床合理用药. 2025(13): 84-86 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: