mRNA and Protein Expressions of Transforming Acidic Coiled-Coil Protein3 and its Clinical Significance in Breast Cancer
-
摘要:目的 探讨转录相关酸性卷曲蛋白3(transforming acidic coiled-coil proteins, TACC3)mRNA和蛋白在乳腺癌中的表达及其临床意义。方法 收集手术切除乳腺癌及癌旁正常组织标本各85例, 进行免疫组织化学染色、RT-PCR、Western blot的检测。结果 乳腺癌组织中的TACC3 mRNA和蛋白的表达水平高于癌旁组织(P < 0.05), 且TACC3的表达与乳腺癌的分化程度、肿瘤直径、淋巴结的转移、P53表达相关, 而与患者的年龄、是否绝经、ER、PR、Ki-67、HER-2等无明显相关。结论 TACC3在乳腺癌中的表达程度与临床病理特征有关, 在乳腺癌发生发展过程中可能具有一定的作用。
-
关键词:
- TACC3 /
- 乳腺癌 /
- 免疫组织化学 /
- RT-PCR /
- Western blo
Abstract:Objective This work aims to investigate the mRNA and protein expressions of transforming acidic coiled-coil protein3 (TACC3) as well as its clinical significance in breast cancer.Methods A total of 85 breast cancer tissues and paraneoplastic breast tissues were collected as samples. The mRNA and protein expressions of TACC3 in these tissue samples were determined using reverse transcription-polymerase chain reaction, western blot analysis, and immunohistochemical staining.Results The mRNA and protein expressions of TACC3 were significantly higher in the breast cancer tissues than in the paraneoplastic breast tissues (P < 0.05). The TACC3 expressions were significantly correlated with the degrees of differentiation, tumor sizes, nodal metastasis, and tumor protein 53, but not with the ages of patients, menstrual status, and the expressions of estrogen receptor-positive, progesterone receptor-positive, human epidermal growth factor receptor-2, and Ki-67.Conclusion TACC3 was overexpressed in breast cancer. This result is relevant to the clinicopathological features of the disease. Therefore, TACC3 expression may play a significant role in the onset and progression of breast cancer -
乳腺癌是女性常见的恶性肿瘤之一,其发病率逐年升高,有超过宫颈癌而居女性恶性肿瘤发病率首位的趋势。TACC家族的成员是中心体主轴的组成蛋白,TACC蛋白影响细胞的有丝分裂,调节染色体的稳定性[1]。最近有研究表明,在人类的乳腺和卵巢组织肿瘤中TACC3的表达上调,用紫杉醇治疗宫颈癌和乳腺癌后TACC3的表达明显下调,但机制尚不清楚[2]。本研究通过免疫组织化学、RT-PCR和Western blot联合检测TACC3 mRNA及蛋白在乳腺癌组织中的表达,探讨TACC3 mRNA和蛋白在人类乳腺癌的发生发展中所起的作用及其临床病理意义,为进一步探讨乳腺癌的发生发展的机制提供新的思路和方法。
1. 材料与方法
1.1 材料
1.1.1 研究对象
收集2011年2月至2011年8月间,重庆医科大学附属第一医院内分泌乳腺外科的手术切除乳腺癌组织及距离癌灶5 cm以上癌旁正常组织标本各85例,年龄39~68岁。经术后病理检查均证实为乳腺癌,新鲜标本放入液氮后存放于-80℃保存。病例均征得患者同意并签署相关同意书。
1.1.2 主要试剂和仪器
主要试剂:兔抗人TACC3多克隆一抗购自Epitomics公司,二抗、DAB显色剂、ECL显影液以及免疫组织化学试剂盒购自康为世纪试剂公司,总RNA提取试剂Trizol、反转录试剂盒及Tap酶购自TaKaRa宝生物工程(大连)有限公司,TACC3基因和内参β-actin基因的特异性引物由上海生工生物工程有限公司合成。主要仪器:PCR仪与凝胶成像系统购自Bio-Rad公司;核酸蛋白分析仪购自瑞典安玛西亚公司。
1.2 方法
1.2.1 免疫组织化学方法检测
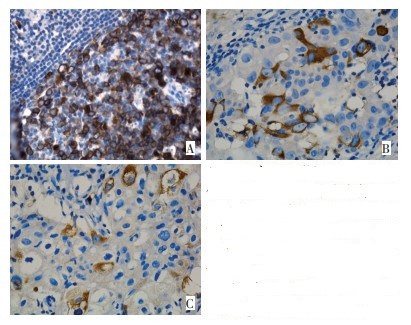
标本经甲醛固定,石蜡包埋,常规制备免疫组织化学石蜡切片。免疫组织化学S-P三步法检测。实验结果判断依据:阳性为细胞质中出现黄棕色,结果以阳性细胞数所占百分比表示,<5%为阴性、≥5%为阳性。每张切片由两名病理医师在双盲法下进行判定,TACC3阳性表达见图 1。
1.2.2 乳腺癌及癌旁正常组织中TACC3 mRNA的表达
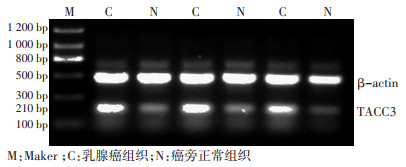
用总RNA提取试剂盒,按照试剂盒所提供的程序从冰冻组织中提取总RNA。分光光度计检测RNA浓度及纯度后,取等量RNA模板加样,使用反转录试剂盒将RNA反转录扩增为cDNA。以β-actin作为内部参照基因,用琼脂糖凝胶电泳比较各组mRNA差异,其中TACC3上游为5'-ATCGTCTGTTCTTCGTGTGTCA-3',下游为5'-TTGGTTCTCTTTCTGTGTCCA G-3',引物大小为210 bp;β-actin上游为5'-CGAGGATCCGGACTTCGAGCAAGAGATGG-3',下 游 为5'-cagtctagagaagcatttgcggtggacg-3',引物大小为500 bp。PCR反应总体积为50 μL,反应体系为2×PCR预混体系25 μL,引物各2 μL,β-actin的cDNA模板各1 μL,去离子水补足至50 μL。扩增循环的参数为:94℃预变性5 min,94℃变性30 s,57℃退火45 s,72℃延伸45 s,扩增35个循环,72℃延伸5 min中止反应。取5 μL PCR产物在2.0%琼脂糖凝胶中电泳,凝胶成像分析系统拍照。
1.2.3 乳腺癌及癌旁组织中TACC3蛋白的表达
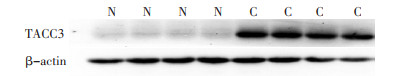
按总蛋白试剂盒提供的程序从冰冻组织中提取总蛋白。分光光度计检测蛋白浓度及纯度后,取等量蛋白加入上样缓冲液并煮沸变性,采用12%SDS-PAGE分离胶,5%SDS-PAGE浓缩胶。取20 μg蛋白样品加入点样孔中,先以80 Ⅴ恒压电泳,至样品进入分离胶后再改为120 Ⅴ,至目的蛋白泳动至距胶下缘1 cm以上停止电泳。再行150 A恒压,100 min转膜。转膜后将硝酸纤维素膜浸入封闭液中1 h,洗膜3次。加入1:1 000 TACC3抗体放置在脱色摇床上4℃孵育过夜。洗膜后加入1:1 000二抗,室温孵育1 h,洗膜3次后将膜放入显色液中,室温下孵育5 min后显影。使用Quantity-one软件分析各个样本TACC3及β-actin表达水平,并且比较TACC3与β-actin的光密度值。
1.3 统计学处理
采用SPSS 17.0统计软件进行数据处理和分析检验,数据以x±s表示,并采用方差分析(ANOVA),P < 0.05表示差异有统计学意义。
2. 结果
2.1 TACC3蛋白免疫组织化学结果
TACC3蛋白阳性主要定位表达于乳腺癌细胞的胞质中。在乳腺癌组织和癌旁正常组织中TACC3蛋白阳性表达率分别为81.2%和14.1%。TACC3蛋白在乳腺癌组织中的表达高于乳腺癌旁正常组织(图 1)。
2.2 TACC3基因扩增的半定量RT-PCR检测结果
TACC3 mRNA在乳腺癌组织中的表达水平明显高于癌旁正常组织(P < 0.05),并且TACC3 mRNA表达在年龄、是否绝经、ER、PR、Ki-67、HER-2方面差异无统计学意义(P>0.05);而在肿瘤分化程度、肿瘤直径、淋巴结转移、P53方面差异具有统计学意义(P < 0.05,表 1,图 2)。
表 1 TACC3 mRNA和蛋白在乳腺癌组织中的表达 x±sTable 1. mRNA and protein expressions of TACC3 in breast cancer
2.3 TACC3蛋白Western blot检测结果
TACC3蛋白在乳腺癌组织中的表达水平明显高于癌旁正常组织(P < 0.05),并且TACC3蛋白表达在年龄、是否绝经、ER、PR、Ki-67、HER-2方面差异无统计学意义(P>0.05);而在肿瘤分化程度、肿瘤直径、淋巴结转移、P53等方面差异具有统计学意义(P < 0.05,表 1,图 3)。
3. 讨论
TACC在中心体处聚集,调控微管蛋白的组成,影响细胞的有丝分裂,调节染色体的稳定性。因TACC具有较高酸性,C末端出现卷曲螺旋区域,并且具有促进细胞转化的能力,所以被命名为酸性卷曲转录相关蛋白。在哺乳动物中有三种TACC蛋白:TACC1,TACC2,TACC3。其中TACC3是一种非机动微管相关蛋白,可维持有丝分裂的稳定性,起稳压适配器的作用[3-4]。
有研究表明,TACC3主要在睾丸、肺、脾、骨髓、胸腺、乳腺等人类增生组织中表达[5]。人类的乳腺和卵巢组织肿瘤中,TACC3表达上调有可能在肿瘤的发生发展中具有潜在意义,因此TACC3可能是乳腺癌或妇科癌症相关基因一个新的修饰位点[6-7],TACC3还可能通过负调控Notch通路介导乳腺上皮细胞及血管的生成,但其具体机制尚不清楚[8]。Piekorz等[9]发现TACC3通过与P53的相互作用,调节P53的功能。在一个正常细胞中,如果TACC3的水平有所改变,纺锤体的功能可能也会受损,此时依赖P53的检查点会检测出未进行有丝分裂,从而在下一个细胞周期触发细胞凋亡通路。在缺乏P53基因的细胞中,细胞无法正常进行有丝分裂,此时TACC3水平的改变并不足以诱导细胞的凋亡,有可能使得基因产生不稳定,而诱发肿瘤的发生。有报道表明,TACC3的过度表达可能与耐药机制、肿瘤进展、细胞增殖和转移有关[10]。本研究收集手术切除乳腺癌及癌旁正常组织标本各85例,进行免疫组织化学染色、RT-PCR、Western blot的检测。结果表明TACC3 mRNA和蛋白在乳腺癌组织中的表达都明显高于癌旁正常组织,经统计学处理分析差异有统计学意义。进一步分析显示TACC3表达与乳腺癌的分化程度、肿瘤直径、淋巴结转移呈正相关,与P53呈负相关,而与患者的年龄、是否绝经、ER、PR、Ki-67、HER-2等无明显相关性。推测TACC3与乳腺癌肿瘤分期、分化程度相关,在判断乳腺癌的临床预后中可能有一定的指导意义,本研究结果支持了TACC3表达可能与乳腺癌的发生发展密切相关。但是关于TACC3还有待进一步深入研究。
综上所述,本研究证明TACC3在乳腺癌和癌旁正常组织中的表达有明显差异,且与乳腺癌的发生发展有关,但对于TACC3参与乳腺癌的发生发展的具体机制目前仍不清楚,有待于进一步研究,并且可能为乳腺癌的预防、诊断和治疗提供新的分子靶点。
-
表 1 TACC3 mRNA和蛋白在乳腺癌组织中的表达 x±s
Table 1 mRNA and protein expressions of TACC3 in breast cancer

-
[1] Wang X, Fredericksen ZS, Vierkant RA, et al. Association of genetic variation in mitotic kinases with breast cancer risk[J]. Breast Can cer Res Treat, 2010, 119(2): 453-462. DOI: 10.1007/s10549-009-0404-3
[2] Yim EK, Tong SY, Ho EM, et al. Anticancer effects on TACC3 by treatment of paclitaxel in HPV-18 positive cervical carcinoma cells [J]. Oncol Rep, 2009, 21(2): 549-557.
[3] Hood FE, Royle SJ. Pulling it together: The mitotic function of TACC3[J]. Bioarchitecture, 2011, 1(3): 105-109. DOI: 10.4161/bioa.1.3.16518
[4] Schneider L, Essmann F, Kletke A, et al. The transforming acidic coiled coil 3 protein is essential for spindle-dependent chromosome alignment and mitotic survival[J]. J Biol Chem, 2007, 282(40): 29273-29283. DOI: 10.1074/jbc.M704151200
[5] Aitola M, Sadek CM, Gustafsson JA, et al. Aint/Tacc3 is highly expressed in proliferating mouse tissues during development, spermatogenesis, and oogenesis[J]. J Histochem Cytochem, 2003, 51(4): 455-469. DOI: 10.1177/002215540305100407
[6] Raff JW. Centrosomes and cancer: lessons from a TACC[J]. Trends Cell Biol, 2002, 12(5): 222-225. DOI: 10.1016/S0962-8924(02)02268-7
[7] Lauffart B, Vaughan MM, Eddy R, et al. Aberrations of TACC1 and TACC3 are associated with ovarian cancer[J]. BMC Womens Health, 2005, 5: 8. DOI: 10.1186/1472-6874-5-8
[8] Booth DG, Hood FE, Prior IA, et al. A TACC3/ch-TOG/clathrin complex stabilises kinetochore fibres by inter-microtubule bridging [J]. EMBO J, 2011, 30(5): 906-919. DOI: 10.1038/emboj.2011.15
[9] Piekorz RP, Hoffmeyer A, Duntsch CD, et al. The centrosomal protein TACC3 is essential for hematopoietic stem cell function and genetically interfaces with p53-regulated apoptosis[J]. EMBO J, 2002, 21(4): 653-664. DOI: 10.1093/emboj/21.4.653
[10] Gómez-Baldó L, Schmidt S, Maxwell CA, et al. TACC3-TSC2 maintains nuclear envelope structure and controls cell division[J]. Cell Cycle, 2010, 9(6): 1143-1155. DOI: 10.4161/cc.9.6.11018



 下载:
下载: