Expressions of Nestin and CD34 in Human Glioma and Their Correlations with Prognosis
-
摘要:目的 研究人脑胶质瘤巢蛋白(nestin)和CD34表达与预后的关系。方法 采用免疫组化方法检测63例人脑胶质瘤中的nestin、CD34的表达情况,并将结果与临床预后随访结果进行综合分析。结果 nestin总阳性表达率为71.4%,其中强表达16例(25.4%),中度表达14例(22.2%),弱表达15例(23.8%),不表达18例(28.6%),统计有显著性差异(P < 0.01)。nestin表达水平与胶质瘤恶性程度相关(χ2=41.44,P < 0.01)。胶质瘤Ⅰ级、Ⅱ级、Ⅲ级~Ⅳ级CD34标记的平均微血管密度(micro vessels density,MVD)分别为(35±14)、(69±33)、(119±49)个,具有显著性差异(P < 0.01)。CD34表达与nestin表达水平相关(P < 0.01)。nestin表达与生存时间负相关(P < 0.01)。结论 CD34和nestin表达有一定相关性,CD34与脑胶质瘤新生血管生成有关。CD34、nestin联合检测可准确判断患者的预后。Abstract:Objective We investigated the expressions of nestin and CD34 in human glioma and their correlations with prognosis.Methods Immunohistochemistry assay was conducted on the expressions of nestin and CD34 in 63 specimens of human gliomas. We also analyzed the influence of nestin expression on survival rate.Results Strong expressions of nestin were observed in 16 of the 63 cases(25.4%). Moderate expressions were observed in 14 cases (22.2%) and weak expressions in 15 cases (23.8%). No expressions were found in the remaining 18 cases (28.6%). Statistically significant differences existed among these groups (P < 0.01). The expression of nestin increased with higher pathological grades (χ²=41.44; P < 0.01). The microvessel densities of positive CD34 cells were 35 ± 14, 69 ± 33, 119± 49 for grade Ⅰ, Ⅱ, and Ⅲ–Ⅳ gliomas, respectively. Statistically significant differences existed among these groups (P < 0.01). CD34 and survival time were significantly and negatively correlated with the expression level of nestin (P < 0.01), respectively.Conclusion The expressions of CD34 have definite correlations with nestin. CD34 is correlated with the formation of neo-vessels in gliomas. The expressions of nestin and CD34 can be used for accurately assessing the prognosis of glioma patients.
-
Keywords:
- Nestin /
- CD34 /
- Glioma /
- Immunohistochemistry /
- Prognosis
-
胶质瘤是中枢神经系统最常见的原发性肿瘤, 其发生和发展都伴随着血管系统的形成; 而血管增生是胶质瘤恶变的重要标志, 血管的增生程度是胶质瘤分级的重要指标之一。巢蛋白(nestin)是第Ⅵ类中间丝(intermediate filament, IF), 主要在神经和肌肉的干细胞或前体细胞中表达; 随着细胞分化成熟, 表达逐渐减低, 分化完成后消失[1]; 但胶质瘤中nestin呈现返祖性表达[2]。另外, nestin在新生血管内皮细胞中阳性细胞, 可以作为血管内皮细胞的标记, 也有报道称其参与了脑组织的血管发生[3]。CD34在肿瘤间质小血管的表达作用已得到证实, 目前普遍认为它是血管内皮细胞的首选标记物, 能清晰显示肿瘤微血管[4]。本研究选取63例人脑胶质瘤患者的瘤组织标本, 对nestin表达及其与血管生成及与其临床预后的关系进行了研究, 现报告如下。
1. 材料与方法
1.1 材料
1.1.1 病例资料
研究对象为河北省河北医科大学第二医院神经外科和沧州中西医结合医院神经外科2006年5月至2011年10月住院手术切除且保存完好的胶质瘤组织的石蜡包埋标本, 临床资料完整, 男性33例, 女性30例, 脑胶质瘤组织学分析根据2000年修改的WHO神经系统肿瘤分级标准对其进行组织学的分类分级, 其中Ⅰ级23例, Ⅱ级23例, Ⅲ~Ⅳ级17例。另取沧州中西医结合医院神经外科因颅脑损伤行内减压术患者6例正常脑组织作对照, 所有胶质瘤患者术前均未接受过化疗或放疗等辅助治疗。所有标本经10%中性福尔马林固定, 常规石蜡包埋, 4μm厚切片编码备用。
1.1.2 主要试剂
鼠抗人Nestin单克隆抗体(浓缩型)购自北京中杉生物技术有限公司, SP免疫组化染色试剂盒购自河北博海生物公司, CD34单克隆抗体、DAB试剂盒、PBS缓冲液和柠檬酸盐抗原修复液, 均购自北京中杉生物技术有限公司。
1.2 方法
1.2.1 免疫组织化学染色
石蜡切片常规脱蜡水化, 蒸馏水漂洗3 min, 切片置0.01 mol/L, 枸橼酸缓冲液(PH6.0)中用煮沸(95℃, 15~20 min)进行抗原修复, 自然冷却20 min以上, 再用冷水冲洗, 加快冷却至室温。取出切片, 蒸馏水冲洗2次, 每次3 min, 用0.01 mol/L PBS液冲洗2次共5 min。使用3%双氧水阻断灭活内源性过氧化物酶, Nestin一抗稀释度1:200, 按照试剂盒说明进行操作(用PBS缓冲液代替一抗作阴性对照), 甩去PBS液, 每张片滴加2滴新配制的DAB溶液(按说明书配制), 3~5 min后显微镜下观察显色情况。蒸馏水充分冲洗, 苏木精轻度复染1 min, 常规脱水, 透明, 干燥, 封片。
CD34染色步骤: 石蜡切片脱蜡和水化后, 用PBS(PH值7.4)冲洗3次, 每次3 min, 切片加入装有150 mL0.01%枸橼酸150 mL微波抗原修复8 min, 凉至室温30 min, 3%过氧化氢室温孵育5 min, 一抗室温孵育90 min, 生物素化二抗室温孵育10 min, DAB孵育5 min, 复染、透明、封片。
1.2.2 结果判定
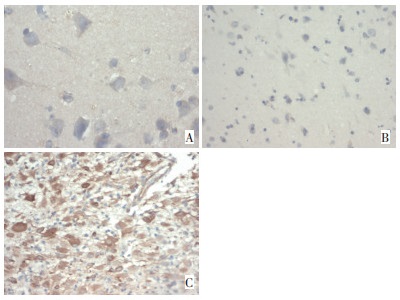
巢蛋白定位于细胞浆内, 以细胞浆出现红褐色为阳性结果, 低倍和高倍镜下观察并在高倍镜(×400)下随机选择5个视野, 计算出阳性细胞所占的百分率。结果判定标准: 阴性(-): 肿瘤组织完全不着色或阳性细胞数 < 5%;弱阳性(+): 肿瘤组织阳性细胞数6%~25%;阳性(++): 肿瘤组织阳性细胞数25%~50%;强阳性(+++): 肿瘤组织阳性数 > 50%。
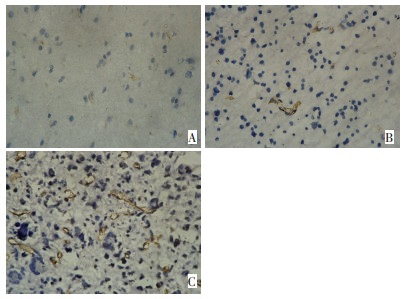
平均微血管密度(micro vessels density, MVD)的判定和MVD值计数CD34染色阳性为血管内皮细胞膜或细胞质呈棕黄色或棕褐色。新生血管通常以肿瘤内MVD来表示, 具体参照Weidner报道的方法。每张切片记录5个高倍视野下微血管数目, 取其平均值作为该标本的MVD(个/视野), 用MVD值表达CD34表达数量。
1.2.3 随访
手术之日即为随访开始时间。术后3个月内死亡者或随访期内死于脑胶质瘤以外原因者不计入统计资料。
1.3 统计学方法
全部实验数据均采用SPSS 17.0统计软件分析处理。根据比较对象的不同, 分别使用χ2检验和Sperman相关性分析等方法。
2. 结果
2.1 巢蛋白表达与胶质瘤临床病理级别的关系
本研究63例脑胶质瘤组织中nestin总阳性表达率为71.4%, 其中强表达16例(25.4%), 中度表达14例(22.2%), 弱表达15例(23.8%), 不表达18例(28.6%)。nestin表达在不同分化程度组织具有显著性差异(P < 0.01), nestin表达水平与脑胶质瘤病理级别成正相关(r=0.7, P < 0.01, 表 1)。随着胶质瘤级别的升高, 巢蛋白阳性细胞表达明显增高(图 1)。正常脑组织nestin阴性表达。
表 1 Nestin、CD34的表达与胶质瘤分级的关系Table 1. Relationship between the expressions of Nestin and CD34 and glioma grading
2.2 CD34免疫组化结果
脑胶质瘤组织微血管内皮细胞均呈CD34抗体反应阳性。胶质瘤Ⅰ级、Ⅱ级、Ⅲ~Ⅳ级微血管密度(MVD)分别为(35±14)、(69±33)、(119±49)。3组间比较具有显著性差异(P < 0.0 1, 表 1)。CD34-MVD值与胶质瘤病理级别成正相关性, 随着两者的表达增高, MVD的表达也明显增高(图 2)。
2.3 临床资料随访结果
胶质瘤Ⅰ级、Ⅱ级、Ⅲ~Ⅳ级患者生存时间(月)分别为(47.8±13.8)、(31.9±10.4)、(19.5±6.9)。3组组间比较有显著性差异(P < 0.01)。
2.4 Nestin与CD34、生存时间的关系
本研究显示nestin表达与CD34呈正相关(P < 0.01);患者生存时间与nestin表达呈负相关(P < 0.01);CD34表达与患者生存时间呈负相关(P < 0.01, 表 2)。
表 2 Nestin表达水平对CD34表达及生存时间的影响Table 2. Effect of nestin expression on CD34 expression and survival time in mice
3. 讨论
胶质瘤的发生发展与血管系统的发展是密切联系的, 低级别胶质瘤的血管与正常脑组织的血管形态相似, 但随着胶质瘤恶性程度增加, 血管增生明显, 血管的异型性与密度也不断增加[5]。血管增生显著影响恶性胶质瘤的生物学行为, nestin和CD34在其中起着重要作用。
1992年Dahlstrand等[6]就发现nestin在中枢神经系统的表达和颅内肿瘤的恶性程度一致。2002年, Ehrmann等[7]发现可根据在肿瘤中nestin免疫组化表达的数量和强度来判断胶质瘤的恶性程度。同时, nestin也能在新生的血管内皮细胞中表达, 也有报道明确其可作为快速生长的肿瘤血管内皮的标志[3]。通过免疫组化方法检测nestin在63例胶质瘤石蜡标本内血管内皮细胞中的表达, 研究发现在所有胶质瘤中, 其血管内皮细胞均呈nestin阳性, 而且Ⅳ级胶质瘤全部呈强阳性表达。结果分析显示nestin在血管内皮细胞的表达与胶质瘤病理分级呈正相关, 即胶质瘤级别和恶性程度越高, nestin在血管内皮的表达越强。
肿瘤组织的生长、转移与血管生成具有比较密切联系。肿瘤的平均微血管密度即可反映肿瘤诱导新生血管形成的能力, 又可作为反映肿瘤具有快速转移性的重要标志[8]。CD34是血管内皮细胞标记物中较敏感的指标, 其在新生血管内皮中表达远大于非新生血管内皮。CD34在肿瘤间质小血管的表达作用已得到证实, 目前普遍认为它是血管内皮细胞的首选标记物, 能清晰显示肿瘤微血管[4]。本实验证实, CD34与肿瘤间质组织无交叉反应, 在胶质瘤中表达清晰可靠, 是测定胶质瘤微血管密度的理想指标。胶质瘤恶性程度越高, 微血管密度越高。
本实验发现人脑胶质瘤中CD34-MVD值与巢蛋白阳性细胞的表达成正相关性。在低级别脑胶质细胞肿瘤中巢蛋白阳性细胞表达很低, 以零星分布。而在高级别脑胶质瘤组织切片上可见数个细胞聚集在一起, 并可见多数是围绕着血管或在血管旁, 而且见到的巢状分布的均近血管边缘。Shibahara等[9]研究结果进一步表明在高级别的胶质瘤中的Nestin表达呈近血管簇状或巢状分布, 以利于肿瘤细胞的自我更新、增殖和沿细胞间隙侵袭, 表明瘤组织内新生的血管内皮细胞和肿瘤的恶性进程有关, Schiffer等[10]研究发现nestin在神经上皮肿瘤中的表达和GFAP及Vimeniin的表达呈互补性, 它是神经细胞再生过程中早期状态的表达信号。
nestin与CD34的关系的研究目前鲜见报道, 其相互作用分子机制尚不清楚。本研究表明CD34与患者临床预后有关, nestin表达水平与肿瘤患者的预后呈负相关。因此联合检测nestin、CD34可作为判断胶质瘤患者的预后指标。
-
表 1 Nestin、CD34的表达与胶质瘤分级的关系
Table 1 Relationship between the expressions of Nestin and CD34 and glioma grading

表 2 Nestin表达水平对CD34表达及生存时间的影响
Table 2 Effect of nestin expression on CD34 expression and survival time in mice

-
[1] Lendahl U, Zmmerman LB, Mckay RD. CNS stem cells express a new class of intermediate filament protein[J]. Cell, 1990, 60(4): 585-595. DOI: 10.1016/0092-8674(90)90662-X
[2] Strojnik T, Rosland GV, Sakariassen PO, et al. Neural stem cellmarkers, nestin and musashi proteins, in the progression of human glioma correlation of nestin with prognosis of patient survival[J]. Surg Neurol, 2007, 68(2): 133-143. DOI: 10.1016/j.surneu.2006.10.050
[3] Shmizu T, Sugamara K, Tosaka M, et al. Nestin expression in vascularm alformations a novelmarker for proliferative endothelium[J]. Neurol Med Chir(Tokyo), 2006, 46(3): 111-117. DOI: 10.2176/nmc.46.111
[4] Weidner N. Intraumor microvessel density as a prognostic factor in cancer[J]. AmJ Pathol, 1995, 17(2): 147.
[5] Vajkoczy P, Menger MD. Vascularm icroenvironment in gliomas[J]. Neuro Oncol, 2000, 50(1-2): 99-l08.
[6] Dahlstrand J, Collins V P, Lendahl U. Expression of the class VI intermediate filament nestin in human central nervous system tumors[J]. Cancer Res, 1992, 52(92): 5334-5341. http://pdfs.semanticscholar.org/3ee9/6f2bc5d7a56cc6a8988916b605537b74b10d.pdf
[7] Ehrmann J, Kolar Z, MokryJ. Nestin as a diagnostic and prognos- tic marker: immunohrstochemical analysis of its expression in different tumons[J]. J Clin Pathol, 2005, 58(2): 222-223. DOI: 10.1136/jcp.2004.021238
[8] Akagi K, Ikeda Y, Sumiyoshi Y, et al. Estimation of angiogenesis with anti-CD105 immunostaining in the process of colorectal cancer delelopmentr[J]. Surgery, 2002, 131(1 Suppl): 103-109. http://www.onacademic.com/detail/journal_1000036119218510_be85.html
[9] Shibahara J, Fukayama M. Secondary glioblastoma with advanced neuronal immunphenotyper[J]. Virchows Arch, 2005, 447(3): 665-668. DOI: 10.1007/s00428-005-1263-x
[10] Schiffer D, Manazza A, Tamagno I. Nestin exepreeion in neuroepithelial tumors[J]. Neurosci Lett, 2006, 400(1-2): 80-85. DOI: 10.1016/j.neulet.2006.02.034



 下载:
下载: