Detection and clinical significance of the peripheral blood tumor marker NPY1R for circulating breast cancer cells
-
摘要:目的 鉴定一种新的检测乳腺癌循环癌细胞的肿瘤标记物NPY1R(neuropeptide Y receptor Y1)。探讨NPY1R在乳腺癌外周血中的表达水平及其与临床病理学特征的关系。方法 通过肿瘤基因组解剖计划(cancer genome anatomy project, CGAP)数据库的数字基因表达演示工具(digital gene expression displayer, DGED), 发现了一种新的乳腺癌外周血标记物NPY1R。采用实时半定量巢式PCR技术, 检测了142例乳腺癌和60例正常人外周血中NPY1R的表达水平, 并进一步分析了NPY1R表达与乳腺癌临床病理特征的相关性。对131例患者随访38个月, 观察NPY1R的表达对乳腺癌患者生存时间的影响。结果 证实NPY1R在142例乳腺癌外周血中的表达水平明显高于正常组(P < 0.01)。并且, NPY1R在外周血中的表达水平与临床分期、淋巴结转移和ER、PR、HER2具有相关性(P < 0.05)。131例随访患者中, NPY1R表达阳性组的生存率显著低于阴性组(P < 0.01)。结论 NPY1R是外周血循环癌细胞一种新的肿瘤标记物, 可作为判断乳腺癌转移和预后的评估指标。Abstract:Objective This study aimed to evaluate a new tumor marker, NPY1R, for the detection of circulating breast cancer cells and to investigate the relationship between NPY1R expression and the clinicopathological features of breast cancer patients.Methods The marker NPY1R, which could detect circulating cancer cells, was identified by the Digital Gene Expression Displayer tool of the Cancer Genome Anatomy Project.The expression levels of NPY1R in 142 breast cancer patients and 60 healthy volunteers were determined using the real-time semi-quantitative nested polymerase chain reaction.The correlation between NPY1R expression and the clinicopathological features of the patients was then analyzed.A follow-up study was performed with 131 breast cancer patients for 38 months to observe the effect of NPY1R expression on the survival of breast cancer patients.Results NPY1R was highly expressed in the cancer patients as compared with the normal controls(P < 0.01).The high-level expression of NPY1R was positively correlated with the clinical stages and lymph node metastasis as well as the status of the estrogen and progesterone receptors(P < 0.05).Breast cancer patients with circulating cancer cells that expressed NPY1R had shorter tumor-specific survival as compared with those without NPY1R expression(P < 0.01).Conclusion NPY1R may serve as a useful marker to predict cancer metastasis and to evaluate the prognosis of breast cancer patients.
-
Keywords:
- breast cancer /
- NPY1R /
- tumor marker /
- circulating cancer cells
-
乳腺癌是女性最常见的恶性肿瘤之一, 治疗失败的主要原因是具有转移潜能的肿瘤细胞在术前或术中脱离原发灶随血行转移。微转移是一个独立的预后指标, 其价值优于肿瘤的分级和分期。因此, 及时发现肿瘤的血行微转移, 对减少日后转移性肿瘤的发生, 改善预后, 提高生存率, 具有重要的意义。
神经肽Y(NPY)主要在大脑和外周神经发挥调节作用, 其受体包括6种亚型。使用体外受体放射自显影技术, 发现Y1和Y2受体在乳腺癌、肾上腺肿瘤、肾细胞癌、卵巢癌等多种肿瘤的细胞和血管中高表达。瘤神经纤维或肿瘤细胞本身释放的内源性NPY可激活NPY受体, 并介导肿瘤细胞增殖和血液供应。本研究通过肿瘤基因组解剖计划(CGAP)SAGE(Serial Analysis of Gene Expression)数据库发现NPY1R基因在乳腺癌外周血中高表达。以该基因作为分子标记物, 测定了乳腺癌患者外周血的微转移情况, 并进一步分析了其与乳腺癌发生、转移和预后的关系。
1. 材料与方法
1.1 材料
收集2008年11月至2011年12月承德医学院附属医院肿瘤科病历资料完整的乳腺癌外周血标本142例, 均为女性, 年龄21~82岁, 中位年龄为52岁。抽血前均未接受化学治疗和放射治疗。所有患者均经手术治疗证实, 手术后均经病理确诊。其中浸润性导管癌98例, 单纯癌7例, 湿疹样癌5例, 髓样癌19例, 浸润性小叶癌13例。淋巴结转移阳性84例, 淋巴结转移阴性58例。Ⅰ期和Ⅱ期乳腺癌患者89例, Ⅲ期和Ⅳ期53例。雌激素受体(ER)阳性82例, 阴性60例。孕激素受体(PR)阳性63例, 阴性79例。HER2阳性68例, 阴性74例。另选取正常捐献者外周血60例, 均为女性, 年龄22~76岁, 中位年龄为49岁, 与乳腺癌组比较差异无统计学意义。经胸片和B超检查未发现乳腺相关和其他疾病。
1.2 差异基因的筛选
利用CGAP提供的SAGE Genie数据库(http://cgap.nci.nih.gov/SAGE), 选取数字基因表达演示(DGED)工具。选择乳腺癌组织和正常白细胞两个池, 设置F值为16, 即表达差异大于16倍以上, P值设置为0.01。差异表达的基因按差异显著性高低排序, 比对出在短序列标签文库和长序列标签文库中均出现的差异基因, 作为候选基因。
1.3 总RNA提取和c DNA合成
将3~5 mL外周血置于淋巴细胞分离液上, 密度梯度离心法分离单个核淋巴细胞。细胞计数后, 按106个/mL在1.5 mL eppendorf管中加入适量Trizol试剂, 提取总RNA。分光光度法测定纯度后取5μg, 按逆转录试剂盒(QIAGEN)操作步骤进行逆转录获得cDNA。
1.4 实时半定量巢式PCR方法检测外周血癌细胞
第一轮PCR反应体系包括: 2.5μL外周血的c DNA模板, 0.2μmol/L外侧引物(上游序列为: 5'-TATACC ACTCTTCTCTTGGTGCTG-3';下游序列为: 5'-CTGG AAGTTTTTGTTCAGGAACCCA-3'), 0.2mM d NTP, 50mM Tris-HCl(p H 8.3), 10 mM KCl, 5 mM(NH4)2SO4, 2 mM MgCl2, 0.75 U of Taq polymerase, 总体积为25μL。反应条件为: 94℃变性20 s, 退火温度为62℃, 72℃延伸40 s, 35个循环后, 再72℃延伸10 min。
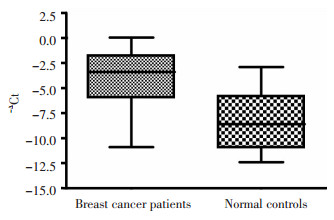
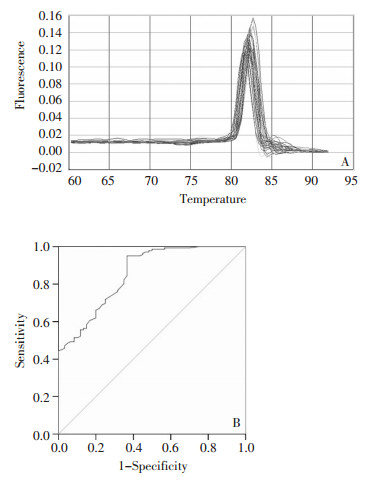
取2μL第一轮PCR的产物作为第二轮的模板, 20μL PCR反应体系还包括: 0.25μmol/L内侧引物(上游序列为: 5'-ATCTGCCCTTGGCCATGAT-3';下游序列为: 5'-AGGCCAGGTTTCCAGAGACA-3'), SYBR Green PCR master mix(上海基康生物技术有限公司)。反应条件: 94℃变性4 min, 94℃15 s, 58℃30 s, 72℃35 s, 共40个循环扩增。溶解曲线见图 1A。GAPDH为内参照, 每个样本的每个待测项目均测3次, 取平均值。记录各样品的Ct值, 并计算各组目的基因的相对表达量。计算公式: ΔCtNPY1R=CtNPY1R-CtGAPDH; ΔΔCt=ΔCt肿瘤-ΔCt正常人平均值; 目的基因的相对量Q为2-ΔΔCt。根据肿瘤组和正常组-ΔCt值绘制ROC曲线(图 1B), 本研究将特异性为100%时的-ΔCt值(-2.75)作为界限值。
1.5 随访
随访主要通过电话、查阅门诊复诊病历、上门随访等方式进行。随访从确诊之日开始, 每3个月1次, 直至2011年12月或患者死亡及失访, 进行随访患者共131例, 随访率为92.3%。患者生存时间为确诊乳腺癌之日起至患者死于乳腺癌或随访截止时间。
1.6 统计学方法
采用SPSS 13.0统计软件包进行统计分析。乳腺癌病例对照的比较采用t检验, 病例按临床病理特征分组后不同组的比较采用方差分析。Kaplan-Meier绘制生存曲线, Log-rank计算评价NPY1R阴性、阳性组生存时间的差异。
2. 结果
2.1 乳腺癌外周血高表达基因NPY1R的鉴定
在SAGE文库中, 比对出在10bp的短标签文库(short tags)和17 bp的长标签文库(long tags)中共同出现的基因, 最终筛选出23个在乳腺癌中高表达的基因。其中NPY1R高度差异表达, 并经RT-PCR验证其在10例乳腺癌外周血标本中有5例表达, 而10例正常人外周血中无一例表达, 可作为外周血检测乳腺癌的标记物。
2.2 乳腺癌外周血NPY1R的表达水平
实时半定量巢式PCR检测外周血NPY1R mRNA表达水平, 测得乳腺癌组患者-ΔCt值为-3.93±2.5, 显著高于正常组(-8.21±2.9)(P < 0.01, 图 2)。乳腺癌患者NPY1R mRNA相对表达量为55.54±27.3。根据界限值(-ΔCt值为-2.75), 得到NPY1R在乳腺癌中的阳性表达率为44.4%(63/142)。
2.3 NPY1R表达与临床病理特征的关系
外周血肿瘤标记物NPY1R表达与临床分期(P < 0.001)、淋巴结转移(P=0.001)和ER(P=0.001)、PR(P=0.037)、HER2(P=0.001)相关。而与年龄、病理类型和肿瘤大小无相关性(P均 > 0.05, 表 1)。
表 1 乳腺癌外周血NPY1R表达水平与临床病理特征的关系x±s Table 1. Relationship between the expression of NPY1R in peripheral blood and the clinicalpathologic features of breast patientsx±s 
2.4 NPY1R表达与乳腺癌患者术后生存率的关系
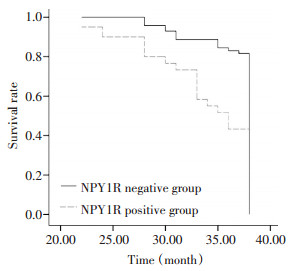
本组对131例乳腺癌患者共随访38个月, 死亡51例(38.9%), 生存80例(61.1%), 其中无复发生存46例(35.1%)。肿瘤标记物NPY1R表达阳性组死亡34例(56.7%), 阴性组死亡17例(23.9%)。NPY1R表达阳性组和阴性组的生存率分别为43.3%(26/60)和76.1%(54/71), 差异有统计学意义(P < 0.01, 图 3)。
2.5 NPY1R基因表达与乳腺癌HER2表达状态的分层分析
NPY1R阳性组和阴性组按照HER2的表达状态进行分层分析, 分为HER2阳性组和HER2阴性组, 两组的生存情况见表 2。经χ2检验, NPY1R阳性组χ2=4.85, OR=3.27, OR(95%CI)为1.140~9.38;NPY1R阴性组χ2=14.73, OR=11.08, OR(95%CI)为3.25~37.77, 结果说明, NPY1R阳性组和阴性组中, 死亡率均与HER2阳性表达有关联。经Mantel-Haenszelχ2检验, χ2M-H=11.48, P < 0.01, 调整ORM-H=4.29(95%CI为1.85~9.95), 表明HER2表达与患者生存相关, 是影响死亡率的危险因素。
表 2 HER2表达状态分层分析结果例 Table 2. Stratified analysis based on the expression of HER2
3. 讨论
及时发现肿瘤的血行播散并给予有效治疗, 将有助于杀灭血中播散的肿瘤细胞, 减少日后转移性肿瘤的发生, 改善预后, 提高生存率[1]。但由于播散到外周血中的实体肿瘤细胞数目非常少, 需要高度敏感、特异的技术对其进行检测。本研究采用了实时半定量巢式PCR技术[2], 第一轮为普通PCR反应, 结束后取扩增产物2μL作为模板加入到第二轮体系中, 而第二轮PCR则采用荧光定量技术, 对扩增产物进行相对的定量检测。这样既保证了检测的敏感性, 又兼具有Real-time PCR定量的优势。
有效的微转移检测, 仅仅敏感的方法还不够, 还需要特异性好的标志物基因。由于目前在实体瘤中尚无特异明确的肿瘤标记物, 因此, 主要采用组织特异mRNA转录物为标记物。本研究为了寻找检测乳腺癌外周血循环癌细胞的肿瘤标记物, 我们应用生物信息学技术[3], 在SAGE文库中选择了乳腺癌组织和正常白细胞两个池。最终筛选出23个短序列标签和长序列标签所共同代表的差异基因, 然后用RT-PCR方法, 对其进行验证。选取10例乳腺癌和10例正常人外周血标本, 规定比较理想的肿瘤标记物, 最好在10例乳腺癌标本中至少有2例表达, 而在10例正常人标本中不多于2例表达。研究结果显示在筛选过程中, 主要出现以下情况: 1)有的肿瘤基因虽然在组织中高表达, 但在外周血中检测阳性率非常低; 2)有的肿瘤基因虽然在乳腺癌外周血单个核细胞上高表达, 但其在正常人外周血单个核细胞上的表达也较高, 因此不能作为诊断的标记物。最后, 我们得到了一个在乳腺癌外周血中高表达的新的肿瘤标记物基因NPY1R。本研究结果也进一步证实了生物信息学分析的可靠性。
神经肽Y(NPY)在中枢神经系统中除具有调节下丘脑激素的合成和释放功能外, 还有增加摄食、抑制呼吸、降低血压和调节体温等作用[4]。在外周NPY主要存在于交感神经末梢, 对心血管系统发挥重要的调节作用。此外, 研究证实垂体前、后叶均含有NPY的表达。有研究[5]认为垂体前叶中NPY主要由下丘脑合成, 通过垂体门脉系统到达垂体, 参与调控垂体激素的合成和分泌, 包括促性腺激素(FSH/LH)、生长激素(GH)和泌乳素(PRL)等。最近的研究表明, NPY及其受体参与很多肿瘤的发生发展过程。有研究报道NPY1受体在尤文肉瘤中高表达, 阳性率高达84%, 平均密度为5 314 DPM/mg组织。同样, 滑膜肉瘤也表现为高密度Y1表达(平均7 497 DPM/mg; 发病率40%)。此外, NPY1R原位杂交显影结果证实许多肉瘤血管中高表达Y1受体[6, 7]。Ruscica等[8]的结果表明神经肽Y可直接通过Y1受体调节前列腺细胞生长。这种效应的方向似乎与MAPK激活的时间动力学以及其他细胞内的信号克隆的参与相关。NPY相关的机制可能在前列腺癌的进展中发挥了相应的作用, 包括雄激素依赖和独立的阶段。另外, 在神经母细胞瘤和肾上腺肿瘤中也发现了NPY受体的异常表达, 提示NPY及其受体在这些肿瘤的发生中也参与了调节作用[9]。
有研究[10]证实, 85%的原发性乳腺癌表达Y1亚型受体, 而正常乳腺组织则表达Y2亚型。Y1受体在乳腺癌中高发生率的原因至今还不清楚。最近有研究提出[11], 神经肽Y能够刺激血管内皮生长因子的产生和分泌进而促进乳腺癌血管的生成。Y1R是第一个被克隆鉴定的NPY受体。雌激素和NPY及其受体之间的关系能够解释雌、孕激素与NPY水平增加的协同作用和促黄体酮激素的增加。逆转录PCR实验证实, 经雌激素处理的大鼠的下丘脑Y1R m RNA水平增加。Amlal等[12]提出Y1R的诱导产生受到雌激素信号转导通路的调节, 其通过研究雌激素受体阳性的人类乳腺癌细胞系MCF-7, 检测雌激素作用下Y1R受体的表达和信号通路, 发现MCF-7表达高亲和力的NPY受体, NPY抑制cAMP的积累以及动员细胞内的钙离子。结果证实, 雌激素在Y1R上调中起重要作用, 反之其同样调节了雌激素诱导的乳腺癌细胞的增殖。本研究中也发现乳腺癌外周血NPY1R的表达水平与雌激素和孕激素相关, 雌、孕激素阳性患者NPY1R基因的表达水平明显高于雌、孕激素阴性的患者。结果也提示, NPY1R在乳腺癌中可能是通过雌激素、孕激素介导的信号传导通路而发挥作用的, 其具体机制有待进一步探讨。
本研究还根据HER2表达状况对NPY1R阳性和阴性组患者的预后进行了分层分析。结果表明HER2表达与患者死亡有关联, 是影响死亡率的危险因素。过去的研究也证实, 原癌基因HER2多拷贝的性质而导致肿瘤易复发和临床预后较差。HER2基因扩增是引起HER2蛋白增加的最常见机制, 可导致肿瘤细胞的形成。在20%~30%乳腺癌中可检测到HER2基因扩增, 对进展期乳腺癌常规治疗方法疗效甚微。许多临床研究对HER2和乳腺癌预后之间的关系进行了探讨[13], 表明HER-2阳性可作为多变量分析中的一个独立的预后指标。HER-2/neu扩增/过表达的乳腺癌的特点表现为病情进展迅速、局部复发的危险性高、化疗缓解期短, 无瘤生存期(DFS)和总生存期(OS)缩短。但是有关NPY1R的表达是否与HER2具有相关性还有待进一步研究。
-
表 1 乳腺癌外周血NPY1R表达水平与临床病理特征的关系
x±s Table 1 Relationship between the expression of NPY1R in peripheral blood and the clinicalpathologic features of breast patients
x±s 
表 2 HER2表达状态分层分析结果
例 Table 2 Stratified analysis based on the expression of HER2

-
[1] Rahbari NN, Bork U, Motschall E, et al. Molecular detection of tumor cells in regional lymph nodes is associated with disease recurrence and poorsurvival in node-negative colorectal cancer: a systematic review and meta-analysis[J]. J Clin Oncol, 2012, 30(1): 60-70. DOI: 10.1200/JCO.2011.36.9504
[2] Liu L, Liao GQ, He P, et al. Detection of circulating cancer cells inlung cancer patients with a panel of marker genes[J]. Biochem Biophys Res Commun, 2008, 372(4): 756-760. DOI: 10.1016/j.bbrc.2008.05.101
[3] Kavak E, UnlüM, Nistér M, et al. Meta-analysis of cancer gene expression signatures reveals new cancer genes, SAGE tags and tumor associatedregions of co-regulation[J]. Nucleic Acids Res, 2010, 38(20): 7008-7021. DOI: 10.1093/nar/gkq574
[4] Higuchi H. Molecular analysis of central feeding regulation by neuropeptide Y(NPY)neurons with NPY receptor smallinterfering RNAs (siRNAs)[J]. Neurochem Int, 2012, 61(6): 936-941. DOI: 10.1016/j.neuint.2012.02.029
[5] Kiyokawa M, Matsuzaki T, Iwasa T, et al. Neuropeptide Y mediates orexin A-mediated suppression of pulsatile gonadotropin-releasing hormone secretionin ovariectomized rats[J]. J Med Invest, 2011, 58(1-2): 11-18.
[6] K rner M, Waser B, Reubi JC. High expression of neuropeptideY1 receptors in ewing sarcoma tumors[J]. Clin Cancer Res, 2008, 14(16): 5043-5049. DOI: 10.1158/1078-0432.CCR-07-4551
[7] Lu C, Tilan JU, Everhart L, et al. Dipeptidyl peptidases as survivalfactors in Ewing sarcoma family of tumors: implications for tumorbiology and therapy[J]. J Biol Chem, 2011, 286(31): 27494-27505. DOI: 10.1074/jbc.M111.224089
[8] Ruscica M, Dozio E, Boghossian S, et al. Activation of the Y1 receptor by neuropeptide Y regulates the growth of prostate cancer cells[J]. Endocrinology, 2006, 147(3): 1466-1473. DOI: 10.1210/en.2005-0925
[9] K rner M, Waser B, Reubi JC. High expression of neuropeptide yreceptors in tumors of the human adrenal gland and extra-adrenalparaganglia[J]. Clin Cancer Res, 2004, 10(24): 8426-8433. DOI: 10.1158/1078-0432.CCR-04-0821
[10] Reubi JC, Gugger M, Waser B, et al. Y(1)-mediated effect of neuropeptide Y in cancer: breast carcinomas as targets[J]. Cancer Res, 2001, 61(11): 4636-4641.
[11] Sheriff S, Ali M, Yahya A, et al. Neuropeptide Y Y5 receptor promotes cell growth through extracellular signal-regulated kinase signaling andcyclic AMP inhibition in a human breast cancer cell line[J]. Mol Cancer Res, 2010, 8(4): 604-614. DOI: 10.1158/1541-7786.MCR-09-0301
[12] Amlal H, Faroqui S, Balasubramaniam A, et al. Estrogen up-regulates neuropeptide Y Y1 receptor expression in a human breast cancer cell line[J]. Cancer Res, 2006, 66(7): 3706-3714. DOI: 10.1158/0008-5472.CAN-05-2744
[13] Lennon S, Barton C, Banken L, et al. Utility of serum HER2 extracellular domain assessment in clinical decision making: pooled analysis of four trialsof trastuzumab in metastatic breast cancer[J]. J ClinOncol, 2009, 27(10): 1685-1693. DOI: 10.1200/JCO.2008.16.8351



 下载:
下载: