Therapeutic effect of transarterial chemoembolization combined with apatinib on patientswith advanced hepatocellular carcinoma
-
摘要:目的 评价肝动脉化疗栓塞术(transarterial chemoembolization,TACE)联合口服阿帕替尼治疗中晚期肝癌的近期疗效。方法 收集2016年6月至2016年10月于首都医科大学附属北京友谊医院接受TACE联合口服阿帕替尼250 mg/d治疗的21例中晚期原发性肝癌(hepatocellular carcinoma,HCC)患者的临床资料;采用影像学中最新修订的实体瘤疗效评价标准(modified responseevaluation criteria in solid tumors,mRECIST),回顾性分析联合治疗1个疗程(平均约28 d)后患者的治疗效果,并对不良反应进行分析。结果 21例患者中,完全缓解(complete response,CR)3例(14.3%),部分缓解(patial response,PR)6例(28.6%),疾病稳定(stable disease,SD)5例(23.8%)。疾病控制率(disease control rate,DCR)为61.9%,客观缓解率(objective rate,ORR)为38.1%。疾病进展(progressive disease,PD)2例(9.5%)。21例患者治疗中出现的不良反应:乏力17例(94.4%),胃肠道症状14例(66.7%),手足综合征4例(19.0%),血压升高4例(19.0%),并出现不同程度的声音嘶哑、头痛头晕、蛋白尿等。结论 TACE联合阿帕替尼对中晚期原发性肝癌的临床治疗近期效果满意,治疗过程中不良反应发生率较高,需给予积极处理。Abstract:Objective To evaluate the therapeutic effect of transarterial chemoembolization(TACE)combined with apatinib on patients with advanced hepatocellular carcinoma(HCC).Methods Twenty-one patients were treated with TACE combined with 250 mgof apatinib once a day.Disease classification was assessed by investigators using the modified Response Evaluation Criteria in Solid Tumors(mRECIST).The evaluation period was 28 days.Results The therapeutic effects were classified as follows: 3 patients(14.3%)hadcomplete response, 6 patients(28.6%)had partial response, 5 patients(23.8%)had stable disease, and 2 patients(9.5%)had progressive disease.The disease control rate was 61.9%, and the objective response rate was 38.1%.In patients, the most frequent adverseevents were fatigue(94.4%), anorexia(23.8%), diarrhea(19.0%), hypertension(19.0%), and hand-foot syndrome(19.0%).Conclusion The short-term therapeutic effect revealed that the combination of TACE and apatinib could be a promising treatment for patientswith advanced HCC.Adverse events should be closely monitored and provided with active management.
-
原发性肝癌(hepatocellular carcinoma,HCC)是全球常见的恶性肿瘤,居癌症致死率的第3位[1]。中国是HCC高发区,发病例数约占全球55%,死亡人数占50%,在与肿瘤相关的死亡中仅次于肺癌,位居第二。
早期HCC多采用手术切除方式,而针对中晚期HCC首选的姑息性治疗方法为肝动脉化疗栓塞术(transarterial chemoembolization,TACE)[2],但也存在一些缺陷,如肿瘤组织灭活不完全等。有报道认为,TACE联合靶向药物治疗,有助于提高肿瘤控制率[3]。本研究主要评价TACE联合阿帕替尼对中晚期HCC的临床治疗效果。
1. 材料与方法
1.1 病例资料
回顾性分析2016年6月至2016年10月就诊于首都医科大学附属北京友谊医院接受TACE联合口服阿帕替尼的21例患者临床资料,所有患者均经影像学检查及相关肿瘤指标临床确诊,并接受1次或多次TACE或单纯TACE治疗,术后3 d均开始口服阿帕替尼(表 1)。本研究符合第21届世界医学协会联合大会(赫尔辛基,1964年)建立的伦理规范和所有后续的修订案。研究治疗方案均与患者及家属充分沟通,所有患者选择TACE联口服合阿帕替尼治疗,并签署知情同意书。甲磺酸阿帕替尼片经Ⅰ、Ⅱ期研究可安全用于治疗HCC,并已通过国家食品药品监督管理总局(CFDA)颁发的《药物临床试验批件》(受理号:CXHB1100041苏)。
表 1 患者一般资料Table 1. Patient information
1.2 方法
1.2.1 治疗方法
所有患者均因肝内多发病灶或有远处转移而不适合行手术治疗,均接受1次或多次TACE,且单纯TACE治疗后效果不佳或疾病进展(progressive disease,PD):所有目标病灶的长径总和增加≥20%,其绝对值≥5 mm,或出现新的病灶。TACE术后3 d给予甲磺酸阿帕替尼片治疗,初始剂量为250 mg/d,餐后服用每日1次(每日尽量同一时间服用),28 d为1个治疗周期;可依据受试者的不良反应进行剂量调整(第1次下调125 mg/d);如不良反应完全恢复,可恢复至上一剂量水平,在肝功能未受损的情况下(根据患者转氨酶及胆红素水平等实验室指标综合判断),进行后续TACE治疗,治疗前3 d停用阿帕替尼,治疗后3 d继续给予阿帕替尼治疗。
1.2.2 随访
所有患者经TACE联口服合阿帕替尼治疗,间隔28d门诊或住院随访1次,随访内容包括:血常规、总胆红素水平、白蛋白水平、血清转氨酶含量、凝血功能、乙肝5项、甲胎蛋白含量、血肌酐和尿素氮、增强CT或MRI(每2个月1次)、药物不良反应等。
1.2.3 疗效评价
采用最新修订的实体瘤疗效评价标准(modified Response Evaluation Criteria in SolidTumors,mRECIST),分为完全缓解(complete response,CR):所有靶病灶动脉期强化消失;部分缓解(partial rate,PR):所有目标病灶的长径总和减少≥30%;疾病稳定(stable disease,SD):变化介于PR和PD之间;PD:所有目标病灶的长径总和增加≥20%,并且长径总和增加的绝对值≥5 mm,或出现新的病灶。疗效指标:计算疾病控制率(disease control rate,DCR=CR+PR+SD)和客观缓解率(objective responserate,ORR=CR+PR)。药物不良反应评价采用美国国家癌症研究所(NCI)常见毒性标准(NCI CTC v4.0)。如NCI毒性分级标准未列出,可根据以下标准判断:Ⅰ度(轻微):有不舒服的感觉,但不影响每日正常活动;Ⅱ度(中):不舒服的程度影响每日正常活动;Ⅲ度(严重):不能工作或正常活动;Ⅳ度(致命):致残或致死。
1.3 统计学分析
采用SPSS19.0软件进行统计学分析,归纳患者的基本特征、不良反应,并进行比较。生存质量评分与基线检查值进行的比较,采用配对t检验或符号秩和检验比较组内前后差异。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 患者一般情况
截至2016年9月30日,所有患者随访率为100%,中位随访时间为21.85 d。TACE中位治疗次数为4.5次,阿帕替尼使用时间为TACE术后3 d,初始使用剂量为250 mg/d,参照mRECIST标准评价患者联合治疗1个疗程后的结果(表 2)。图 1、2为2例联合治疗后评估疗效较好患者的影像资料。随访期间共发生PD 2例(9.5%)(其中1例口服阿帕替尼1个疗程后无任何不良反应,肿瘤靶病灶最大径由原来4.3cm进展为7.3cm,且有多发新出现病灶;1例口服阿帕替尼2周后出现胸闷气短,呼吸困难,患者自行停药,肿瘤靶病灶增大,病灶数量增多)。1例口服阿帕替尼1周后因出现乏力、恶心、呕吐症状,自行停药;2例因口服阿帕替尼1周后出现不能控制的高血压,停药;1例因口服阿帕替尼14d后出现心动过缓,不稳定性心绞痛,停药。死亡1例(患者因脑转移瘤死亡)。
表 2 联合治疗后mRESIST评价结果Table 2. Results of mRESIST after administering the combined treatment
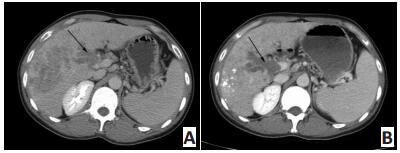
![]() 图 1 患者男性,36岁,发现HCC 1个月,CT示TACE联合阿帕替尼治疗后肿瘤变化情况Figure 1. A 36-year-old male patient diagnosed with HCC for 1 month.CTshowed the tumor change after TACE and apatinib treatmentA.Arrow indicates the enhanced tumor in the right liver and the tumorthrombus in the branch of portal vein.Afterward, the patient was treatedwith one course of TACE and apatinib(250 mg/d); B.Follow-up contrastenhancement CT reveals that all target lesions were deposited with goodlipiodol accumulation
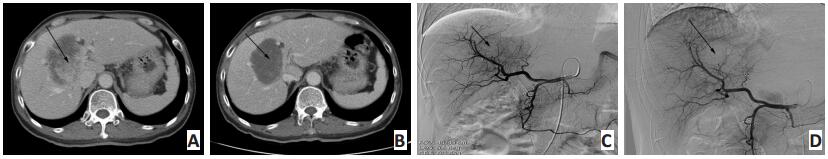
图 1 患者男性,36岁,发现HCC 1个月,CT示TACE联合阿帕替尼治疗后肿瘤变化情况Figure 1. A 36-year-old male patient diagnosed with HCC for 1 month.CTshowed the tumor change after TACE and apatinib treatmentA.Arrow indicates the enhanced tumor in the right liver and the tumorthrombus in the branch of portal vein.Afterward, the patient was treatedwith one course of TACE and apatinib(250 mg/d); B.Follow-up contrastenhancement CT reveals that all target lesions were deposited with goodlipiodol accumulation![]() 图 2 患者男性,57岁,发现HCC3个月余。CT与DSA显示TACE联合阿帕替尼治疗后肿瘤变化情况Figure 2. A 57-year old male patient diagnosed with HCC for 3 months.CT and DSA showed tumor change after TACE and apatinib treatmentA.Abdominal CT shows a single enhanced lesion(arrow)in the right lobe; B.Abdominal CT shows no enhancement within the lesion(arrow); C.DSApresents the same rich blood supply lesion(arrow).Afterward, the patient was treated with one course of TACE and apatinib(250 mg/d); D.DSA showsthat the tumor stain disappeared(arrow).The case was regarded as CR by mRECIST
图 2 患者男性,57岁,发现HCC3个月余。CT与DSA显示TACE联合阿帕替尼治疗后肿瘤变化情况Figure 2. A 57-year old male patient diagnosed with HCC for 3 months.CT and DSA showed tumor change after TACE and apatinib treatmentA.Abdominal CT shows a single enhanced lesion(arrow)in the right lobe; B.Abdominal CT shows no enhancement within the lesion(arrow); C.DSApresents the same rich blood supply lesion(arrow).Afterward, the patient was treated with one course of TACE and apatinib(250 mg/d); D.DSA showsthat the tumor stain disappeared(arrow).The case was regarded as CR by mRECIST实验室检查分析显示(表 3),行TACE联合阿帕替尼治疗1个疗程后,与末次TACE检验结果相比,6例甲胎蛋白由≥2000ng/mL下降至≤400ng/mL,有明显降低趋势且肝功能无明显变化(随访中1例死亡,4例自行停药,实验室检查共16例患者)。
表 3 联合治疗后实验室检查随访结果Table 3. Laboratory values after administering the combined treatment
2.2 不良反应
21例患者中,17例出现乏力症状;5例出现声音嘶哑,经休息后可缓解;2例患者出现头痛、头晕症状;5例患者食欲减退伴有恶心呕吐症状;4例出现手足综合征;1例皮疹,经外用炉甘石洗剂或其他外用软膏后症状缓解,并且经长期口服阿帕替尼治疗后,多数患者可耐受。4例患者出现血压升高,其中3例出现高血压后口服降血压药物治疗,可缓解;1例最高血压达220/100mmHg,口服3种联合降低血压药,效果不明显,于是停用阿帕替尼治疗高血压危相,血压平稳后,继续口服阿帕替尼治疗。10例出现转氨酶升高,7例总胆红素升高,5例胆碱酯酶降低,经保肝降酶等药物治疗后好转,继续口服阿帕替尼治疗。2例出现蛋白尿,经药物治疗后效果不明显停药。2例口服阿帕替尼1周后出现不稳定性心绞痛,并伴有喘憋、呼吸困难等症状,不可耐受,停用阿帕替尼治疗,于专科继续治疗(表 4)。
表 4 联合治疗中患者出现的不良反应Table 4. Adverse events of the combined treatment
3. 讨论
TACE普遍用于治疗中晚期HCC,其优势在于更有效地对肿瘤进行针对性治疗,从而达到抑制肿瘤生长的目的[4]。然而,单纯的TACE治疗需要短时间内多个周期进行,并且存在肿瘤灭活不彻底等缺陷。最近多项研究证实[5-6],TACE术后会导致栓塞组织细胞缺血缺氧,从而分泌多种生长因子(如VEGF),促进肿瘤生长和转移。血管新生是恶性肿瘤发生与进展过程中最关键的步骤。既往有研究报道[7-8]索拉非尼联合TACE,最长生存期长达30个月,可以有效延长中晚期肝癌患者生存期。因此,TACE联合靶向血管生成抑制剂,不仅可以有效的抑制肿瘤周边的血管新生,还可延缓肿瘤的进展,进而提高肿瘤治疗效果。
阿帕替尼是一种小分子酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)。多项体内、外试验发现,阿帕替尼对控制多种类型的肿瘤有显著作用,可通过抑制肿瘤细胞的活性及侵袭能力,并通过RET/Src等信号通路产生多种细胞毒性,达到抗肿瘤的目的[9]。试验表明[10-12]阿帕替尼可显著延长晚期肿瘤患者的生存期和无进展生存期,提高DCR。然而,TACE联合口服阿帕替尼应用于肝癌患者的疗效尚缺乏报道。本研究收集TACE联合口服阿帕替尼的21例患者进行初步报道。
研究发现,TACE后联合阿帕替尼250 mg治疗1个疗程后,肿瘤内坏死组织增多,肿瘤负荷明显缩小,表明阿帕替尼抗肿瘤血管生成具有明显的疗效。Ⅱ期临床前数据显示[13],阿帕替尼可有效抑制静脉血管内皮细胞的增殖、迁移并阻碍血管生成。同时,有研究显示[14],单独应用阿帕替尼能明显抑制VEGF-2的下游表皮因子受体生成从而阻止血管新生,并且明显优于其他抗血管生成药物,有效率为49.0% vs.33.5%。Zhang等[15]研究表明阿帕替尼可以有效抑制血管增殖、组织血管迁移,为本研究提供了理论依据。
本研究的疗效随访观察中,发现TACE联合阿帕替尼的21例患者首次治疗后,CR为3例(14.3%),PR为6例(28.6%),SD为5例(23.8%)。联合治疗效果较好,其中DCR为61.9%,ORR为38.1%。但也有部分患者疗效欠佳,其中PD为2例(9.5%)。DCR明显高于Kuzuya等[16]研究关于索拉菲尼治疗中晚期HCC33.3%的有效率。同时,本研究中伴有门静脉转移的患者,在行联合治疗后,其门静脉瘤栓坏死,血流恢复。既往研究表明[17]HCC合并门脉癌栓是临床治疗上面临的一道难题,单一模式治疗效果均不理想,总体疗效差,不仅引起肿瘤细胞的肝内播散,还导致病情快速进展、肝功能恶化,严重影响患者的预后。TACE联合口服阿帕替尼为治疗HCC合并门脉癌栓的患者提供了新的治疗选择。
本研究关于药物不良反应的观察中发现:21例患者中17例出现乏力,其中10例(47.6%)为Ⅰ度,7例(33.3%)为Ⅱ度,无患者出现重度乏力;14例(66.7%)出现轻度胃肠道反应,其中手足综合证4例(19.0%),上述不良反应多数不影响正常活动,说明口服阿帕替尼不良反应轻,多数患者可以耐受。此外,1例(4.8%)患者出现严重腹泻,3例(14.3%)出现Ⅱ~Ⅲ级高血压,1例(4.8%)出现中度蛋白尿,影响日常生活,但经药物治疗后好转,并继续阿帕替尼治疗;1例(4.8%)出现不可控制的高血压、重度蛋白尿等重度不良反应,中途停用阿帕替尼并经专科治疗后,继续服用阿帕替尼。临床治疗中应注意观察不稳定性心绞痛等不良反应,一旦出现应立即停药,并于专科治疗,以免造成致命性危害。本研究建议既往有冠状动脉粥样硬化或心绞痛等心脏疾病病史的患者,谨慎口服阿帕替尼等抗血管生成药物,以免影响因心脏缺血引起的代偿性侧枝循环建立,从而造成严重后果。
本研究结果提示,患者的不良反应程度可能与疗效正相关。21例患者中,3例CR及6例患者口服阿帕替尼治疗后1~3d即出现乏力、手足综合征、高血压等不良反应:其反应程度高于平均水平,经对症治疗后可耐受的患者,治疗1个疗程后复查甲胎蛋白较前明显降低;腹部CT显示:所有靶病灶动脉期强化消失,肿瘤液化坏死明显或所有目标病灶的长径总和减少≥30%以上。2例PD患者中,1例患者无任何不良反应出现,复查甲胎蛋白较前明显增高>2000ng/mL。本研究发现,停用阿帕替尼治疗后,较未口服阿帕替尼治疗前,病灶增多,恶化加重,肿瘤控制不理想。2例PD患者中,1例患者口服阿帕替尼2周后出现胸闷气短,呼吸困难,患者自行停药,再次复查腹部CT显示肿瘤靶病灶增大,病灶数量增多。其余4例中途停药的患者,再次复查腹部CT较服药前病灶均有不同程度增大。经过1个疗程的观察,口服阿帕替尼普遍出现乏力、恶心、呕吐、手足综合征等不良反应,有些患者甚至可出现不能耐受等情况。经验认为口服阿帕替尼初始剂量为250mg/d,患者可避免严重不良反应,同时可获得较理想的治疗效果,且依从性好。若患者出现不可耐受的不良反应、肝肾功能在口服药物期间出现严重的损害,或肿瘤标志物持续上升等情况,口服阿帕替尼可下调剂量至125mg/d;若无不良反应或复查患者病灶持续增长等情况出现,可根据患者一般情况及肝肾功能上调剂量至125mg/d。阿帕替尼服用期间出现不同程度的不良反应,可能与阿帕替尼抑制全身微小血管新生有关。
综上所述,抗血管生成靶向药物可有效抑制肿瘤细胞生长,同时减少转移的发生。本研究中TACE联合口服阿帕替尼对中晚期HCC的治疗近期疗效较好。有望提高TACE治疗中晚期HCC的疗效,降低患者体内肿瘤负荷,提高患者带瘤生存质量。但由于本研究临床样本较少,随访时间较短,远期治疗的安全性、有效性及生存期仍需大样本的临床随机对照研究进一步验证。
-
图 1 患者男性,36岁,发现HCC 1个月,CT示TACE联合阿帕替尼治疗后肿瘤变化情况
Figure 1. A 36-year-old male patient diagnosed with HCC for 1 month.CTshowed the tumor change after TACE and apatinib treatment
A.Arrow indicates the enhanced tumor in the right liver and the tumorthrombus in the branch of portal vein.Afterward, the patient was treatedwith one course of TACE and apatinib(250 mg/d); B.Follow-up contrastenhancement CT reveals that all target lesions were deposited with goodlipiodol accumulation
图 2 患者男性,57岁,发现HCC3个月余。CT与DSA显示TACE联合阿帕替尼治疗后肿瘤变化情况
Figure 2. A 57-year old male patient diagnosed with HCC for 3 months.CT and DSA showed tumor change after TACE and apatinib treatment
A.Abdominal CT shows a single enhanced lesion(arrow)in the right lobe; B.Abdominal CT shows no enhancement within the lesion(arrow); C.DSApresents the same rich blood supply lesion(arrow).Afterward, the patient was treated with one course of TACE and apatinib(250 mg/d); D.DSA showsthat the tumor stain disappeared(arrow).The case was regarded as CR by mRECIST
表 1 患者一般资料
Table 1 Patient information

表 2 联合治疗后mRESIST评价结果
Table 2 Results of mRESIST after administering the combined treatment

表 3 联合治疗后实验室检查随访结果
Table 3 Laboratory values after administering the combined treatment

表 4 联合治疗中患者出现的不良反应
Table 4 Adverse events of the combined treatment

-
[1] Lortet-Tieulent J, Soerjomataram I, Lin CC, et al.U.S.burden of cancer by race and ethnicity according to disability-adjusted life years[J].Am J Prev Med, 2016, 51(5):673-681. DOI: 10.1016/j.amepre.2016.07.039
[2] 黄书明, 陈圣开, 张涛.肝癌切除术联合术后TACE对肝癌合并门静脉癌栓患者的治疗效果及预后影响因素分析[J].中国医学前沿杂志(电子版), 2016(6):160-164. http://www.cnki.com.cn/Article/CJFDTOTAL-YXQY201606023.htm Huang SM, Chen SK, Zhang T.Analysis of the clinical effect andprognostic factors of postoperative TACE combined with hepaticcarcinectomy in the treatment of primary carcinoma of the liverwith portal vein tumor thrombus[J].Chin J Front Med Sci(Electronic Version), 2016(6):160-164. http://www.cnki.com.cn/Article/CJFDTOTAL-YXQY201606023.htm
[3] Ter Veer E, Haj MN, van Valkenhoef G, et al.Second-and third-linesystemic therapy in patients with advanced esophagogastric cancer: a systematic review of the literature[J].Cancer Metastasis Rev, 2016, 35(3):439-456. DOI: 10.1007/s10555-016-9632-2
[4] 中华人民共和国国家卫生和计划生育委员会.原发性肝癌诊疗规范(2017年版)[J].临床肝胆病杂志, 2017, (8):114-126. http://www.cnki.com.cn/Article/CJFDTOTAL-YLYS201722100.htm National Health and Family Planning Commission of the People'sRepublic of China.Diagnosis, management, and treatment of hepatocellular carcinoma(2017)[J].J Clin Hepat, 2017, (8):114-126. http://www.cnki.com.cn/Article/CJFDTOTAL-YLYS201722100.htm
[5] Mi YJ, Liang YJ, Huang HB, et al.Apatinib(YN968D1) reverses multidrugresistance by inhibiting the efflux function of multiple ATP-bindingcassette transporters[J].Cancer Res, 2010, 70(20):7981-7991. DOI: 10.1158/0008-5472.CAN-10-0111
[6] Ziogas DC, Papadatos-Pastos D, Thillai K, et al.Efficacy and safety ofsorafenib in patients with advanced hepatocellular carcinoma: age isnot a problem[J].Eur J Gastroenterol Hepatol, 2017, 29(1):48-55. DOI: 10.1097/MEG.0000000000000739
[7] Shiozawa K, Watanabe M, Ikehara T, et al.Efficacy of Sorafenib versus hepatic arterial infusion chemotherapy for advanced hepatocellular carcinoma refractory to transcatheter arterial chemoembolization[J].Gan To Kagaku Ryoho, 2015, 42(8):953-956. https://www.ncbi.nlm.nih.gov/pubmed/20565419
[8] Watanabe Y, Nakaba H, Taniguchi E, et al.Successful treatment ofmetastatic hepatocellular carcinoma with sorafenib combined withtranscatheter arterial chemoembolization/hepatic arterial infusion chemotherapy[J].Gan To Kagaku Ryoho, 2014, 41(12):2110-2112.
[9] Lin C, Wang S, Xie W, et al.Apatinib inhibits cellular invasion andmigration by fusion kinase KIF5B-RET via suppressing RET/Src sig-naling pathway[J].Oncotarget, 2016, 7(37):59236-59244. DOI: 10.18632/oncotarget.v7i37
[10] Jayson GC, Kerbel R, Ellis LM, et al.Antiangiogenic therapy in oncology:current status and future directions[J].Lancet, 2016, 388(10043):518-529. DOI: 10.1016/S0140-6736(15)01088-0
[11] Fontanella C, Ongaro E, Bolzonello S, et al.Clinical advances in thedevelopment of novel VEGFR2 inhibitors[J].Ann Transl Med, 2014, 2(12):123. https://www.ncbi.nlm.nih.gov/pubmed/25568876
[12] Zhu XR, Zhu ML, Wang Q, et al.A case report of targeted therapywith apatinib in a patient with advanced gastric cancer and high serum level of alpha-fetoprotein[J].Medi(Baltimore), 2016, 95(37):e4610. DOI: 10.1056/NEJMc0911925?query=nextarrow&
[13] Mi YJ, Liang YJ, Huang HB, et al.Apatinib(YN968D1) reverses multidrugresistance by inhibiting the efflux function of multiple ATP-bindingcassette transporters[J].Cancer Res, 2010, 70(20):7981-7991. DOI: 10.1158/0008-5472.CAN-10-0111
[14] Shan F, Miao R, Xue K, et al.Controlling angiogenesis in gastric cancer:A systematic review of anti-angiogenic trials[J].Cancer Lett, 2016, 380(2):598-607. DOI: 10.1016/j.canlet.2015.12.023
[15] Zhang H.Apatinib for molecular targeted therapy in tumor[J].DrugDes Devel Ther, 2015, (9):6075-6081. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4654530/table/t1-dddt-9-6075/
[16] Kuzuya T, Ishigami M, Ishizu Y, et al.Fever within 2 weeks of sorafenibtherapy predicts favorable treatment efficacy in patients with advanced hepatocellular carcinoma[J].Oncol, 2016, 91(5):261-266. DOI: 10.1159/000449000
[17] Chung SM, Yoon CJ, Lee SS, et al.Treatment outcomes of transcatheter arterial chemoembolization for hepatocellular carcinoma thatinvades hepatic vein or inferior vena cava[J].Cardiovasc Int Radiol, 2014, 37(6):1507-1515. DOI: 10.1007/s00270-014-0841-1
-
期刊类型引用(59)
1. 姚忠强,李炜,王娟毅,高智志,马建梅,曲凯,周涛. 华蟾素胶囊联合阿帕替尼对二线治疗失败后晚期胃癌患者的免疫细胞及预后影响. 世界中医药. 2023(05): 654-657 .  百度学术
百度学术
2. 于洋. 肝动脉化疗栓塞术联合阿帕替尼对原发性肝癌患者疾病缓解率、免疫功能的影响. 黑龙江医药科学. 2023(02): 123-124 .  百度学术
百度学术
3. 孙志强,姜成毅,李佰萍,韩庆贺,陈健. TACE联合不同剂量阿帕替尼治疗中晚期肝癌的临床疗效及不良反应. 中国老年学杂志. 2022(03): 557-560 .  百度学术
百度学术
4. 顾杰,许晨,周卫忠,刘圣,施海彬. TACE联合低剂量阿帕替尼治疗中晚期肝癌的疗效及生存预后分析. 介入放射学杂志. 2022(02): 143-147 .  百度学术
百度学术
5. 王建. CT引导下经皮微波消融术对肝癌患者免疫功能及生存率的影响. 哈尔滨医药. 2022(01): 70-71 .  百度学术
百度学术
6. 沈裕厚,岳爱民,陈挺松. TACE联合SPVE在肝癌二期切除术中的应用效果及对残余肝体积的影响. 临床医学研究与实践. 2021(08): 44-45+48 .  百度学术
百度学术
7. 华琼博,牟海波,郭勇. 水木两滋汤加味对肝肾阴亏型中晚期原发性肝癌患者TACE后的疗效及其外周血T淋巴细胞亚群的影响. 中国现代医生. 2021(05): 129-132 .  百度学术
百度学术
8. 程瑜蓉,严冬,杨建东,孔曼,刘义,张佩华. 肝动脉栓塞化疗联合索拉非尼在原发性肝癌治疗中应用效果及对患者免疫功能影响. 临床军医杂志. 2021(03): 290-291 .  百度学术
百度学术
9. 李青薛. CT灌注成像用于评估TACE联合阿帕替尼治疗中晚期原发性肝癌疗效的临床研究. 中国CT和MRI杂志. 2021(05): 59-62 .  百度学术
百度学术
10. 黄娜,刘强,周晓琳. 仑伐替尼在原发性肝癌治疗中的研究进展. 巴楚医学. 2021(02): 111-115 .  百度学术
百度学术
11. 姚忠强,王斐斐,马建梅,曲凯,何婷. 阿帕替尼对二线治疗失败的Ⅲ B期和Ⅳ期胃癌患者免疫细胞的影响. 现代消化及介入诊疗. 2021(05): 610-613 .  百度学术
百度学术
12. 顾杰,许晨,周卫忠,刘圣,施海彬. TACE联合阿帕替尼对比单独TACE治疗中晚期原发性肝癌的倾向性匹配分析. 介入放射学杂志. 2021(07): 724-729 .  百度学术
百度学术
13. 陈坤,李元明. 肝动脉化疗栓塞术联合甲磺酸阿帕替尼片治疗晚期肝癌的疗效及安全性评价. 医学影像学杂志. 2021(07): 1208-1211 .  百度学术
百度学术
14. 余海涛,杨惠芳,姜之明. 肝动脉化疗栓塞联合阿帕替尼治疗中晚期肝细胞癌的疗效及对血清HSP90α及AFP的影响. 现代实用医学. 2021(07): 901-903 .  百度学术
百度学术
15. 翟焕阁,肖正红,杨双林. CT引导下氩氦刀冷冻消融术辅助治疗原发性肝癌对肿瘤组织血流变化的影响. 中国CT和MRI杂志. 2021(09): 96-99+110 .  百度学术
百度学术
16. 韩绪生,凌冰,杨勇,乔风雷,赵东波. TACE联合阿帕替尼治疗中晚期肝癌的临床研究. 介入放射学杂志. 2021(09): 941-944 .  百度学术
百度学术
17. 周杰斌,李倩. 肝动脉化疗栓塞术联合阿帕替尼治疗肝癌的效果及对免疫功能的影响. 中外医学研究. 2021(26): 25-27 .  百度学术
百度学术
18. 赵芳芳,王丽. 零缺陷护理对肝癌切除术患者胃肠功能、应激反应及并发症的影响. 临床医学工程. 2021(12): 1711-1712 .  百度学术
百度学术
19. 董小平,张鸽. 甲磺酸阿帕替尼片联合肝动脉化疗栓塞术治疗中晚期肝癌的效果观察. 中国实用医刊. 2021(21): 29-32 .  百度学术
百度学术
20. 郭巍巍. 阿帕替尼辅助治疗原发性肝癌的价值探析. 名医. 2021(16): 177-178 .  百度学术
百度学术
21. 谢鑫,莫伟,阳秀春. 阿帕替尼联合介入治疗肝癌不良反应的观察及护理. 当代护士(下旬刊). 2020(02): 126-127 .  百度学术
百度学术
22. 王瑞亭,袁国盛. 阿帕替尼联合TACE治疗肝细胞肝癌合并门静脉癌栓的临床疗效. 广东医学. 2020(01): 19-24 .  百度学术
百度学术
23. 林秀强. 肝动脉栓塞化疗术联合小分子靶向治疗对晚期肝癌的效果. 深圳中西医结合杂志. 2020(01): 184-185 .  百度学术
百度学术
24. 黄俊生,曾立,蔡俊义. 艾迪注射液联合经肝动脉化疗栓塞术治疗中晚期肝癌效果观察. 中国医药科学. 2020(04): 251-253+276 .  百度学术
百度学术
25. 陆阳,汤蕊嘉,谢璇丞,赵卫. TACE联合阿帕替尼治疗中晚期肝细胞癌无进展生存时间的影响因素分析. 介入放射学杂志. 2020(03): 246-250 .  百度学术
百度学术
26. 袁牧,谭玉林,张阳,杨培培,谢波,魏建筑,钱景瑜,祝子祎. 阿帕替尼联合TACE治疗原发性肝癌不良反应分析及处理对策. 齐齐哈尔医学院学报. 2020(03): 299-301 .  百度学术
百度学术
27. 唐贵菊,田塬,王继婷,苏松,李亚玲. 阿帕替尼联合TACE术治疗中晚期肝癌有效性与安全性的Meta分析. 中国药房. 2020(12): 1487-1494 .  百度学术
百度学术
28. 包学智. 经肝动脉化疗栓塞联合射频消融术治疗中晚期原发性肝癌的效果. 医学信息. 2020(19): 110-112 .  百度学术
百度学术
29. 邓仝彤,崔智飞,李蒙迪,魏淮升. CT、DSA和超声造影诊断肝癌HAE术后残余血供的价值对比. 中国CT和MRI杂志. 2020(11): 104-106 .  百度学术
百度学术
30. 杨柱梅,邓杰,张红银,殷家福,孔树佳. 经导管肝动脉化疗栓塞联合阿帕替尼治疗中晚期肝癌的Meta分析. 肿瘤药学. 2020(05): 600-607 .  百度学术
百度学术
31. 朱鸷翔,沈松鹤,赵森,王大勇,王志学,李荟苹,吴涛. 中晚期原发性肝癌TACE介入微创治疗的疗效和对肝功能的影响. 黑龙江医学. 2020(11): 1483-1485 .  百度学术
百度学术
32. 郭永坤. TACE联合肿瘤肝外侧支循环栓塞术治疗原发性肝癌疗效评价. 临床研究. 2019(02): 1-2 .  百度学术
百度学术
33. 周娓. 甲磺酸阿帕替尼治疗晚期原发性肝癌临床疗效及安全性分析. 中国继续医学教育. 2019(02): 121-123 .  百度学术
百度学术
34. 张怀峰. 甲磺酸阿帕替尼治疗晚期原发性肝癌的临床疗效及安全性. 智慧健康. 2019(04): 109-110 .  百度学术
百度学术
35. 陆阳,姜永能,万程,赵卫,寸江平,范宏杰,蔡顺然,陈亚东. 阿帕替尼联合TACE治疗中晚期肝细胞癌的疗效研究. 介入放射学杂志. 2019(02): 162-165 .  百度学术
百度学术
36. 白桦,肖鹏,栗敏,刘俊启. 介入化疗栓塞联合阿帕替尼治疗局部中晚期肝癌的临床观察. 医药论坛杂志. 2019(03): 7-10 .  百度学术
百度学术
37. 李薇. 不同方法治疗晚期肝癌的效果. 中国处方药. 2019(05): 131-132 .  百度学术
百度学术
38. 陈德志,陈巧辉,陈惠萍,许燕玉,陈志民. 阿帕替尼在原发性肝癌治疗中的应用研究进展. 中国药业. 2019(12): 128-131 .  百度学术
百度学术
39. 周爱静,段红光,程崇勇,高峰. GEMOX化疗联合肝动脉化疗栓塞术对晚期原发性肝癌患者疾病控制率及肝功能的影响. 医药论坛杂志. 2019(07): 93-94 .  百度学术
百度学术
40. 杨嘉文. TACE分别联合微波消融、~(125)I放射性粒子植入及阿帕替尼靶向治疗大肝癌的疗效比较. 中国医师杂志. 2019(08): 1190-1194 .  百度学术
百度学术
41. 甄振华,申传厚,杜文凯. 阿帕替尼联合槐耳颗粒治疗晚期原发性肝癌的临床疗效. 现代肿瘤医学. 2019(17): 3086-3089 .  百度学术
百度学术
42. 牙韩达,韦亚娜. 阿帕替尼联合经动脉化疗栓塞对肝癌患者甲胎蛋白的影响分析. 吉林医学. 2019(09): 2047-2048 .  百度学术
百度学术
43. 刘勇. 介入治疗联合靶向药物阿帕替尼在原发性肝癌治疗中的应用价值探索. 基层医学论坛. 2019(29): 4287-4288 .  百度学术
百度学术
44. 刘洪敬,冯将,杨建军. 以TACE为主综合治疗原发性肝癌的研究进展. 延安大学学报(医学科学版). 2019(03): 82-86 .  百度学术
百度学术
45. 韦亚娜,牙韩达. 甲磺酸阿帕替尼治疗50例晚期原发性肝癌的效果分析. 当代医学. 2019(29): 107-109 .  百度学术
百度学术
46. 周林荣,姚清深,陈宁,李晓和,庞成,杨宇. 甲磺酸阿帕替尼对晚期原发性肝癌患者临床缓解率及不良反应的影响. 现代诊断与治疗. 2019(18): 3161-3162 .  百度学术
百度学术
47. 谢青云,雷泽华,高峰畏,蒋康怡,刘宇. 甲磺酸阿帕替尼联合callispheres载药微球-肝动脉化疗栓塞术(DEB-TACE)治疗中晚期肝细胞癌的临床疗效分析. 肝胆外科杂志. 2019(02): 95-99 .  百度学术
百度学术
48. 张璐西,吴金平,阮程华,吴康. TACE联合阿帕替尼治疗肝细胞肝癌伴门静脉癌栓疗效研究. 生物医学工程与临床. 2019(06): 683-687 .  百度学术
百度学术
49. 翁志成,彭建扬,吴伟达,张春生,林群,潘喜鹏. 阿帕替尼联合S-TACE治疗中晚期原发性肝癌的疗效及安全性评价. 癌症进展. 2019(22): 2666-2669 .  百度学术
百度学术
50. 陆阳,赵卫,李星海,范宏杰,汤蕊嘉. TACE联合阿帕替尼或微波消融治疗中晚期肝细胞癌现状. 中国介入影像与治疗学. 2018(07): 443-446 .  百度学术
百度学术
51. 张振坤,王筱芳,吴福勇. 阿帕替尼靶向治疗联合调强放疗在胃癌患者中的应用及对治疗依从性影响. 新疆医科大学学报. 2018(08): 971-974 .  百度学术
百度学术
52. 朱土福,黎昌国. 阿帕替尼应用于晚期肝癌患者的临床疗效和安全性分析. 临床医学工程. 2018(05): 621-622 .  百度学术
百度学术
53. 曾筱怡. 阿帕替尼联合TACE治疗原发性肝癌的临床研究. 基层医学论坛. 2018(11): 1442-1444 .  百度学术
百度学术
54. 钟慧,钟贞武,吴莉芳,钟瑜,林周美. 阿帕替尼联合复方苦参注射液治疗恶性肿瘤的临床研究. 中国当代医药. 2018(11): 130-132 .  百度学术
百度学术
55. 黄锐,姚立正,李文会,王学俊. 肝动脉化疗栓塞术联合甲磺酸阿帕替尼片治疗中晚期肝癌的疗效及安全性评价. 肿瘤. 2018(10): 965-972 .  百度学术
百度学术
56. 孙扬,王昊鹏. 肝动脉化疗栓塞术(TACE)在肝癌治疗中的应用. 世界最新医学信息文摘. 2018(90): 40+240 .  百度学术
百度学术
57. 曾广源,吴龚丽莉,郑文,王家寿. 阿帕替尼片联合肝动脉化疗栓塞术治疗中晚期原发性肝癌的临床研究. 中国临床药理学杂志. 2018(23): 2693-2696 .  百度学术
百度学术
58. 李红学,刘军杰,胡巧琴,李航. 超声造影在肝癌TACE术后残留诊治中的价值. 医学研究杂志. 2018(10): 57-60 .  百度学术
百度学术
59. 李少明,汤万荣,李薇,杨荣彬. 经肝动脉化疗栓塞联合射频消融术对术中晚期原发性肝癌的近期疗效分析. 中国医药科学. 2018(22): 223-225+250 .  百度学术
百度学术
其他类型引用(15)



 下载:
下载: