Treatment outcomes of different induction chemotherapy regimens combined with intensity-modulated radiotherapy in nasopharyngeal carcinoma
-
摘要:目的 分析诱导化疗后行调强放疗的鼻咽癌患者,对比不同诱导化疗方案的治疗疗效。方法 回顾性分析2012年1月至2014年6月天津医科大学肿瘤医院初治170例Ⅱ~Ⅳb期鼻咽癌患者临床资料,其中男性126例,女性44例;Ⅱ期27例,Ⅲ期105例,Ⅳa~b期38例。结果 全组中位随访时间34个月。3年总生存率、局部区域控制率、无病生存率和无远处转移生存率分别为82.8%、91.5%、76.7%和69.1%。多因素分析发现,含紫杉醇+顺铂的诱导化疗方案较顺铂+5-氟尿嘧啶疾病进展(HR:1.820,95%CI:1.013~3.271,P=0.045)及远处转移风险(HR:2.240,95%CI:1.017~4.090,P=0.045)显著降低。结论 含紫杉醇+顺铂的诱导化疗方案较顺铂+5-氟尿嘧啶方案显著延长鼻咽癌患者无病生存率和无远处转移生存率。Abstract:Objective The role of induction chemotherapy (IC) and preferred regimens is not very clear in non-endemic nasopharyngeal carcinoma (NPC) in northern China.Methods A total of 170 pathologically proven locoregional advanced NPCs between January 2012 and December 2014 were included in this analysis. One hundred and twenty-six were men and 44 patients were women. According to the American Joint Committee on Cancer (AJCC) 7th stage system, 48 patients were T1-2 and 77 patients were T3-4; 48 patients were N0-1 and 122 patients were N2-3; 27 patients were stage Ⅱ, 105 patients were stage Ⅲ, and 38 patients were stage IVa-b.Results The median follow-up time was 34 months. The 3-year overall survival (OS), locoregional failure-free survival (LRFS), distant metastasis-free survival (DMFS), and disease-free survival (DFS) were 82.8%, 91.5%, 76.7%, and 69.1%, respectively. Multivariate analyses showed that IC with TPF (docetaxel, carboplatin, and fluorouracil) or TP (docetaxel and cisplatin) presented superior DFS and DMFS compared with PF (cisplatin+5-FU) [DFS-hazard ratio (HR): 1.820, 95% confidence interval (CI): 1.013-3.271, P=0.045; DMFS-HR: 2.240, 95% CI: 1.017-4.090, P=0.045].Conclusions The IC regimens appeared to affect patients' outcomes, and TP-containing IC regimens conferred better DFS and DMFS than PF regimens.
-
鼻咽癌好发于我国东南部,其发病与EB病毒感染相关,是我国最常见的头颈部恶性肿瘤之一。鼻咽癌不同于其他头颈部鳞癌,具有独特的流行病学、临床特征及预后特点[1]。鼻咽癌对放化疗均敏感[2-5],放疗为主要治疗手段,5年总生存率约80%。随着放疗技术的不断进步,调强放疗已成为鼻咽癌的主流治疗模式。在调强放疗治疗技术下,鼻咽癌局部区域控制率可达90%,复发率低于10%[2-5]。而远处转移发生率却高达20%~30%,远处转移为最主要失败原因,也是最主要的致死原因。因而,如何降低远处转移成为主要研究方向之一。
基于多项前瞻性研究及荟萃分析显示同步化疗较单纯放疗显著改善预后[6-7]。同步放化疗是局部晚期鼻咽癌标准治疗手段。如何在同步放化疗基础上,进一步降低远处转移率成为改善预后的重要研究方向[8]。辅助化疗因其耐受性欠佳,仅约2/3患者完成计划性辅助治疗,且既往研究同步化疗基础上联合辅助化疗并未显著改善预后,致使辅助化疗难以成为标准[9]。相对而言,诱导化疗具有更好的治疗耐受性,且诱导化疗可减少肿瘤负荷,降低放疗体积,更好地保护正常器官。同时,诱导化疗能够清除血液中潜在的微转移病灶,具有潜在降低鼻咽癌远处转移作用[4]。
虽然已有多项研究显示鼻咽癌同步放化疗联合诱导化疗的安全性和疗效尚可,但均来自鼻咽癌高发区,且采用的诱导化疗方案不一[4-5, 10-12]。因此,为评估诱导化疗后调强放疗治疗非高发区局部晚期鼻咽癌的疗效,并对比不同诱导化疗方案的疗效,以期探索最为合适的诱导化疗方案,本研究组开展了这项回顾性临床研究。
1. 材料与方法
1.1 材料
回顾性分析2012年1月至2014年6月共406例天津医科大学肿瘤医院初治病理确诊的Ⅱ~Ⅳb期(AJCC 7th)鼻咽癌患者的临床资料。入组条件为卡氏评分≥ 70分、接受诱导化疗和调强放疗。排除条件为合并第二原发癌者。
1.2 方法
所有患者均接受诱导化疗,诱导化疗方案不一,主要为PF(顺铂+5-氟尿嘧啶)、TP(紫杉醇+顺铂)及TPF(紫杉醇+顺铂+5-氟尿嘧啶)三种。具体如下:PF方案为顺铂100 mg/(m2·d)静脉滴注d1~3和5-氟尿嘧啶800~1 000 mg/m2 d1~5;TP为多西他赛或紫杉醇75 mg/m2 d1和顺铂100 mg/(m2·d)d1~3;TPF为多西他赛或紫杉醇75 mg/m2 d1,顺铂80~100 mg/(m2·d)d1~3,5-氟尿嘧啶800~1 000 mg/m2 d1~5。同步化疗为单药顺铂75~80(mg/m2·3W)d1~3。放疗技术为调强放疗,处方剂量为95%PGTV(肿瘤区和转移淋巴结)69.96 Gy/2.12 Gy/33 f;PTV1(高危区)为60.06 Gy/1.82 Gy/ 33 F;PTV2(低危区)为50.96 Gy/1.82 Gy/28 F。
1.3 统计学方法
采用SPSS 20.0软件进行统计学分析。组间比较采用χ2检验,生存分析采用Kaplan-meier法,采用Cox回归模型进行单因素及多因素分析。P < 0.05为差异具有统计学意义。
2. 结果
2.1 病例特征及治疗资料
共170例患者纳入分析,其中男性126例,女性44例;中位年龄53(15~73)岁。T1~2期93例,T3~ 4期77例;N0~1期48例,N2~3期122例;Ⅱ期27例,Ⅲ期105例,Ⅳa~b期38例。其中诱导化疗为TPF 66例,TP 54例,PF 50例;中位诱导化疗周期为2(1~6)个周期。同步化疗99例,中位同步化疗周期数为2(1~3)个周期。PGTV中位剂量为69.96(66~ 70)Gy。见表 1。
表 1 170例Ⅱ~Ⅳb期鼻咽癌患者病例特征及治疗资料
2.2 总体治疗疗效及失败模式
全组中位随访时间34(20~56)个月。3年总生存(overall survival,OS)率、3年无局部区域复发生存(locoregional failure free survival,LRFS)率、3年无远处转移生存(distant metastasis free survival,DMFS)率和3年无病生存(disease free survival,DFS)率分别是82.8%、91.5%、76.7%和69.1%。全组43例(25%)患者失败,其中13例患者出现局部区域复发,占8%;而32例患者出现远处转移,占19%。远处转移是主要的失败模式,占总失败的74%。
2.3 不同诱导化疗方案的治疗疗效
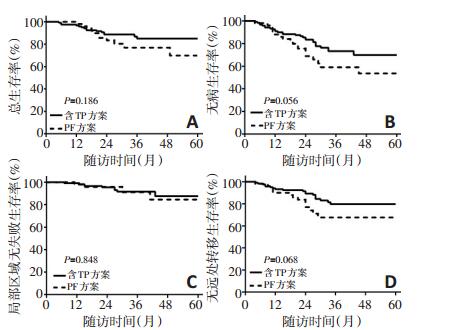
为对比不同诱导化疗方案疗效,按诱导化疗方案是否含有紫杉醇(T)和顺铂(P)将患者分为含TP组(TPF/ TP)和PF组。两组病例的临床特征及治疗资料分布均衡,差异无统计学意义(P>0.05,表 2)。两组生存曲线见图 1,结果显示含TP组较PF组DFS(73.3% vs. 59.0%,P=0.056)和DMFS提高(79.7% vs. 69.3%,P=0.068),P值均为临界统计学差异。含TP组较PF组的3年OS亦提高9%,但差异无统计学意义(85.0% vs. 75.9%,P= 0.186)。两组的3年LRFS无显著性差异(91.6% vs. 91.1%,P=0.848)。
表 2 不同诱导化疗方案(含TP组和PF组)的临床特征及治疗资料 例(%)
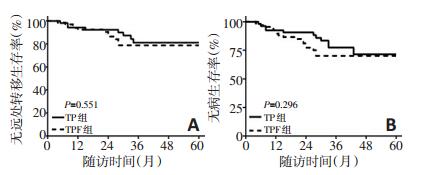
将含TP组进一步分为TPF组与TP组,发现两组DMFS及DFS差异均无统计学意义(P>0.05),两组的3yDMFS分别是80.0%和79.6%(P=0.551);两组的3y-DFS分别是71.2%和76.0%(P=0.296)。两组生存曲线见图 2。
2.4 预后因素分析
采用Cox模型进行单因素及多因素分析,单因素结果见表 3。多因素结果显示临床分期及化疗周期数是影响OS的独立预后因素,临床分期和诱导化疗方案是影响DFS和DMFS的独立预后因素。与PF诱导化疗方案相比较,TPF方案或是TP方案显著降低了疾病进展及远处转移的风险(DFS:HR=1.820,95%CI:1.013~ 3.271,P=0.045;DMFS:HR=2.240,95%CI:1.017~4.090,P=0.045)。未发现与局部区域控制相关的预后因素。多因素分析结果见表 4。
表 3 单因素分析结果 表 4 多因素分析结果
表 4 多因素分析结果
3. 讨论
鼻咽癌是我国高发的头颈部恶性肿瘤,具有独特的地区分布差异,高发于我国东南部,西部及北部发病率低。由于鼻咽癌发病部位隐匿,且极易出现淋巴结转移,鼻咽癌初诊时约75%~90%为局部晚期[13]。INT 0099研究奠定了同步放化疗成为局部晚期鼻咽癌的标准治疗模式[14]。随后几项随机对照研究及荟萃分析结果显示,较单纯放疗相比,同步化疗的加入显著提高了局部区域控制率,改善了总生存[15-16]。随着化疗的广泛应用及放疗技术的不断进步,鼻咽癌5年局部区域控制率达90%以上。远处转移成为鼻咽癌主要的失败模式,发生率为25%~ 30%[2-3]。如何筛选远处转移高危患者,并进一步降低远处转移率,是提高鼻咽癌治疗疗效的主要方向之一。
加强系统治疗,包括辅助化疗或诱导化疗,是降低远处转移的措施之一。然而辅助化疗因其耐受性较差,仅约2/3患者能按期完成足疗程化疗,且研究显示辅助化疗并未显著改善预后[17-18]。而诱导化疗具有更好的耐受性,90%以上能按计划完成[4]。且诱导化疗能够缩小肿瘤体积,缩小接下来放疗的靶区体积,更好地保护危及器官,同时能清除血液中甚至是远处可能存在的潜在微小转移灶,降低远处转移风险。前瞻性Ⅱ/Ⅲ期临床研究探索同步放化疗基础上联合诱导化疗的疗效和安全性[5, 10, 12]。这些研究结果均来自鼻咽癌高发区。为评估诱导化疗在非高发区鼻咽癌疗效,本中心回顾性分析诱导化疗后行调强放疗同步或未同步化疗的局部晚期北方鼻咽癌病例,其中超过2/3患者为N2~3期,病期偏晚。结果显示3年总生存率、局部区域控制率、无远处转移生存率和无病生存率分别为82.8%、91.5%、76.7%和69.1%,与既往文献报道结果一致[19]。远处转移仍为最主要失败模式,占总失败的74%。
多个前瞻性临床研究探讨同步放化疗基础上联合诱导化疗的疗效,结论不一,可能的重要因素为各个研究中采用的诱导化疗方案不一。Hui等[4]采用紫杉醇联合顺铂,Fountzilas等[5]采用顺铂、表柔比星及紫杉醇,Tan等[11]和Zhao等[22]采用的是吉西他滨和顺铂/卡铂,Sun等[10]采用的是紫杉醇、顺铂和5-氟尿嘧啶治疗。TAX323和TAX324研究对比TPF与PF诱导化疗后单纯放疗(TAX323)[20]和同步放化疗(TAX324)[21]治疗非鼻咽癌的其他头颈部鳞癌的疗效分析,结果均显示TPF诱导化疗较PF诱导化疗显著改善无疾病进展生存率和总生存率,该两项研究奠定了TPF方案在头颈部鳞癌中诱导化疗的地位。针对鼻咽癌是否存在同样规律的研究,目前仅有一项Ⅲ期前瞻性临床研究(NCT 01536223)对比TPF和PF诱导化疗方案在鼻咽癌治疗中的疗效,其中期结果显示2年的无进展生存分别为84.5%和77.9%(P= 0.380)[23]。尽管相较于PF诱导化疗,TPF诱导提高了2年无进展生存达7%,然而差异无统计学意义。因此,为探索鼻咽癌最佳的诱导化疗方案,本研究对比不同诱导化疗方案的疗效。结果显示TPF/TP诱导化疗较PF方案显著降低了远处转移及疾病进展的风险。
目前,同步放化疗仍是局部晚期鼻咽癌的标准治疗模式,然而这一治疗模式推荐是基于二维放疗年代的证据[6]。调强放疗因其更好的剂量分布,较二维放疗提高了局部区域控制率,目前已成为鼻咽癌的主流放疗技术[8]。多个中心较大样本的回顾性资料显示,在调强放疗年代,同步化疗的加入并未显著改善预后[24]。因此在调强放疗年代,是否仍需要同步化疗尚不明确。尽管本中心对于局部晚期鼻咽癌推荐诱导化疗后行同步放化疗,但仍有少部分患者在诱导化疗后,因为种种原因未行同步化疗。即便如此,本研究中170例局部晚期鼻咽癌患者诱导化疗后行IMRT同步或未同步化疗疗效尚可。单因素分析亦显示同步化疗并未显著降低局部区域复发率及远处转移率,与其他回顾性资料结果一致。目前已有三项对比鼻咽癌调强放疗同步化疗与单纯放疗的前瞻性Ⅲ期临床研究正在进行中(NCT01817023,NCT03015727,NCT01854203),期待这些临床研究的结果将为调强放疗年代鼻咽癌是否仍需要行同步化疗提供新证据。
本研究显示,TPF/TP的诱导化疗方案较PF方案显著改善了鼻咽癌患者的无病生存率和无远处转移生存率。但本研究是基于我国北方鼻咽癌的单中心治疗结果,样本量较少且为回顾性分析,可能存在病例选择偏移。有关鼻咽癌最优的诱导化疗方案,期待前瞻性Ⅲ期临床研究(NCT01536223,对比TPF与PF诱导化疗联合同步放化疗用于局部晚期鼻咽癌的疗效)的终期结果。
-
表 1 170例Ⅱ~Ⅳb期鼻咽癌患者病例特征及治疗资料

表 2 不同诱导化疗方案(含TP组和PF组)的临床特征及治疗资料 例(%)

表 3 单因素分析结果

表 4 多因素分析结果

-
[1] Chapman CH, Parvathaneni U, Yom SS. Revisiting induction chemotherapy before radiotherapy for head and neck cancer, partⅡ: nasopharyngeal carcinomap[J]. Future Oncol, 2017, 13(7):581-584. DOI: 10.2217/fon-2016-0544
[2] Sun X, Su S, Chen C, et al. Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma: an analysis of survival and treatment toxicities[J]. Radiother Oncol, 2014, 110(3):398-403. DOI: 10.1016/j.radonc.2013.10.020
[3] Ng WT, Lee MC, Chang AT, et al. The impact of dosimetric inadequacy on treatment outcome of nasopharyngeal carcinoma with IMRT [J]. Oral Oncol, 2014, 50(5):506-512. DOI: 10.1016/j.oraloncology.2014.01.017
[4] Hui EP, Ma BB, Leung SF, et al. Randomized phase Ⅱ trial of concurrent cisplatin-radiotherapy with or without neoadjuvant docetaxel and cisplatin in advanced nasopharyngeal carcinoma[J]. J Clin Oncol, 2009, 27(2):242-249. DOI: 10.1200/JCO.2008.18.1545
[5] Fountzilas G, Ciuleanu E, Bobos M, et al. Induction chemotherapy followed by concomitant radiotherapy and weekly cisplatin versus the same concomitant chemoradiotherapy in patients with nasopharyngeal carcinoma: a randomized phase Ⅱ study conducted by the Hellenic Cooperative Oncology Group (HeCOG) with biomarker evaluation[J]. Ann Oncol, 2012, 23(2):427-435. DOI: 10.1093/annonc/mdr116
[6] Baujat B, Audry H, Bourhis J, et al. Chemotherapy in locally advanced nasopharyngeal carcinoma: an individual patient data meta-analysis of eight randomized trials and 1753 patients[J]. Int J Radiat Oncol Biol Phys, 2006, 64(3):47-56.
[7] Blanchard P, Lee A, Marguet S, et al. Chemotherapy and radiotherapy in nasopharyngeal carcinoma: an update of the MAC-NPC metaanalysis[J]. Lancet Oncol, 2015, 16(6):645-655. DOI: 10.1016/S1470-2045(15)70126-9
[8] Wu LR, Liu YT, Jiang N, et al. Ten-year survival outcomes for patients with nasopharyngeal carcinoma receiving intensity-modulated radiotherapy: An analysis of 614 patients from a single center [J]. Oral Oncol, 2017, 69(3):26-32. https://www.sciencedirect.com/science/article/pii/S1368837517300787
[9] Chen L, Hu CS, Chen XZ, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: a phase 3 multicentre randomised controlled trial[J]. Lancet Oncol, 2012, 13(2):163-171. DOI: 10.1016/S1470-2045(11)70320-5
[10] Sun Y, Li WF, Chen NY, et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a phase 3, multicentre, randomised controlled trial[J]. Lancet Oncol, 2016, 17(11):1509-1520. DOI: 10.1016/S1470-2045(16)30410-7
[11] Tan T, Lim WT, Fong KW, et al. Concurrent chemo-radiation with or without induction gemcitabine, Carboplatin, and Paclitaxel: a randomized, phase 2/3 trial in locally advanced nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2015, 91(5):952-960. DOI: 10.1016/j.ijrobp.2015.01.002
[12] Airoldi M, Gabriele AM, Garzaro M, et al. Induction chemotherapy with cisplatin and epirubicin followed by radiotherapy and concurrent cisplatin in locally advanced nasopharyngeal carcinoma observed in a non-endemic population[J]. Radiother Oncol, 2009, 92 (1):105-110. DOI: 10.1016/j.radonc.2009.02.005
[13] Lee AW, Ma BB, Ng WT, et al. Management of nasopharyngeal carcinoma: current practice and future perspective[J]. J Clin Oncol, 2015, 33(29):3356-3364. DOI: 10.1200/JCO.2015.60.9347
[14] Al-Sarraf M, LeBlanc M, Giri PG, et al. Chemoradiotherapy versus radiotherapy in patients with advanced nasopharyngeal cancer: phase Ⅲ randomized Intergroup study 0099[J]. J Clin Oncol, 1998, 16(4):1310-1307. DOI: 10.1200/JCO.1998.16.4.1310
[15] Wee J, Tan EH, Tai BC, et al. Randomized trial of radiotherapy versus concurrent chemoradiotherapy followed by adjuvant chemotherapy in patients with American Joint Committee on Cancer/International Union against cancer stage Ⅲ and Ⅳ nasopharyngeal cancer of the endemic variety[J]. J Clin Oncol, 2005, 23(27):6730-6738. DOI: 10.1200/JCO.2005.16.790
[16] Chan AT, Leung SF, Ngan RK, et al. Overall survival after concurrent cisplatin-radiotherapy compared with radiotherapy alone in locoregionally advanced nasopharyngeal carcinoma[J]. J Natl Cancer Inst, 2005, 97(7):536-539. DOI: 10.1093/jnci/dji084
[17] Lee AW, Ngan RK, Tung SY, et al. Preliminary results of trial NPC-0501 evaluating the therapeutic gain by changing from concurrent-adjuvant to induction-concurrent chemoradiotherapy, changing from fluorouracil to capecitabine, and changing from conventional to accelerated radiotherapy fractionation in patients with locoregionally advanced nasopharyngeal carcinoma[J]. Cancer, 2015, 121(8):1328-1338. DOI: 10.1002/cncr.v121.8
[18] Chen L, Hu CS, Chen XZ, et al. Adjuvant chemotherapy in patients with locoregionally advanced nasopharyngeal carcinoma: Long term results of a phase 3 multicentre randomised controlled trial [J]. Eur J Cancer, 2017, 75(2):150-158. https://www.sciencedirect.com/science/article/pii/S0959804917300461
[19] Kawahira M, Yokota T, Hamauchi S, et al. Survival benefit of adding docetaxel, cisplatin, and 5-fluorouracil induction chemotherapy to concurrent chemoradiotherapy for locally advanced nasopharyngeal carcinoma with nodal Stage N2-3[J]. Jpn J Clin Oncol, 2017, 47 (8):705-712. DOI: 10.1093/jjco/hyx057
[20] Vermorken JB, Remenar E, van Herpen C, et al. Cisplatin, fluorouracil, and docetaxel in unresectable head and neck cancer[J]. N Engl J Med, 2007, 357(17):1695-1704. DOI: 10.1056/NEJMoa071028
[21] Posner MR, Hershock DM, Blajman CR, et al. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer[J]. N Engl J Med, 2007, 357(17):1705-1715. DOI: 10.1056/NEJMoa070956
[22] Zhao L, Xu M, Jiang W, et al. Induction chemotherapy for the treatment of non-endemic locally advanced nasopharyngeal carcinoma [J]. Oncotarget, 2017, 8(4):6763-6774. https://www.researchgate.net/publication/311993355_Induction_chemotherapy_for_the_treatment_of_non-endemic_locally_advanced_nasopharyngeal_carcinoma/fulltext/587dfdee08aed3826af4137f/311993355_Induction_chemotherapy_for_the_treatment_of_non-endemic_locally_advanced_nasopharyngeal_carcinoma.pdf
[23] Fangzheng W, Chuner J, Lei W, et al. Addition of 5-fluorouracial to first-line induction chemotherapy with docetaxel and cisplatin before concurrent chemoradiotherapy does not improve survival in locoregional advanced nasopharyngeal carcinoma[J]. Oncotarget, 2017, 8(53):91150-91161.
[24] Zhang B, Hu Y, Xiong RH, et al. Matched analysis of induction chemotherapy plus chemoradiotherapy versus induction chemotherapy plus radiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a multicenter study[J]. Oncotarget, 2017, 8(8):14078-14088. https://www.researchgate.net/publication/309888537_Matched_analysis_of_induction_chemotherapy_plus_chemoradiotherapy_versus_induction_chemotherapy_plus_radiotherapy_alone_in_locoregionally_advanced_nasopharyngeal_carcinoma_A_multicenter_study
-
期刊类型引用(9)
1. 吕科友,刘肃静,李红伟,马照,姜伟,徐波,宋轶鹏. 尼妥珠单抗联合TP方案诱导化疗并序贯同期放化疗治疗局部晚期鼻咽癌的疗效、不良反应及预后因素. 滨州医学院学报. 2022(01): 9-13+40 .  百度学术
百度学术
2. 王伟锋,袁峰,林志仁. 新辅助化疗后再分期联合放疗治疗局部晚期鼻咽癌的疗效观察. 中华肿瘤防治杂志. 2021(07): 508-512 .  百度学术
百度学术
3. 蒋朝阳,王娟,陈治明,张伶,高辉,张涛,李智慧. 局部T晚期与N晚期鼻咽癌患者的预后比较. 中国肿瘤临床. 2020(15): 780-783 .  本站查看
本站查看
4. 魏照光,王长青,成彦霖,梅宝富. GP方案与PF方案诱导化疗序贯同步放疗治疗局部晚期鼻咽癌的效果比较. 实用临床医学. 2020(06): 8-11 .  百度学术
百度学术
5. 何玉,刘莹,柯晓冰,文珂,陈佩娟. 基于PDCA循环的营养护理在鼻咽癌放疗患者中的应用效果. 中国医药. 2019(10): 1579-1582 .  百度学术
百度学术
6. 计文超,谭笔琴. 氟尿嘧啶联合紫杉醇对脑胶质瘤患者血清TGF-β、GFAP浓度变化的影响. 中国现代医生. 2019(24): 113-116 .  百度学术
百度学术
7. 邵盈. 脂质体紫杉醇联合洛铂对晚期鼻咽癌安全性分析和对免疫功能的研究. 北方药学. 2019(11): 133-135 .  百度学术
百度学术
8. 罗静雯,李平. 诱导化疗在局部晚期鼻咽癌治疗中的应用进展. 遵义医科大学学报. 2019(06): 727-733+738 .  百度学术
百度学术
9. 陈洁,周方正,丑红宇,雷小庆,吴文学,张东升. 调强放疗治疗初治鼻咽癌的近期疗效分析. 湖北医药学院学报. 2018(06): 522-525+530+603 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: