Prognostic value of pretreatment platelet and fibrinogen levels for early non-small cell lung cancer after complete resection
-
摘要:目的 评估血小板及纤维蛋白原对于根治术后非小细胞肺癌的预后价值,并建立预后模型以早期发现术后预后较差的患者。方法 选取2004年3月至2009年1月在天津医科大学肿瘤医院行根治性手术且术后病理确诊的非小细胞肺癌患者405例,血小板及纤维蛋白原水平均为术前测定,并对相关临床病理指标及生存期进行分析。结果 血小板和纤维蛋白原水平升高的发生率分别为16.5%和36.3%。血小板和/或纤维蛋白原升高的患者生存期较短。多因素分析提示病理分期(P<0.05)、复发或转移(P<0.05)及血小板水平(P<0.05)为非小细胞肺癌的独立预后因素。低危组、中危组及高危组患者的中位生存期分别为67、24和20个月,有显著性差异(P<0.05)。结论 术前血小板及血浆纤维蛋白原与非小细胞肺癌患者的预后有密切关系,风险模型的建立或可较早发现高危患者并尽早给予个体化治疗从而改善预后。Abstract:Objective To evaluate the prognostic value of pretreatment platelet and fibrinogen levels for non-small cell lung cancer (NSCLC) after complete resection.Methods Four hundred and five patients with pathological-proven NSCLC who underwent complete resection between March 2004 and January 2007 were included in this study. Blood samples for pretreatment platelet and fibrinogen examinations were collected. Platelet and fibrinogen levels were analyzed with patients' clinical parameters.Results The overall prevalence of thrombocytosis (>350×109/L) was 16.5%, and that of hyperfibrinogenemia (>4 g/L) was 36.3%. Patients with thrombocytosis and/or hyperfibrinogenemia exhibited poor overall survival (P=0.002). Multivariate survival analysis using the Cox proportional hazard model demonstrated that pretreatment platelet levels (P=0.048), tumor stage (P < 0.05), and tumor progression (P < 0.05) were independent prognostic factors of NSCLC. The median survival time among patients with low-, intermediate-, and high-risk NSCLC were 67, 24, and 20 months, respectively (P < 0.05).Conclusions Elevated pretreatment platelet and fibrinogen levels significantly correlate with poor survival in patients with NSCLC. Moreover, the risk model can potentially improve prognosis by enabling the detection of highrisk patients and providing a reference for individualized treatments.
-
Keywords:
- platelets /
- fibrinogen /
- prognosis /
- neoplasm metastasis /
- non-small-cell lung cancer
-
肺癌是世界范围内最常见的肿瘤之一,也是肿瘤相关死亡的最主要原因[1],我国肺癌的发生率及死亡率逐年上升[2]。尽管随着研究的深入,特定基因突变的检测,miRNA以及甲基化DNA的发现能精确地预测肺癌患者的预后,但这些技术价格昂贵且尚未推广,因此有必要发现可靠、简便又经济的指标。近年许多研究发现血小板增多症及高纤维蛋白原血症与多种肿瘤有关,包括肺癌[3]、消化系统肿瘤[4-5]、头颈部肿瘤[6]及妇科肿瘤[7, 8]等,血液高凝状态对肿瘤患者预后具有负面影响。尽管一些研究表明血液高凝状态提示肺癌患者预后较差,但并未将之与总生存期及无进展生存期进行综合分析。
本研究探究术前血小板及纤维蛋白原水平升高与非小细胞肺癌患者各项临床指标之间的关系,并结合相关因素分析其对于患者生存期的影响,期望建立风险模型来筛选出高危患者。
1. 材料与方法
1.1 临床资料
选取2004年3月至2009年1月在天津医科大学肿瘤医院行根治性手术的非小细胞肺癌患者405例,所有患者经细胞学或组织病理学检查,确诊为非小细胞肺癌,并且病历资料完整,所有患者随访至2017年1月为止。本研究经天津医科大学肿瘤医院伦理委员会批准及患者本人知情同意。患者排除标准:1)术前行新辅助放化疗;2)切端阳性患者;3)患有严重心、肝、肾疾病、糖尿病、血栓疾病,或1个月内接受过止血药物、抗凝血及抗纤溶治疗者;4)失访患者。肺癌病理诊断及病理分期基于国际抗癌联盟(UICC)第8版肺癌TNM分期标准。
1.2 方法
血小板及纤维蛋白原水平均是取术前1~7天清晨空腹静脉血后行血常规及凝血功能化验测定。采用XN9000全自动血液分析仪(希森美康,日本)检测血小板水平,采用CA7000全自动血凝分析仪(希森美康,日本)检测纤维蛋白原水平。
1.3 统计学分析
应用SPSS 22.0软件进行统计学分析。类别变量采取χ2检验,各组连续变量采用秩和检验,累计生存率用Kaplan-Meier法计算,单因素分析有统计学意义的变量则采用Cox比例风险回归模型进行分析。P<0.05为差异具有统计学意义。
2. 结果
2.1 血小板/纤维蛋白原水平与非小细胞肺癌各项临床病理因素之间的相关性分析
术前血小板及纤维蛋白原水平用中位数(P25~P75)表示,血小板正常值为(100~300)×109/L,纤维蛋白原正常值为2~4 g/L。所选患者的术前血小板水平范围为(97~601)×109/L[中位数(P25~P75)为236(199~ 282)×109/L],血小板升高的发生率为16.5%(67/405,临界值为300×109/L);纤维蛋白原水平范围为1.423~ 5.872 g/L[中位数(P25~P75)为3.606(3.971~4.466)],纤维蛋白原升高的发生率为36.3%(147/405,临界值为4 g/L)。研究提示,患者术前血小板水平与性别、年龄、病理类型、病理分期及远处转移均无显著相关性,但与肿瘤大体位置及肿瘤大小有相关性(P=0.046),同时血小板升高在Ⅰ期、Ⅱ期及ⅢA期的患者中的发生率分别为11.3%、28.0%、16.1%,有显著性差异(P=0.005),Ⅰ期患者的血小板升高率明显低于Ⅱ期及Ⅲ期的患者;而术前纤维蛋白原水平在男性(P<0.001)、>60岁(P=0.010)、有吸烟史(P<0.001)、中央型肺癌(P=0.022)、肿瘤体积>5 cm(P<0.001)、鳞癌(P<0.001)以及Ⅱ期、ⅢA期患者(P<0.001)中,均有显著升高。由此可得,中晚期非小细胞肺癌的患者中高纤维蛋白原血症及血小板增多较为多见(表 1)。
表 1 非小细胞肺癌患者术前的血小板及纤维蛋白原水平(中位数)
2.2 检测非小细胞肺癌独立预后因素的单因素及多因素分析
术前血小板及纤维蛋白原水平对于预估非小细胞肺癌的预后意义(表 2,3)。单因素分析提示肿瘤大小(P=0.001)、病理分期(P<0.05)、转移或复发(P<0.05)、术前纤维蛋白原(P=0.017)及血小板水平(P<0.05)均与非小细胞肺癌预后有关。术前纤维蛋白原水平正常甚至较低的患者的总生存期比纤维蛋白原水平高的患者的总生存期要长(分别为35、25个月,P=0.017)。术前血小板水平较低的患者的总生存期要明显优于血小板增多的患者(分别为32、22个月,P<0.001)。而性别(P=0.836)、年龄(P=0.800)、吸烟史(P=0.526)、肿瘤位置(P=0.822)及病理类型(P=0.299)不是预后相关因素。多因素分析提示病理分期(P<0.05)、复发或转移(P<0.05)及血小板水平(P<0.05)为非小细胞肺癌的独立预后因素,而纤维蛋白原水平不是非小细胞肺癌的独立预后因素(P= 0.304)。
表 2 非小细胞肺癌预后的单因素分析(Kaplan-Meier法) 表 3 多因素分析Cox比例风险回归模型
表 3 多因素分析Cox比例风险回归模型
2.3 联合血小板及纤维蛋白原水平评估非小细胞肺癌复发或转移以及预后
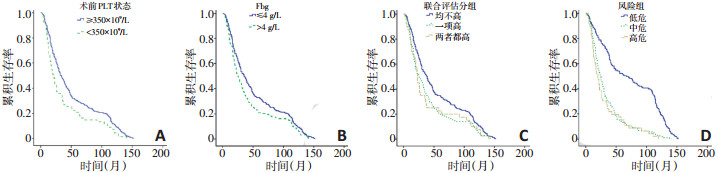
为了能够早发现有复发转移风险及预后较差的患者,将本次研究中的患者分为3组,组Ⅰ为血小板及纤维蛋白原水平正常的患者,组Ⅱ为血小板及纤维蛋白原中有且仅有1项升高的患者,组Ⅲ为两项均高的患者(表 4)。405例患者中,有230例血小板及纤维蛋白原水平均正常的患者,有135例任意1项增高的患者,而两者均增高的患者有35例。各组内有复发或远处转移的患者比例分别为83.5%、86.7%和87.5%,无显著差异(P=0.636)。但组间的中位生存期有明显的不同,分别为30、25、23个月,术前血小板和纤维蛋白原水平均正常的患者预后优于血小板或(和)纤维蛋白原增多的患者(P<0.05,图 1A~B)。
表 4 联合血小板及纤维蛋白原预测复发转移及预后
2.4 根据多因素Cox比例风险回归模型建立风险组
多因素分析提示病理分期、复发或转移及血小板水平是非小细胞肺癌的独立预后因素,病理分期为Ⅱ、ⅢA期、有复发或转移及血小板升高的患者预后较差,因此可以建立如下预后模型,低危组:0~1个危险因素;中危组:2个危险因素;高危组:3个危险因素。低危组、中危组及高危组的中位生存期分别为67(44.0~90.0)、24(20.5~27.5)和20(14.3~25.7)个月,有显著性差异(P<0.05),生存曲线见图 1C~D。
2.5 血小板及纤维蛋白原之间的相关性分析
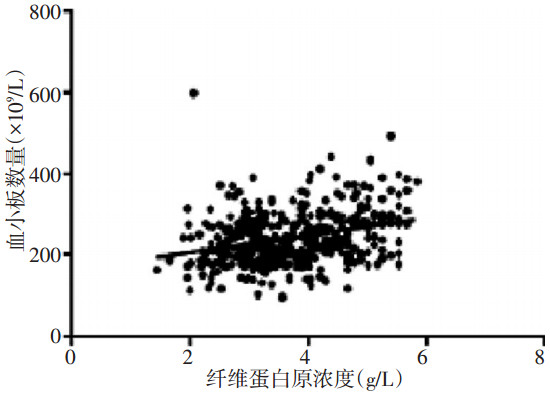
进行数据分析时发现血小板及纤维蛋白原有同时增高的趋势,且血小板及纤维蛋白原同时增高的患者预后较差,因此采用Pearson相关系数分析法分析血小板及纤维蛋白原的相关性提示,两者有微弱的正相关关系(r=0.309,P<0.001,图 2)。
3. 讨论
本次研究支持了血小板增多症及高纤维蛋白原血症对于非小细胞肺癌患者预后具有负向影响的结论。结果表明,在本次纳入回顾性研究的405例患者中,血小板增多症和高纤维蛋白原血症发生率均不低,血小板升高的发生率为16.5%(67/405,临界值为300×109/L),纤维蛋白原升高的发生率为36.3%(147/ 405,临界值为4 g/L),且两者同时升高的患者预后差,生存期明显较短。相似的影响可见于多种恶性肿瘤,如胃癌、结直肠癌、胰腺癌及妇科恶性肿瘤等。
肿瘤细胞与宿主的正常细胞尤其是血小板、血管内皮细胞和白细胞之间有很强的相互作用,通常会导致原本正常的细胞诱发促凝血状态,主要机制为:1)肿瘤细胞促进炎性细胞因子(如TNF-α、IL-1β)、促血管生成因子(如VEGF、bFGF)以及血小板聚集激动剂(如二磷酸腺苷、凝血酶)的释放;2)肿瘤细胞表达可黏附于血细胞和血管壁的表面黏附分子和/或其受体[9]。血小板维持肿瘤内血管的完整性,并可能成为破坏肿瘤血管的有效目标[10]。肿瘤细胞通过直接的“细胞-细胞”黏附和分泌血小板激活分子来激活血小板,被称为肿瘤细胞诱导的血小板聚集(tumor cell induced platelet aggregation,TCIPA)。血小板的激活和聚集与肿瘤细胞的转移潜能有关,并且能保护肿瘤细胞不被循环系统中的免疫系统识别,TICPA形成了肿瘤细胞外的“血小板外衣”来避免自然杀伤细胞对肿瘤细胞的清除[11]。本研究结果表明术前血小板水平与肿瘤大体位置(P=0.046)及肿瘤大小有相关性,同时血小板升高在Ⅱ期及Ⅲ期的患者中发生率高,提示血小板对于肿瘤的发生发展有直接关系,可能与其能维持肿瘤血管完整性从而保证瘤体的血液供应,以及保护肿瘤细胞不被NK细胞识别有关。
纤维蛋白原在诱导肿瘤细胞增殖、迁移、上皮-间质转化、血管生成和血行转移中有关键作用。纤维蛋白原通过直接与TGF-β、VEGF和bFGF结合,纤维蛋白原/纤维蛋白基质形成了一个储存因肿瘤细胞刺激而分泌的生长因子容器,从而调节肿瘤细胞增殖、抑制细胞凋亡、促进血管生成和肿瘤转移[12-13]。纤维蛋白原作为连接血小板上的αⅡbβ3整合蛋白和循环肿瘤细胞(CTC)上的αⅤβ3整合蛋白的桥梁,增强了血小板对肿瘤细胞的黏附[14]。在凝血酶的作用下,纤维蛋白原也会转化成致密的纤维蛋白基质,共同参与“血小板外衣”的形成[11, 15]。Palumbo等[16]实验表明对转基因纤维蛋白原及纤溶酶原缺失的小鼠静脉注入高转移潜能的肺癌细胞及黑色素瘤细胞后,肿瘤转移的能力受到限制。Perisanidis等[6]一项Meta分析提示血浆纤维蛋白原基线水平与转移性或非转移性疾病临床结局较差均有关系,因此血浆纤维蛋白原可能在肿瘤发生的多个阶段均有关键性的作用。本次研究提示术前纤维蛋白原水平在Ⅱ期、ⅢA期患者中有显著升高,但与肺癌的复发或转移之间无明显的关联,与先前一些研究的结论不一致,且单因素分析提示纤维蛋白原对患者预后有负影响,纤维蛋白原升高患者的总生存期明显短于正常的患者,但是多因素分析中仅血小板和病理分期是影响患者预后的独立因素。分别以纤维蛋白原和血小板分析患者总生存期提示,两者中只要有其中一项增高的患者,其术后总生存期明显较差。因此又对纤维蛋白原和血小板水平进行相关性分析,提示两者有微弱的正相关关系(r=0.309,P<0.05)。
目前各种肺癌的肿瘤标志物,包括鳞状上皮细胞癌抗原(SCC)、糖类抗原125(CA125)及神经元特异烯醇化酶(NSE)等,在临床上已有广泛应用,联合多种肿瘤标记物也可以增加肺癌诊断的敏感性,有助于提升非小细胞肺癌的检出率,但是同时也有一些研究表明在早期肺癌中,NSE、CA125和SCC等肿瘤标志物的作用也相对有限[17]。而本研究根据血小板水平和和病理分期将患者分为低危组、中危组及高危组,从而建立风险模型,对于指导临床治疗具有一定意义。涵盖血小板和纤维蛋白原水平的血常规及凝血功能检查是手术前的常规检查,经济便捷,患者依从性好。因此或可将两者整合到现有的肺癌分期标准中,与常规的肿瘤标志物一同来进一步提高预测患者预后的准确性,参与医疗决策的制定。
目前研究已发现肝素可能通过抑制肝素结合生长因子来影响肿瘤的生长[18],与之相似的低分子肝素也可以抑制血管生成、阻断血小板聚集、抑制血小板与内皮细胞的结合,达到抑制肿瘤进展的效果,从而改善患者预后[19]。同时目前已证实部分药物,包括降脂药物,如他汀类、贝特类,可以显著地降低血浆纤维蛋白原水平[20]。
本研究也存在一些不足之处,首先在术后患者的随访中,未跟进监测患者的血小板和纤维蛋白原水平的变化,导致患者出现转移或复发等进展时检测此两项指标的数据并不完善,因此并未作出系统的统计;其次,本研究是单一中心的研究,无法避免患者的选择偏倚。
综上所述,术前血小板和纤维蛋白原水平具有预测非小细胞肺癌患者预后的潜力,常规监测这两项指标,可更为精确地评估患者预后,而术后适当给予抗血小板及降低纤维蛋白原药物,可改善患者生存质量并延长生存期。
-
表 1 非小细胞肺癌患者术前的血小板及纤维蛋白原水平(中位数)

表 2 非小细胞肺癌预后的单因素分析(Kaplan-Meier法)

表 3 多因素分析Cox比例风险回归模型

表 4 联合血小板及纤维蛋白原预测复发转移及预后

-
[1] Siegel RL, Miller KD, Jemal A.Cancer Statistics 2017[J]. CA Cancer J Clin, 2017, 67(1):7-30. DOI: 10.3322/caac.21387
[2] Zheng, R, Zeng, H, Zuo, T, et al. Lung cancer incidence and mortality in China 2011[J]. Thorac Cancer, 2016, 7(1):94-99. DOI: 10.1111/1759-7714.12286
[3] Møller Pedersen, L. Milman N. Prognostic significance of thrombocytosis in patients with primary lung cancer[J]. Eur Respir J, 1996, 9(9): 1826-1830. DOI: 10.1183/09031936.96.09091826
[4] Ikeda M, Furukawa H, Imamura H, et al.Poor prognosis associated with thrombocytosis in patients with gastric cancer[J]. Ann Surg Oncol, 2002, 9(3):287-291. DOI: 10.1007/BF02573067
[5] Hwang SG, Kim KM, Cheong JH, et al. Impact of pretreatment thrombocytosis on blood-borne metastasis and prognosis of gastric cancer[J]. Eur J Surg Oncol, 2012, 38(7):562-567. DOI: 10.1016/j.ejso.2012.04.009
[6] Perisanidis C, Psyrri A, Cohen EE. et al. Prognostic role of pretreatment plasma fibrinogen in patients with solid tumors: A systematic review and meta-analysis[J]. Cancer Treat Rev, 2015, 41(10):960-970. DOI: 10.1016/j.ctrv.2015.10.002
[7] Hernandez E, Donohue KA, Anderson LL, et al. The significance of thrombocytosis in patients with locally advanced cervical carcinoma: a Gynecologic Oncology Group study[J]. Gynecol Oncol, 2000, 78(2):137-142. DOI: 10.1006/gyno.2000.5838
[8] Gucer F, Moser F, Tamussino K, et al. Thrombocytosis as a prognostic factor in endometrial carcinoma[J]. Gynecol Oncol, 1998, 70(2): 210-214. DOI: 10.1006/gyno.1998.5078
[9] Falanga A, Russo L, Milesi V, et al. Mechanisms and risk factors of thrombosis in cancer[J]. Crit Rev Oncol Hematol, 2017, (118):79-83. https://www.sciencedirect.com/science/article/pii/S1040842817303141
[10] Stegner DS, Dutting B. Nieswandt, Mechanistic explanation for platelet contribution to cancer metastasis[J]. Thromb Res, 2014, 133 Suppl 2: S149-157. http://europepmc.org/abstract/med/24862136
[11] Palumbo JS, Talmage KE, Massari JV, et al. Platelets and fibrin (ogen) increase metastatic potential by impeding natural killer cellmediated elimination of tumor cells[J]. Blood, 2005, 105(1):178-185. DOI: 10.1182/blood-2004-06-2272
[12] Martino MM, Briquez PS, Ranga, A, et al. Heparin-binding domain of fibrin(ogen) binds growth factors and promotes tissue repair when incorporated within a synthetic matrix[J]. Proc Natl Acad Sci U S A, 2013, 110(12):4563-4568. DOI: 10.1073/pnas.1221602110
[13] Witsch E, Sela M, Yarden Y. Roles for growth factors in cancer progression[J]. Physiology (Bethesda), 2010, 25(2):85-101. http://europepmc.org/articles/PMC3062054
[14] Desgrosellier JS. Cheresh DA. Integrins in cancer: biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2010, 10(1): p.9-22. DOI: 10.1038/nrc2748
[15] Zheng S, Shen J, Jiao Y, et al, Platelets and fibrinogen facilitate each other in protecting tumor cells from natural killer cytotoxicity[J]. Cancer Sci, 2009, 100(5):859-865. DOI: 10.1111/j.1349-7006.2009.01115.x
[16] Palumbo JS, Kombrinck KW, Drew AF. et al. Fibrinogen is an important determinant of the metastatic potential of circulating tumor cells[J]. Blood, 2000, 96(10):3302-3309. http://europepmc.org/abstract/med/11071621
[17] Ma S, Shen L, Qian N, et al. The prognostic values of CA125, CA19.9, NSE, AND SCC for stage I NSCLC are limited[J]. Cancer Biomark, 2011, 10(3-4):155-162. https://content.iospress.com/articles/cancer-biomarkers/cbm00246
[18] Castelli R, Porro F, Tarsia P. The heparins and cancer: review of clinical trials and biological properties[J]. Vasc Med, 2004, 9(3):205-213. DOI: 10.1191/1358863x04vm566ra
[19] Cosgrove RH, Zacharski LR, Racine E, et al. Improved cancer mortality with low-molecular-weight heparin treatment: a review of the evidence[J]. Semin Thromb Hemost, 2002, 28(1):79-87. DOI: 10.1055/s-2002-20566
[20] Hirschfield G.Effects of fluvastatin and bezafibrate combination on plasma fibrinogen, t-plasminogen activator inhibitor and C reactive protein levels in coronary artery disease patients with mixed hyperlipidaemia (FACT Study)--a rebuttal[J]. Thromb Haemost, 2001, 85 (1):189-190. DOI: 10.1055/s-0037-1612931
-
期刊类型引用(8)
1. 黄健,覃莉,黄东宁. 立体定向放射治疗早期非小细胞肺癌的疗效及预后分析. 当代医学. 2021(11): 143-145 .  百度学术
百度学术
2. 常瑞霞,可春梅. 血小板相关参数和凝血指标在肺癌治疗中的变化及意义. 陕西医学杂志. 2021(05): 610-613 .  百度学术
百度学术
3. 李影,刘苗苗,何严璐琦,张洪珍. 治疗前系统免疫-炎症指数、纤维蛋白原对非小细胞肺癌预后的评估价值. 河北医科大学学报. 2021(05): 514-519 .  百度学术
百度学术
4. 李在峰,宇龙,王培斌. 血浆纤维蛋白原水平及清蛋白/球蛋白比值与直肠癌患者预后的关系. 癌症进展. 2020(03): 271-274 .  百度学术
百度学术
5. 唐国富,綦晓龙,李敏,李厚泽. 大肠癌患者术前纤维蛋白原、血小板与临床病理和预后的相关研究. 中国肿瘤外科杂志. 2020(01): 49-53 .  百度学术
百度学术
6. 陈辰,李利亚. 术前血小板、血浆纤维蛋白原及D-二聚体水平与小细胞肺癌预后的相关性分析. 现代肿瘤医学. 2019(07): 1148-1153 .  百度学术
百度学术
7. 庞宗东,向永红,梁世锋. 肺癌合并血管栓塞患者凝血因子、炎症因子的表达水平及其与吉非替尼疗效相关性研究. 临床和实验医学杂志. 2019(11): 1153-1156 .  百度学术
百度学术
8. 童晶涛,张欢乐,郑璐,许权,杨梓汝,陆妙珍. 血小板和淋巴细胞的比值、中性粒细胞和淋巴细胞的比值与非小细胞肺癌的临床病理学关系及预后效果研究. 中国卫生检验杂志. 2019(24): 3020-3023 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: