Research progress of sterol regulatory element binding transcription factor 1(SREBP1)in cancer
-
摘要: 脂肪酸合成增加是肿瘤细胞的第三大代谢表型,固醇调节元件结合转录因子1(sterol regulatory element binding transcription factor 1,SREBP1)是脂质代谢,尤其是脂肪酸合成相关的重要核转录因子。SREBP1在多种肿瘤中有异常高表达,并在肿瘤细胞的增殖、凋亡、侵袭、耐药性及能量代谢等方面发挥着重要作用。本文就SREBP1的结构、功能,在肿瘤细胞中SREBP1的表达、作用及相关通路进行综述。
-
关键词:
- 固醇调节元件结合转录因子1 /
- 脂肪酸合成 /
- 肿瘤
Abstract: The increase of fatty acid synthesis is the third biggest metabolic phenotype of tumor cells, and sterol regulatory element binding transcription factor 1 (SREBP1) is the major nuclear transcription factor involved in lipid metabolism, especially in the synthesis of fatty acid. The expression of SREBP1 is elevated in multiple tumors, which plays an important role in tumor proliferation, apoptosis, invision, drug resistance, energy metabolism etc. In this paper, we will review the research progress on SREBP1 in tumor.-
Keywords:
- SREBP1 /
- fatty acid synthesis /
- cancer
-
脂肪酸合成增加是肿瘤细胞的第三大代谢表型。通过构成细胞的生物膜,以脂滴的形式储存能量,再经过脂肪酸氧化提供三磷酸腺苷以及参与细胞内信号传递,脂肪酸合成途径的增加对于满足肿瘤细胞快速增殖的物质和能量需要起到重要作用。除此之外,脂肪酸合成增加与肿瘤的发生发展,肿瘤细胞的增殖、凋亡、侵袭、迁移及自噬等都存在相关性。
固醇调节元件结合转录因子(sterol regulatory el- ement binding transcription factor 1,SREBPs)是细胞内调节脂质代谢基因的重要核转录因子,最早在1993年从Hela细胞的核抽提物中纯化得到,对维持细胞内脂质代谢平衡起重要作用[1]。研究表明,SREBP1在多种肿瘤中有异常表达,并在肿瘤细胞的增殖、凋亡、侵袭、耐药性及能量代谢等方面发挥着重要作用[2-3]。SREBP1包括SREBP1a和SREBP1c两种亚型。一般认为SREBP1c是肿瘤细胞内脂肪酸合成的重要转录因子,而SREBP1a则参与调控甘油三酯生成。但目前尚未成功制备出针对SREBP1a和SREBP1c亚型设计的抗体,这可能部分导致了SREBP1的研究在亚型分类上不是很清楚。本文就SREBP1的结构、功能,在肿瘤细胞中SREBP1的表达、作用及相关通路进行综述。
1. SREBP1的结构和功能
SREBP1a和SREBP1c来源于17号染色体上的SREBP-1基因,该基因有19个外显子和18个内含子,在转录过程中由于转录起始位点不同,使得两种亚型mRNA的第一个外显子出现差异[4]。这种差异在蛋白水平上则表现为两者在N端的转录因子结构域出现差异-SREBP1c比SREBP1a的氨基酸序列少(24:42)。此外,在蛋白翻译过程中,由于亚型mRNA在3’端的剪切不同,使得两种亚型在蛋白序列最末端有133个氨基酸不同[4]。SREBP1属于碱性-螺旋-环-螺旋-亮氨酸拉链结构,在内质网合成SREBP1前体(flSREBP1),随后与SREBP裂解激活蛋白SCAP结合形成复合物,镶嵌于内质网膜上[5]。SREBP1前体无功能,当其进入高尔基体,经1位蛋白酶(S1P)和2位蛋白酶(S2P)的剪切后则形成有功能的成熟体(mSREBP)。mSREBP进入细胞核,与固醇调节元件结合参与靶基因的调控[5]。
在功能上,SREBP1a既参与胆固醇合成,又参与脂肪酸合成,而SREBP1c则以调节脂肪酸合成为主[6]。糖酵解产生的柠檬酸进入细胞质后,在三磷酸腺苷柠檬酸裂解酶作用下生成乙酰辅酶A,经过乙酰辅酶A羧化酶作用生成丙二酰辅酶A,最后在脂肪酸合成酶催化下,生成以棕榈酸为主的饱和软脂酸[7]。饱和脂肪酸又经过硬脂酰辅酶A去饱和酶生成不饱和脂肪酸[7]。上述提及的一系列酶均可经由SREBP1c调控[8]。此外有研究表明,SREBP1a也可通过SREBP1c介导间接参与脂肪酸合成,但在肿瘤领域尚未发现[6]。
2. SREBP1在肿瘤中的表达情况
肿瘤细胞最重要的生物学特征是无限制快速增殖,而其浸润、转移的特性则是影响治疗效果和预后的重要因素。研究发现,SREBP1在前列腺癌[9]、肝癌[10]、胰腺癌[11-12]、卵巢癌[13]、子宫内膜癌[14-15]、乳腺癌[16]、人脑胶质细胞瘤[17]、非小细胞肺癌[18]、结直肠癌[19]、黑色素瘤[20]等肿瘤中均有异常高表达,肿瘤细胞增殖、浸润、转移等与SREBP1表达呈正相关。此外,在子宫内膜的不典型增生组织中,SREBP1同样高表达[14]。结合临床资料的分析发现,SREBP1还与胰腺癌[11]、卵巢癌[13]、乳腺癌[16]等患者的预后密切相关,肿瘤患者SREBP1高表达可预测其不良预后。而在前列腺癌中,SREBP1表达还与肿瘤的恶性度分级呈正相关,具有一定的诊断意义[9]。
除此之外,肿瘤中SREBP1的相关通路研究也为SREBP1的深入探索提供了很多支持。
3. SREBP1在肿瘤中的相关调节机制
3.1 细胞内脂肪酸合成对SREBP1的调节
正常组织中,SREBP1可针对细胞内固醇含量做出反馈,调节细胞内的脂质平衡[21]。而在癌细胞中的研究发现,SREBP1可能还受到细胞内脂肪酸含量的调节。有研究分别用药物阻断丙二酰辅酶A在脂肪酸合成过程中的上下游,均可见细胞内的脂肪酸合成减少,但随着药物作用时间的推移,SREBP1和脂肪酸合成酶的含量增加[19]。推测SREBP1主要对细胞内脂肪酸合成的减少进行反馈,而不是脂肪酸合成中间产物的变化。
3.2 PI3K-Akt通路在SREBP1中的研究
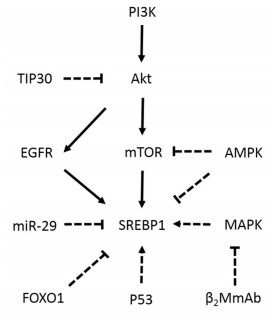
PI3K-Akt-mTORC1是SREBP1研究较多的通路之一。PI3K-Akt在多种肿瘤中激活,参与细胞的生长、存活及代谢等,是肿瘤研究及临床治疗中的重要靶点。PI3K-Akt一方面通过正向调控葡萄糖转运体、己糖激酶等促进肿瘤细胞葡萄糖摄取及糖酵解,增加葡萄糖来源的乙酰辅酶A参与脂肪酸合成[22-23],另一方面通过对SREBP1的调控密切参与肿瘤细胞内脂肪酸的合成。
目前研究表明PI3K-Akt对SREBP1的调控主要在两方面:1)活化的Akt通过Fwb-7(一种泛素酶E3)介导SREBP1的N端降解,稳定核内成熟的SREBP1[24-25]。2)PI3K-Akt活化后激活下游mTORC1,通过Lipin参与SREBP1的核定位以及转录活性[26]。但有研究表明,肿瘤细胞中SREBP1对mTORC1抑制的敏感性不高,这可能与mTORC1抑制可导致上游Akt的活化,反过来又激活SREBP1有关[3]。而这也部分解释了mTORC1靶向抑制剂雷帕霉素在抗癌的临床应用中易出现耐药性,难以取得很好的疗效[27]。而与之相应的是越来越多的研究提出联合抑制mTORC1和mTORC2的必要性,以及相关药物在肿瘤研究中取得的进展[25, 27-28]。SREBP1作为PI3K-Akt活化的结局之一,也可能是靶向mTOR抑制剂出现耐药性的原因之一。
上述研究表明,SREBP1的抑制在抗肿瘤,尤其是对内源性脂肪酸依赖性较强的肿瘤细胞中有着重要意义。
3.3 SREBP1的其他相关通路
3.3.1 EGFR通路
EGFR突变与SREBP1的相关性在恶性脑肿瘤中研究较为深入。对EGFRⅧ突变型的多形性神经母细胞瘤研究发现,SREBP1在癌组织中高表达,通过抑制SREBP依赖性的胆固醇摄取可抑制其细胞增殖和肿瘤形成。而在恶性胶质瘤(glioblastoma multiforme,GBM)细胞系的研究中进一步证实发现,这一过程由PI3K-SREBP1-LDLR途径介导完成[29]。值得注意的是,上述两项研究均强调的是胆固醇合成在肿瘤中的作用,一般认为胆固醇合成由SREBP1a主要参与,但研究中未对SREBP1的亚型进行区分。而同样在GBM方面的另一项研究指出,PI3K-Akt介导了EGFR调控的SREBP1核定位,且这一过程不经过mTORC1的介导[17]。但该研究通过比较GBM细胞系对HMG-CoA还原酶抑制剂阿托伐他汀和FAS抑制剂C75的应答后指出,EGFR-PI3KAkt-SREBP1对GBM细胞系的主要作用是以影响脂肪酸合成为主,而不是胆固醇合成[17]。
在非小细胞肺癌的体内外研究中发现,应用小分子抑制剂或者SREBP1沉默技术抑制SREBP1可以提高肿瘤对EGFR抑制剂索拉非尼的敏感性,可能与降低细胞膜的流动性,从而降低了EGFR的酪氨酸磷酸化有关[18]。
虽然EGFR对SREBP1的调控机制尚不明确,但EGFR通路与SREBP1在肿瘤研究中具有一定的研究价值,靶向联合可能会有更好的抗癌效果。
3.3.2 AMPK通路
活化的AMPK可直接通过SREBP1c的磷酸化抑制细胞内脂肪酸合成,也可通过mTOR介导参与抑制SREBP1。水飞蓟素处理前列腺癌细胞后可激活AMPK磷酸化,增加磷酸化SREBP1水平,抑制SREBP1核转录和脂质累积,添加AMPK抑制剂后可逆转这种抑制作用[30]。而在HepG2中,肿瘤坏死因子-α(TNF-α)则通过抑制AMPK-mTOR通路提高SREBP1水平,增加脂质合成[31]。值得注意的是,AMPK还可通过乙酰辅酶A羧化酶的磷酸化直接阻止脂肪酸合成,也可以通过磷酸化SREBP1间接调控脂肪酸合成相关酶的表达[32]。
此外,肿瘤细胞内参与SREBP1调节的还有MAPK通路、基因突变、miRNA表达等。研究发现,β2微球蛋白单克隆抗体(β2M mAb)通过使MAPK失活,下调SREBP1,从而降低肿瘤细胞的雄激素受体(androgen receptor,AR)活性和脂肪酸生成[33]。而p53基因突变可通过SREBP1调节脂质生成,参与乳腺癌发生和乳腺组织的重建;对合并p53突变的AR阴性/去势抵抗性前列腺癌使用SREBP抑制剂或者联合多西他赛有可能取得更好的治疗效果[34]。在肝癌的研究中发现,抑癌基因TIP30通过负性调控Akt/mTOR通路,可以下调SREBP1表达,通过抑制TIP30表达可以促进肝癌细胞的增殖[35]。另一项在子宫内膜癌的体外研究中发现,叉状头转录因子1(fork head transcription factor 1,FOXO1)过表达可以抑制肿瘤生长,同时细胞内SREBP1表达明显降低,但具体机制尚不明确[36]。而在GBM的研究中发现,SREBP1可以促进miRNA-29家族成员miRNA-29a、miRNA-29b和miRNA-29c的表达,而miRNA-29反过来可以抑制SREBP1的表达[37]。
SREBP1的相关通路研究(图 1)目前尚有较多不明确的地方,但这同时也对SREBP1在未来的研究中提供了更多的可能性,值得进一步深入研究。
4. SREBP1与低氧
实体肿瘤内部通常存在氧和营养物质供应不足的情况,而SREBP1有望成为这方面的新的研究热点。在恶性胶质瘤的研究中发现,低氧可以诱导SREBP1的表达,提高细胞内脂肪酸合成,而抑制SREBP1可以使低氧环境中的肿瘤细胞脂肪酸合成减少,细胞死亡增加[38]。在乳腺癌的研究中,发现低氧通过Akt和HIF激活,诱导SREBP1的表达,而低氧诱导的肿瘤耐药性则与SREBP1调控的脂肪酸合成酶上调有一定关系[39]。
5. 结语
随着SREBP1相关研究的深入展开,SREBP1在肿瘤方面的重要性也越来越受到重视,但同时SREBP1的未知面也逐渐增多。未来有关SREBP1在更多肿瘤中的表达情况、功能及其具体的调节机制和调控细节等,需要更进一步的研究探讨。临床方面则期待SREBP1能够协助进行肿瘤的诊断及预后,希望SREBP1靶向药物单用或者联合其他药物能够最终在临床肿瘤治疗中发挥作用。
-
[1] Briggs MR, Yokoyama C, Wang X, et al. Nuclear protein that binds sterol regulatory element of low density lipoprotein receptor promoter. I. Identification of the protein and delineation of its target nucleotide sequence[J]. J Biol Chem, 1993, 268(19):14490-14496. http://cn.bing.com/academic/profile?id=96227d695c44bfad1d1e69ce3b0315cc&encoded=0&v=paper_preview&mkt=zh-cn
[2] Xiao X, Song BL. SREBP: a novel therapeutic target[J]. Acta Biochim Biophys Sin (Shanghai), 2013, 45(1):2-10. DOI: 10.1093/abbs/gms112
[3] Griffiths B, Lewis CA, Bensaad K, et al. Sterol regulatory element binding protein- dependent regulation of lipid synthesis supports cell survival and tumor growth[J]. Cancer Metab, 2013, 1(1):3. DOI: 10.1186/2049-3002-1-3
[4] Horton JD, Shimomura I, Brown MS, et al. Activation of cholesterol synthesis in preference to fatty acid synthesis in liver and adipose tissue of transgenic mice overproducing sterol regulatory elementbinding protein-2[J]. J Clin Invest, 1998, 101(11):2331-2339. DOI: 10.1172/JCI2961
[5] Yokoyama C, Wang X, Briggs MR, et al. SREBP-1, a basic-helix-loophelix- leucine zipper protein that controls transcription of the low density lipoprotein receptor gene[J]. Cell, 1993, 75(1):187-197. DOI: 10.1016/S0092-8674(05)80095-9
[6] Bitter A, Nussler AK, Thasler WE, et al. Human sterol regulatory element-binding protein 1a contributes significantly to hepatic lipogenic gene expression[J]. Cell Physiol Biochem, 2015, 35(2):803-815. DOI: 10.1159/000369739
[7] Currie E, Schulze A, Zechner R, et al. Cellular fatty acid metabolism and cancer[J]. Cell Metab, 2013, 18(2):153-161. DOI: 10.1016/j.cmet.2013.05.017
[8] Shimano H. Sterol regulatory element- binding proteins (SREBPs): transcriptional regulators of lipid synthetic genes[J]. Prog Lipid Res, 2001, 40(6):439-452. DOI: 10.1016/S0163-7827(01)00010-8
[9] Huang WC, Li X, Liu J, et al. Activation of androgen receptor, lipogenesis, and oxidative stress converged by SREBP-1 is responsible for regulating growth and progression of prostate cancer cells[J]. Mol Cancer Res, 2012, 10(1):133-142. DOI: 10.1158/1541-7786.MCR-11-0206
[10] Li C, Yang W, Zhang J, et al. SREBP-1 has a prognostic role and contributes to invasion and metastasis in human hepatocellular carcinoma[J]. Int J Mol Sci, 2014, 15(5):7124-7138. DOI: 10.3390/ijms15057124
[11] Sun Y, He W, Luo M, et al. SREBP1 regulates tumorigenesis and prognosis of pancreatic cancer through targeting lipid metabolism[J]. Tumour Biol, 2015, 36(6):4133-4141. DOI: 10.1007/s13277-015-3047-5
[12] Siqingaowa, Sekar S, Gopalakrishnan V, et al. Sterol regulatory element- binding protein 1 inhibitors decrease pancreatic cancer cell viability and proliferation[J]. Biochem Biophys Res Commun, 2017, 488(1):136-140. DOI: 10.1016/j.bbrc.2017.05.023
[13] Nie LY, Lu QT, Li WH, et al. Sterol regulatory element-binding protein 1 is required for ovarian tumor growth[J]. Oncol Rep, 2013, 30 (3):1346-1354. DOI: 10.3892/or.2013.2575
[14] Li W, Tai Y, Zhou J, et al. Repression of endometrial tumor growth by targeting SREBP1 and lipogenesis[J]. Cell Cycle, 2012, 11(12):2348-2358. DOI: 10.4161/cc.20811
[15] Shafiee MN, Mongan N, Seedhouse C, et al. Sterol regulatory element binding protein- 1 (SREBP1) gene expression is similarly increased in polycystic ovary syndrome and endometrial cancer[J]. Acta Obstet Gynecol Scand, 2017, 96(5):556-562. DOI: 10.1111/aogs.2017.96.issue-5
[16] Bao J, Zhu L, Zhu Q, et al. SREBP-1 is an independent prognostic marker and promotes invasion and migration in breast cancer[J]. Oncol Lett, 2016, 12(4):2409-2416. DOI: 10.3892/ol.2016.4988
[17] Guo D, Prins RM, Dang J, et al. EGFR signaling through an AktSREBP- 1- dependent, rapamycin-resistant pathway sensitizes glioblastomas to antilipogenic therapy[J]. Sci Signal, 2009, 2(101):ra82. http://stke.sciencemag.org/content/2/101/ra82.full
[18] Li J, Yan H, Zhao L, et al. Inhibition of SREBP increases gefitinib sensitivity in non-small cell lung cancer cells[J]. Oncotarget, 2016, 7(32):52392-52403. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5239560
[19] Li J N, Mahmoud MA, Han WF, et al. Sterol regulatory element-binding protein- 1 participates in the regulation of fatty acid synthase expression in colorectal neoplasia[J]. Exp Cell Res, 2000, 261(1):159-165. DOI: 10.1006/excr.2000.5054
[20] Giampietri C, Petrungaro S, Cordella M, et al. Lipid storage and autophagy in melanoma cancer cells[J]. Int J Mol Sci, 2017, 18(6):e1271. DOI: 10.3390/ijms18061271
[21] Horton JD, Goldstein JL, Brown MS. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver[J].J Clin Invest, 2002, 109(9):1125-1131. DOI: 10.1172/JCI0215593
[22] Cong LN, Chen H, Li Y, et al. Physiological role of Akt in insulin-stimulated translocation of GLUT4 in transfected rat adipose cells[J]. MolEndocrinol, 1997, 11(13):1881-1890. https://academic.oup.com/mend/article/11/13/1881/2754066
[23] Katome T, Obata T, Matsushima R, et al. Use of RNA interference mediated gene silencing and adenoviral overexpression to elucidate the roles of AKT/protein kinase B isoforms in insulin actions[J]. J Biol Chem, 2003, 278(30):28312-28323. DOI: 10.1074/jbc.M302094200
[24] Bengoechea- Alonso MT, Ericsson J. The phosphorylation- dependent regulation of nuclear SREBP1 during mitosis links lipid metabolism and cell growth[J]. Cell Cycle, 2016, 15(20):2753-2765. DOI: 10.1080/15384101.2016.1220456
[25] Li S, Oh YT, Yue P, et al. Inhibition of mTOR complex 2 induces GSK3/FBXW7-dependent degradation of sterol regulatory element-binding protein 1 (SREBP1) and suppresses lipogenesis in cancer cells[J]. Oncogene, 2016, 35(5):642-650. DOI: 10.1038/onc.2015.123
[26] Peterson TR, Sengupta SS, Harris TE, et al. mTOR complex 1 regulateslipin 1 localization to control the SREBP pathway[J]. Cell, 2011, 146(3):408-420. DOI: 10.1016/j.cell.2011.06.034
[27] Li J, Kim SG, Blenis J. Rapamycin: one drug, many effects[J]. Cell Metab, 2014, 19(3):373-379. DOI: 10.1016/j.cmet.2014.01.001
[28] Ahmed M, Hussain AR, Bavi P, et al. High prevalence of mTOR complex activity can be targeted using Torin2 in papillary thyroid carcinoma[J]. Carcinogenesis, 2014, 35(7):1564-1572. DOI: 10.1093/carcin/bgu051
[29] Guo D, Reinitz F, Youssef M, et al. An LXR agonist promotes glioblastoma cell death through inhibition of an EGFR/AKT/SREBP-1/LDLRdependent pathway[J]. Cancer Discov, 2011, 1(5):442-456. DOI: 10.1158/2159-8290.CD-11-0102
[30] Nambiar DK, Deep G, Singh RP, et al. Silibinin inhibits aberrant lipid metabolism, proliferation and emergence of androgen- independence in prostate cancer cells via primarily targeting the sterol response element binding protein 1[J]. Oncotarget, 2014, 5(20):10017-10033. https://www.researchgate.net/profile/Dhanya_Nambiar2/publication/265787489_Silibinin_inhibits_aberrant_lipid_metabolism_proliferation_and_emergence_of_androgen-independence_in_prostate_cancer_cells_via_primarily_targeting_the_sterol_response_element_binding_protein_1/links/551a125b0cf2f51a6fea2a80/Silibinin-inhibits-aberrant-lipid-metabolism-proliferation-and-emergence-of-androgen-independence-in-prostate-cancer-cells-via-primarily-targeting-the-sterol-response-element-binding-protein-1.pdf
[31] Lv Q, Zhen Q, Liu L, et al. AMP-kinase pathway is involved in tumor necrosis factor alpha-induced lipid accumulation in human hepatoma cells[J]. Life Sci, 2015, 131:23-29. DOI: 10.1016/j.lfs.2015.03.003
[32] Li Y, Xu S, Mihaylova MM, et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metab, 2011, 13(4):376-388. DOI: 10.1016/j.cmet.2011.03.009
[33] Huang WC, Zhau HE, Chung LW. Androgen receptor survival signaling is blocked by anti-beta2-microglobulin monoclonal antibody via a MAPK/lipogenic pathway in human prostate cancer cells[J]. J BiolChem, 2010, 285(11):7947-7956. http://www.jbc.org/content/285/11/7947.full
[34] Li X, Wu JB, Chung LW, et al. Anti-cancer efficacy of SREBP inhibitor, alone or in combination with docetaxel, in prostate cancer harboring p53 mutations[J]. Oncotarget, 2015, 6(38):41018-41032. https://www.researchgate.net/publication/283323562_Anti-cancer_efficacy_of_SREBP_inhibitor_alone_or_in_combination_with_docetaxel_in_prostate_cancer_harboring_p53_mutations/fulltext/56aff76f08ae9f0ff7b296cb/283323562_Anti-cancer_efficacy_of_SREBP_inhibitor_alone_or_in_combination_with_docetaxel_in_prostate_cancer_harboring_p53_mutations.pdf
[35] Yin F, Sharen G, Yuan F, et al. TIP30 regulates lipid metabolism in hepatocellular carcinoma by regulating SREBP1 through the Akt/mTOR signaling pathway[J]. Oncogenesis, 2017, 6(6):e347. DOI: 10.1038/oncsis.2017.49
[36] Zhang Y, Zhang L, Sun H, et al. Forkhead transcription factor 1 inhibits endometrial cancer cell proliferation via sterol regulatory element-binding protein 1[J]. Oncol Lett, 2017, 13(2):731-737. DOI: 10.3892/ol.2016.5480
[37] Ru P, Guo D. microRNA-29 mediates a novel negative feedback loop to regulate SCAP/SREBP-1 and lipid metabolism[J]. RNA Dis, 2017, 4(1):e1525. http://www.smartscitech.com/index.php/RD/gateway/plugin/WebFeedGatewayPlugin/rss
[38] Lewis CA, Brault C, Peck B, et al. SREBP maintains lipid biosynthesis and viability of cancer cells under lipid- and oxygen-deprived conditions and defines a gene signature associated with poor survival in glioblastoma multiforme[J]. Oncogene, 2015, 34(40):5128-5140. DOI: 10.1038/onc.2014.439
[39] Furuta E, Pai SK, Zhan R, et al. Fatty acid synthase gene is up-regulated by hypoxia via activation of Akt and sterol regulatory element binding protein-1[J]. Cancer Res, 2008, 68(4):1003-1011. DOI: 10.1158/0008-5472.CAN-07-2489
-
期刊类型引用(2)
1. 高文广,李龙辉,王建华. SREBP2、LOXL2和PEBP4在原发性肝癌中的表达及与患者临床病理特征的相关性. 国际消化病杂志. 2024(04): 251-257 .  百度学术
百度学术
2. 吴鹏,刘强. 血清SREBP1、AMACR水平对根治性前列腺切除术后患者预后不良的预测效能. 转化医学杂志. 2024(08): 1194-1198 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载:
