Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy in patients with pseudomyxoma peritonei: Analysis of 182 patients at a single center
-
摘要:目的 腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是一种主要来源于阑尾黏液性肿瘤的恶性肿瘤综合征,肿瘤细胞减灭术(cytoreductive surgery,CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)是国际推荐的PMP标准治疗。本研究旨在评估CRS+HIPEC治疗PMP的疗效及围手术期安全性。方法 研究首都医科大学附属北京世纪坛医院2001年1月至2008年5月采用CRS+HIPEC治疗182例PMP临床数据库,进行生存分析,通过单因素和多因素分析筛选独立预后因素,并分析围手术期安全性。结果 182例PMP患者接受CRS+HIPEC治疗,低级别PMP 73例(40.1%),部分低级别、部分高级别PMP 50例(27.5%),高级别PMP 53例(29.1%),PMP伴印戒细胞6例(3.3%);中位腹膜癌指数(peritoneal cancer index,PCI)30分,PCI≥20分为134例(74.0%);肿瘤细胞减灭程度(completeness of cytoreduction,CC)评分0~1分者为79例(44.1%);死亡48例(26.4%),生存134例(73.6%),中位生存时间64.7个月(95%CI:43.1~84.3个月)。Cox多因素回归分析发现4个独立预后因素:年龄(HR=12.079,95%CI:1.605~90.916)、CC(HR=0.211,95%CI:0.069~0.641)、是否有吻合口(0个vs. >1个)(HR=5.519,95%CI:1.176~25.907)、吻合口数量(1个vs. >1个)(HR=7.543,95%CI:1.592~35.732)。围手术期死亡率、严重不良事件率分别为1.6%、19.8%。结论 PMP患者在腹膜肿瘤专科单位接受CRS+HIPEC治疗,达到完全肿瘤细胞减灭,可延长生存,围手术期安全性可接受。Abstract:Objective Pseudomyxoma peritonei (PMP) is a clinically malignant tumor syndrome derived from mucin-producing appendiceal tumors, and cytoreductive surgery (CRS) plus hyperthermic intraperitoneal chemotherapy (HIPEC) is a standard treatment for PMP recommended by the Peritoneal Surface Malignancy Group International (PSOGI). This retrospective study analyzed the efficacy and safety of CRS+HIPEC for PMP at our center.Methods This was a retrospective study on the PMP database established at our center. The clinicopathological features, treatment details, and follow-up information on PMP patients were systematically established in this database. Survival analysis was conducted to evaluate the efficacy of treatment; univariate and multivariate analyses were performed to identify the independent prognostic factors. Perioperative adverse events were assessed to evaluate the safety of CRS + HIPEC.Results Among the 182 PMP patients that received CRS+HIPEC, 73 (40.1%) had low-grade PMP, 50 (27.5%) had low-and-high mixed-grade PMP, 53 (29.1%) had high-grade PMP, and 6 (3.3%) had PMP with signet ring cells. The median peritoneal cancer index (PCI) was 30, and 74.0% of the patients had a PCI ≥20. There were 79 patients (44.1%) who had a completeness of cytoreduction (CC) score of 0-1. Of 182 patients, 48 (26.4%) died and 134 (73.6%) were alive, with the median overall survival (OS) from surgery being 64.7 months (95% CI: 43.1-84.3 months). Multivariate analysis and Cox proportional regression model analysis identified 4 independent prognostic factors: age (HR=12.079, 95% CI: 1.605-90.916), CC score (HR=0.211, 95% CI: 0.069-0.641), presence of anastomosis (0 vs. >1) (HR=5.519, 95% CI: 1.176-25.907), and number of anastomoses (1 vs. >1) (HR=7.543, 95% CI: 1.592-35.732). The perioperative mortality rate and serious adverse events rate was 1.6% and 19.8%, respectively.Conclusions PMP patients treated with CRS+HIPEC to achieve complete cytoreduction at experienced centers may experience survival benefits with acceptable safety.
-
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)由Karl F. Rokitansky于1842年最先报道,发病率约百万分之二[1],主要特征为黏液肿瘤腹腔内播散和大量黏液性腹水进行性积聚,导致腹胀、胃肠道梗阻、腹腔脏器黏连。国内针对PMP的大样本研究较少,仅有小样本病例报道[2-3]。国际上,腹膜表面肿瘤国际联盟(peritoneal surface oncology group international,PSOGI)定义PMP为恶性肿瘤综合征,病理学分为4类:无细胞性黏液、腹膜低级别黏液癌或腹膜弥漫性黏液腺瘤病(disseminated peritoneal adenomucinosis,DPAM)、腹膜高级别黏液癌或腹膜黏液腺癌病(peritoneal mucinous carcinomatosis,PMCA)、腹膜高级别黏液癌伴印戒细胞或腹膜黏液腺癌病伴印戒细胞(peritoneal mucinous carcinomatosis with signet ring cells,PMCA-S)[4]。肿瘤细胞减灭术(cytoreductive surgery,CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)是PMP的首选治疗方案[5]。
首都医科大学附属北京世纪坛医院是国内集中诊治腹膜癌的临床专科之一,采用CRS+HIPEC治疗PMP在内的各类腹膜癌近千例,建立了临床病理资料数据库[6]。本研究分析CRS+HIPEC治疗PMP的临床资料,评估疗效和安全性。
1. 材料与方法
1.1 临床资料
从数据库中筛选2004年1月至2018年5月首都医科大学附属北京世纪坛医院接受CRS+HIPEC治疗的PMP患者182例,资料包括临床病理特征、治疗数据、随访信息等。患者符合下述纳入和排除标准[6]。研究方案获得本院伦理委员会批准,所有患者均签署知情同意书。
纳入标准:1)经病理组织学和(或)细胞学证实为PMP;2)卡氏评分(Karnofsky performance status score,KPS)>60分;3)外周血白细胞≥3.5×109/L、血小板≥80×109/ L;4)适宜肝功能:总胆红素、AST、ALT < 2×ULN(upper limit of normal);5)适宜肾功能:血肌酐值< 1.2×ULN;6)其他主要脏器功能可耐受长时间大手术。
排除标准:1)术前常规检查发现肺、脑、骨、肝等多处转移;2)总胆红素、AST、ALT≥2×ULN;3)血肌酐值≥1.2×ULN;4)影像学诊断明显肠系膜挛缩;5)机体状态、重要脏器功能难以耐受大手术。
1.2 方法
1.2.1 术前评估
依据细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识[7]评估患者,主要包括:1)肿瘤标志物:联合检测CEA、CA125、CA199,判断肿瘤侵袭程度、腹水形成及腹膜肿瘤负荷、癌细胞增生活性;2)影像学:静态影像学采用胸腹盆腔CT增强扫描+三维重建,肿瘤分布;动态影像学包括胃肠道造影,小肠运动及肠系膜受累情况;3)细胞学:对部分无病理诊断者,行腹水或腹腔冲洗液脱落细胞学病理检查。
1.2.2 CRS+HIPEC主要过程
CRS+HIPEC由腹膜癌治疗专科团队实施。开腹探查后,评估腹膜癌指数(peritoneal cancer index,PCI)[8],然后行最大程度CRS手术,包括切除原发肿瘤、受侵组织器官、清扫淋巴结和剥除受侵腹膜。术毕评估细胞减灭程度(completeness of cytoreduction,CC)[9]。
CRS完成后行开放式HIPEC,每种药物加入3 L生理盐水中,加热至(43.0±0.5)℃,以400 mL/min的流速持续循环灌注60 min。HIPEC方案包括:顺铂120 mg+多西他赛120 mg、顺铂120 mg+丝裂霉素C 30 mg。HIPEC完成后,消化道、泌尿系等重建,术野止血后关腹,返回病房,监护治疗。
1.2.3 辅助治疗
患者手术恢复出院后,完成6~8个周期全身联合腹腔化疗:1)全身化疗采取FOLFOX或FOLFIRI方案;2)腹腔化疗采取顺铂+多西他赛方案;3)91例(50.0%)患者术前2周口服标准桃金娘油600 mg,2次/日,以降低肿瘤硬度,提高手术安全性及细胞减灭程度。
1.2.4 随访
随访记录主要包括一般状况和生存状态,末次统一电话随访日期为2018年5月20日,随访率为100%。
1.2.5 研究指标
1)临床病理特征:性别、年龄、BMI、既往治疗史、KPS评分和术前肿瘤标志物;2)CRS+HIPEC相关参数:手术时间、器官(部分)切除数量、腹膜(区域)切除数量、吻合口数量、HIPEC方案、PCI评分、CC评分、血制品输注量、液体出入量、腹水量;3)生存数据:生存状态、总生存期等。
1.2.6 相关定义
不良事件:依照美国国立癌症研究所通用术语标准(national cancer institute common terminology criteria,NCI-CTC),3~5级为严重不良事件(serious adverse event,SAE)。
总生存期(overall survival,OS):CRS+HIPEC手术当日至PMP相关死亡或随访截止时间。
围手术期:CRS+HIPEC手术当日至术后30 d。
1.3 统计学分析
数据分析采用Microsoft Excel 2016、SPSS 21.0统计学软件。计量资料采用t检验或秩和检验;计数资料采用χ2检验、Fisher确切概率法;生存分析采用Kaplan-Meier生存函数、Log-rank检验;采用单因素和多因素分析影响生存的独立预后因素。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 主要临床病理特征
接受CRS+HIPEC治疗PMP患者182例,其中男性93例(51.1%),女性89例(48.9%),中位年龄54(24~81)岁。低级别PMP 73例(40.1%),部分低级别、部分高级别PMP 50例(27.5%),高级别PMP 53例(29.1%),PMP伴印戒细胞6例(3.3%),见表 1。
表 1 182例PMP患者主要临床病理特征
2.2 CRS+HIPEC相关参数
中位手术时间10.5(1.6~18.0)h,中位PCI 30(1~39)分,PCI≥20分134例(74.0%);CC 0~1分为79例(44.1%)。无胃肠道吻合口为35.0%,1处为38.4%,1处以上为26.6%。HIPEC方案:顺铂120 mg+丝裂霉素C 30 mg为28.2%,顺铂120 mg+多西他赛120 mg为71.8%。术中大量输注红细胞(≥5 U)为26.9%,见表 2。
表 2 182例PMP患者CRS+HIPEC相关参数
2.3 生存曲线分析
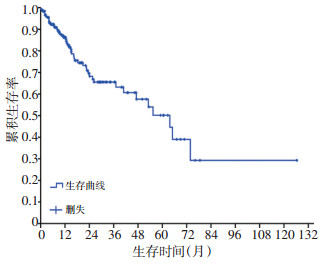
中位随访时间19.5个月(95%CI:13.3~25.7个月),48例(26.4%)死亡,134例(73.6%)生存,中位OS为64.7个月(95%CI:43.1~84.3个月)。1、2、3、5年生存率分别为:86.3%、68.2%、65.5%和50.2%(图 1)。
2.4 生存单因素分析
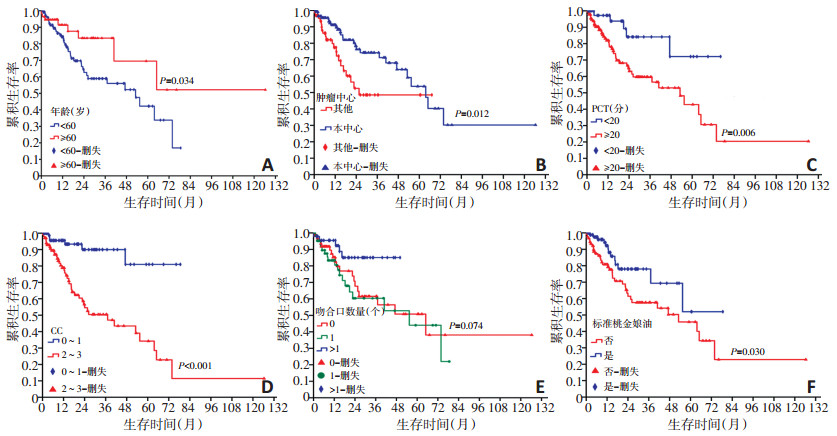
生存单因素分析显示下列影响预后因素:年龄(P=0.034,图 2A)、性别(P=0.030)、BMI(P=0.032)、第一次手术治疗肿瘤中心(P=0.012,图 2B)、病理组织学类型(P=0.023)、SAE(P=0.029)、PCI(P=0.006)(图 2C)、CC(P < 0.001)(图 2D)、红细胞输注量(P=0.049)、吻合口数量(P=0.074)(图 2E)、术前口服标准桃金娘油(P=0.030)(图 2F,表 3)。
表 3 182例PMP患者生存的单因素分析
2.5 生存多因素分析
将生存单因素分析中P < 0.10的因素纳入Cox回归模型进行多因素分析,显示:年龄、CC、有无胃肠道吻合口、吻合口数量为独立预后因素(表 4)。CC为2~3患者的死亡风险是CC为0~1分者的4.739倍(P=0.006,95%CI:0.069~0.641)。
表 4 182例PMP患者生存的多因素分析
2.6 不良事件
围手术期SAE 36例(19.8%):死亡(5级)3例(1.6%);余33例(17.3%)包括:1)消化道系统(3级)15例(8.3%):吻合口瘘、肠瘘、肠梗阻、化脓性梗阻性胆管炎;2)呼吸系统(3级)6例(3.3%):胸腔积液、气胸;3)循环系统(3~4级)8例(4.4%):循环不稳定、心肌梗死、Ⅲ度房室传导阻滞;4)血液系统(3级)1例(0.5%):Ⅲ度骨髓抑制;5)泌尿系统(4级)3例(1.6%):急性肾功能不全、尿崩症;6)感染(3级)16例(8.8%):腹腔感染、切口裂开感染、中心静脉置管相关感染;7)出血(3级)6例(3.3%);8)深静脉血栓栓塞(3级)为2例(1.1%)。
3. 讨论
本研究中,PMP患者经规范性CRS+HIPEC治疗后,临床获益明显:从手术开始计算的中位生存时间超过64.7个月,围手术期死亡率1.6%,严重不良事件率为19.8%。年龄、肿瘤细胞减灭程度、是否有吻合口和吻合口数量是与生存相关的4个独立预后因素。本研究单因素分析显示,年龄、性别、BMI、第一次手术治疗肿瘤中心、病理组织类型、严重不良事件、PCI、CC、红细胞输注量、吻合口数量、口服标准桃金娘油等对患者预后有显著影响,与国外相关报道相似。Chua等[10]进行2 298例的多中心临床研究提示年龄≥53岁、SAE、CC 2~3、高级别PMP是预后不良的独立危险因素。Ansari等[11]1 000例的单中心研究显示男性、高级别PMP、CEA增高、CA125增高是预后不良的独立危险因素。Kusamura等[12]研究CRS+ HIPEC治疗PMP学习曲线,提出肿瘤外科医生需在专业化肿瘤中心进行96例手术,才能达到技术稳定,故PMP患者在腹膜肿瘤专科中心接受规范性CRS+ HIPEC治疗,是保证疗效、延长生存的关键。Saxena等[13]研究发现,大量异体输血(≥5 U)与SAE呈正相关、与OS呈负相关。本研究发现,吻合口数量>1个比0、1个者预后较好,考虑可能与完全CRS率(CC 0~1)有关:吻合口数量≤1个、>1个者分别为41.5%、53.2%,即吻合口数量≤1个者可切除性较差,仅行减瘤手术。术前口服标准桃金娘油对PMP患者生存预后有显著影响,可能与标准桃金娘油的黏液溶解作用[14]、增加手术可切除性有关。
CRS+HIPEC体现了以手术为主整合治疗的整体优势[7],技术要求较高:1)术前评估肿瘤可切除性,详细制订CRS方案;2)为达到完全肿瘤细胞减灭(CC 0~1),CRS需多学科协作,多部位、多脏器、多区域腹膜联合切除,多处淋巴结清扫,术后腹盆腔脏器复杂重建;3)HIPEC时要精准控制温度(≤±0.5℃)、流量(≤±5%)及灌注时间;4)手术时间长,血液动力学管理及麻醉管理要求高;5)围手术期多脏器功能维护要求高,应预防重要并发症如VTE[15]、胃肠道瘘[16]、心衰、高肌红蛋白血症[17]、凝血功能异常等。
本研究的不足在于单中心回顾性研究,样本量有限,循证医学证据质量不高,亟需多中心研究等高级别循证医学验证。
综上所述,本研究是国内较早采用规范性CRS+ HIPEC治疗PMP的大样本报道,提示PMP患者在腹膜肿瘤专科单位接受CRS+HIPEC治疗,达到完全肿瘤细胞减灭,可延长生存,围手术期安全性可接受,建议推广该技术体系。
-
表 1 182例PMP患者主要临床病理特征

表 2 182例PMP患者CRS+HIPEC相关参数

表 3 182例PMP患者生存的单因素分析

表 4 182例PMP患者生存的多因素分析

-
[1] Smeenk RM, van Velthuysen ML, Verwaal VJ, et al. Appendiceal neoplasms and pseudomyxoma peritonei: a population based study [J]. Eur J Surg Oncol, 2008, 34(2):196-201. DOI: 10.1016/j.ejso.2007.04.002
[2] 胡双明.腹膜假性黏液瘤5例的临床报道[J].临床医药文献杂志, 2016, 3(2):371-372. http://d.old.wanfangdata.com.cn/Periodical/lcyydzzz201602130 [3] 马越, 涂水平.原发性阑尾黏液性肿瘤的临床特点和生存分析[J].胃肠病学, 2016, 21(11):662-667. DOI: 10.3969/j.issn.1008-7125.2016.11.005 [4] Carr NJ, Cecil TD, Mohamed F, et al. A consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia: the results of the Peritoneal Surface Oncology Group International (PSOGI) modified Delphi process[J]. Am J Surg Pathol, 2016, 40(1):14-26. DOI: 10.1097/PAS.0000000000000535
[5] Li Y, Zhou YF, Liang H, et al. Chinese expert consensus on cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal malignancies[J]. World J Gastroenterol, 2016, 22(30):6906-6916. DOI: 10.3748/wjg.v22.i30.6906
[6] Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase Ⅲ randomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6):1575-1581. DOI: 10.1245/s10434-011-1631-5
[7] 李雁, 周云峰, 梁寒, 等.细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识[J].中国肿瘤临床, 2015, 42(4):198-206. DOI: 10.3969/j.issn.1000-8179.20150013 [8] Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis[J]. Cancer Treat Res, 1996, 82:359-374. DOI: 10.1007/978-1-4613-1247-5
[9] Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome[J]. Eur J Surg Oncol, 2001, 27(3):239-243. DOI: 10.1053/ejso.2000.1038
[10] Chua TC, Moran BJ, Sugarbaker PH, et al. Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. J Clin Oncol, 2012, 30(20):2449-2456. DOI: 10.1200/JCO.2011.39.7166
[11] Ansari N, Chandrakumaran K, Dayal S, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1000 patients with perforated appendiceal epithelial tumours[J]. Eur J Surg Oncol, 2016, 42(7):1035-1041. DOI: 10.1016/j.ejso.2016.03.017
[12] Kusamura S, Moran BJ, Sugarbaker PH, et al. Multicentre study of the learning curve and surgical performance of cytoreductive surgery with intraperitoneal chemotherapy for pseudomyxoma peritonei[J]. Br J Surg, 2014, 101(13):1758-1765. DOI: 10.1002/bjs.2014.101.issue-13
[13] Saxena A, Valle SJ, Liauw W, et al. Allogenic blood transfusion is an independent predictor of poorer peri-operative outcomes and reduced long- term survival after cytoreductive surgery and hyperthermic intraperitoneal chemotherapy: a review of 936 cases[J]. J Gastrointest Surg, 2017, 21(8):1318-1327. DOI: 10.1007/s11605-017-3444-8
[14] Paparoupa M, Gillissen A. Is myrtol(R) standardized a new alternative toward antibiotics[J]? Pharmacogn Rev, 2016, 10(20):143-146. DOI: 10.4103/0973-7847.194045
[15] 彭开文, 张倩, 刘九洋, 等.肿瘤细胞减灭加腹腔热灌注化疗术后静脉血栓栓塞症的预防[J].中国肿瘤临床, 2017, 44(8):384-389. DOI: 10.3969/j.issn.1000-8179.2017.08.421 [16] 张彦斌, 姬忠贺, 刘刚, 等.双套管持续冲洗负压引流治疗腹膜癌术后胃肠瘘[J].中华普通外科杂志, 2017, 6(32):505-508. http://d.old.wanfangdata.com.cn/Periodical/zhptwk201706013 [17] Liu G, Ji ZH, Yu Y, et al. Treatment of hypermyoglobinemia after CRS + HIPEC for patients with peritoneal carcinomatosis: a retrospective comparative study[J]. Medicine (Baltimore), 2017, 96(45):e8573. DOI: 10.1097/MD.0000000000008573
-
期刊类型引用(12)
1. 雷子颖,丁炳晖,吴启越,罗嘉莉,李峥,王田,王颖思,陈泱晓,黄立峰,何金富,杨贤盛,关天培,阮强,王佳泓,唐鸿生,王进,崔书中. 细胞减灭术联合腹腔热灌注化疗治疗腹膜假黏液瘤的疗效分析. 中华胃肠外科杂志. 2023(12): 1179-1186 .  百度学术
百度学术
2. 杨飞,张亚铭,周潮平,汪大田,高斌,马军,汤代彬,袁建伟,蒋鹏. 局部进展期胃癌根治性手术联合腹腔热灌注化疗的安全性及近期疗效. 中国普通外科杂志. 2021(04): 412-420 .  百度学术
百度学术
3. 李莎,周晓红. 腹腔热灌注化疗联合静脉化疗在肿瘤细胞减灭术后晚期卵巢癌患者中的应用效果. 中国民康医学. 2021(20): 47-49 .  百度学术
百度学术
4. 史冠军,夏奥,蔚莉菲,马瑞卿,许洪斌. 腹膜假黏液瘤的诊断与治疗研究进展. 肿瘤学杂志. 2021(12): 1034-1040 .  百度学术
百度学术
5. 夏奥,马瑞卿,翟喜超,卢一艳,蔡莺,史冠军,安鲁彪,王冰,庞少军,陈峰,许洪斌. 细胞减灭术+腹腔热灌注化疗治疗腹膜假黏液瘤——单中心854例经验总结. 中国肿瘤临床. 2020(03): 145-151 .  本站查看
本站查看
6. 高庆祥,冯飞灵,袁磊,吴越,沈洋,李志臻,姜小清. 腹腔热灌注化疗联合细胞减灭术对胆囊癌腹膜转移的临床疗效研究. 中国肿瘤临床. 2020(03): 140-144 .  本站查看
本站查看
7. 马茹,李鑫宝,闫风彩,林育林,李雁. 肿瘤间质比评估阑尾来源腹膜假黏液瘤的临床价值. 北京大学学报(医学版). 2020(02): 240-246 .  百度学术
百度学术
8. 庄培涛,盖俊杰,梁国刚,王群先,邢雪. 高级别阑尾黏液性肿瘤1例. 临床普外科电子杂志. 2020(02): 37-38+46 .  百度学术
百度学术
9. 马茹,闫风彩,李鑫宝,林育林,李雁. 肿瘤组织病理图像定量分析在腹膜假黏液瘤中的研究进展. 医学综述. 2020(23): 4643-4649 .  百度学术
百度学术
10. 李鑫宝,姬忠贺,林育林,李雁. 细胞减灭术联合腹腔热灌注化疗治疗腹膜假黏液瘤的研究进展. 医学综述. 2019(05): 915-921 .  百度学术
百度学术
11. 林育林,张珏,杨智冉,李鑫宝,姬忠贺,许洪斌,彭正,李雁. 腹膜假黏液瘤人源异种移植模型的研究进展. 医学综述. 2019(14): 2842-2849 .  百度学术
百度学术
12. 史冠军,夏奥,马瑞卿,王冰,翟喜超,安鲁彪,许洪斌. 34例非阑尾来源腹膜假黏液瘤诊治分析. 中国肿瘤临床. 2019(17): 897-902 .  本站查看
本站查看
其他类型引用(1)



 下载:
下载: