-
摘要:目的 探讨鞘氨醇-1-磷酸转运体2(spinster homolog 2,SPNS2)在结直肠癌组织中的表达及其临床意义。方法 选取2010年1月至2013年6月于安徽省立医院经结直肠癌手术切除的133例患者的结直肠癌和癌旁正常组织标本,采用免疫组织化学法检测SPNS2蛋白的表达。另收集2018年2月至2018年6月的29例结直肠癌患者的癌组织和癌旁正常组织标本行RT-qPCR检测。采用χ2检验分析SPNS2在结直肠癌组织中的表达及与患者临床病理特征的关系。采用单因素和多因素分析SPNS2在结直肠癌组织中的表达情况与患者预后的关系。结果 免疫组织化学法结果显示SPNS2在结直肠癌组织中的表达较癌旁正常组织高(81.20% vs. 22.60%,χ2=69.136,P<0.001)。RT-qPCR结果显示SPNS2 mRNA在结直肠癌组织中的表达水平显著高于其对应的癌旁正常组织(t=3.974,P<0.001)。SPNS2蛋白过表达与肿瘤分化程度、淋巴结转移数、肿瘤大小和浸润深度密切相关,差异具有统计学意义(P<0.001)。SPNS2阴性患者的生存期明显优于阳性患者(χ2=13.080,P<0.001)。单因素分析和Cox多因素分析表明,SPNS2异常表达会影响结直肠癌患者总生存率(overall survival,OS),是患者预后的独立影响因素(P<0.05)。结论 SPNS2在结直肠癌组织中的阳性表达与结直肠肿瘤的发生发展有关,SPNS2作为一种新型结直肠肿瘤标记物,在临床上可作为评估患者预后、监测术后肿瘤侵袭转移的指标及诊疗新靶点。Abstract:Objective To investigate the expression and clinical significance of sphingosine-1-phosphate transporter 2 (spinster homolog 2, SPNS2) in colorectal cancer.Methods Colorectal cancer and adjacent normal tissues were collected from 133 patients undergoing colorectal cancer resection in Anhui Provincial Hospital from January 2010 to June 2013. The expression of SPNS2 protein was detected by immunohistochemistry. RT-qPCR was performed on the cancer tissues and adjacent normal tissues of 29 patients with colorectal cancer from February 2018 to June 2018. The relationship between the expression of SPNS2 in cancer tissues and clinicopathological features of colorectal cancer patients was analyzed using χ2 test. The relationship between the expression of SPNS2 and prognosis of patients with colorectal cancer was analyzed based on univariate and multivariate analysis.Results Immunohistochemistry results indicated that the expression of SPNS2 in colorectal cancer tissues was higher than that in adjacent normal tissues (81.20% vs. 22.60%, χ2=69.136, P < 0.001). The results of RT-qPCR indicated that the expression of SPNS2 mRNA in colorectal cancer tissues was significantly higher than that in the corresponding adjacent normal tissues (t=3.974, P < 0.001). The overexpression of SPNS2 protein was closely related to tumor differentiation, lymph node metastasis (pN), tumor size, and depth of invasion (Tx); this difference was statistically significant (P < 0.001). The survival time of patients with negative SPNS2 expression was significantly longer than that of patients with positive expression (χ2=13.080, P < 0.001). Univariate and Cox multivariate analyses showed that abnormal expression of SPNS2 affects the overall survival of colorectal cancer patients and is an independent influencing factor for patient prognosis.Conclusions The positive expression of SPNS2 in colorectal cancer is related to the occurrence and development of colorectal cancer. SPNS2 can be used as a new colorectal tumor marker to evaluate the prognosis of patients, monitor the invasion and metastasis of postoperative tumors, and serve as a new target for diagnosis and treatment.
-
Keywords:
- spinster homolog 2 (SPNS2) /
- colorectal cancer /
- immunohistochemistry /
- RT-qPCR /
- prognosis
-
结直肠癌为最常见的消化道肿瘤之一,其发病率居全球第3位,致死率居第4位[1-3]。目前,以手术为中心的多学科综合治疗是根治结直肠癌的可能治疗方法[4],但术后患者仍存在较大的复发转移风险,因此寻找一种能够用于结直肠癌诊疗及评估患者预后的标记物成为临床研究的重点。研究表明,靶向抑制鞘氨醇-1-磷酸转运体2(spinster homolog 2,SPNS2)的表达,能显著改善结直肠癌、肺癌和乳腺癌患者的预后[5]。SPNS2为鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)的转运体,S1P是一种有效且具有生物活性的信号分子,通过调节细胞增殖、存活、迁移、血管及淋巴管形成促进癌症的发生发展,因此SPNS2对癌症发展也存在一定的调控作用[6]。目前,关于SPNS2与结直肠癌相关性的研究还处于动物模型阶段,尚未开展临床标本检测,本研究采用结直肠癌标本进行检测,能较为准确验证SPNS2的表达差异与结直肠癌患者的各项临床参数、术后生存时间等相关性,以期为评估结直肠癌患者的预后提供新指标。
1. 材料与方法
1.1 材料
1.1.1 病例资料
收集2018年2月至2018年6月于安徽医科大学附属省立医院行手术治疗的29例结直肠癌患者的癌组织和癌旁正常组织(距肿块边缘距离>5 cm)冰冻标本行RT-qPCR检测。另选取2010年1月至2013年6月在安徽医科大学附属省立医院行结直肠癌手术的133例患者的结直肠癌和癌旁正常组织标本,其中男性72例、女性61例。年龄为31~88岁,中位年龄63岁。标本使用4%福尔马林浸泡固定、石蜡包埋,切片,行免疫组织化学法检测。纳入本研究的病例均为原发性结直肠肿瘤,排除家族肿瘤遗传史,术前均未行放化疗。本研究均告知患者或患者家属并征得其同意。
1.1.2 主要试剂与仪器
PCR试剂与仪器:TRIzol购自美国Life Technogies公司,PCR引物购自上海生工生物工程公司,逆转录试剂盒购自德国Thermo Scientific公司,荧光定量PCR试剂盒购自德国Qiagen公司,荧光定量PCR仪购自德国Thermo Scientific公司。免疫组织化学试剂与仪器:一抗兔抗人SPNS2购自北京Bioss生物技术公司,新型酶标羊抗鼠/兔IgG聚合物、免疫组织化学染色试剂盒和DAB显色盒均购自福州迈新生物技术公司。
1.2 方法
1.2.1 免疫组织化学染色及其评价
手术中取下的标本切片厚5 μm,经二甲苯脱蜡、浓度梯度酒精水化;使用磷酸缓冲盐溶液(PBS)洗涤后,3%过氧化氢室温下孵育10 min,以灭活内源性过氧化物酶活性;放置于95℃枸橼酸缓冲液(pH为6.0)中15 min,修复抗原;滴加正常山羊血清封闭液,室温孵育20 min,阻断非特异性免疫反应。待切片干燥后,将一抗兔抗人SPNS2稀释浓度至1: 100滴加于组织表面,4℃孵育过夜。室温下复温30 min,PBS洗涤,滴加新型酶标羊抗鼠/兔IgG聚合物,孵育30 min后滴加现配DAB显色剂显色,苏木精复染2 min,盐酸酒精分化,流水冲洗10 min。常规脱水、透明、封片、镜检。
结果判定:每张切片选择5个高倍镜视野(×200),由两名病理科医生共同判定,对每张切片阳性细胞染色比例及染色强度进行分级评分,根据两项评分之和进行结果判定。阳性细胞染色比例评分标准:无阳性细胞为0分,<20%阳性细胞为1分,20%~50%阳性细胞为2分,>50%细胞为3分。阳性细胞染色强度评分标准:0分(无染色),1分(淡黄色),2分(棕黄色),3分(棕褐色)。两者之和:0~2分为阴性(不表达或低表达);3~6分为阳性(高表达)。
1.2.2 RT-qPCR检测
将冻存于-80℃冰箱的癌组织和癌旁正常组织标本分别使用TRIzol试剂处理,提出癌组织和癌旁组织中的总RNA。使用RevertAidTM first Strand cDNA Synthesis Kit逆转录试剂盒合成cDNA第一链,随后取出cDNA作为荧光定量的模板,使用QuantiNova SyBr Green PCR Kit试剂盒进行PCR检测,分析扩增曲线、溶解曲线以及相对表达量。反应条件:95℃预变性10 min,95℃变性1 min,60℃退火30 s,72℃延伸30 s,共计40个循环。SPNS2基因的特异引物:上游引物序列5'-CATGTTCTTCCTCGCCACTG-3';下游引物序列5'-GCACCACCTCAGACTTTCAC-3';引物长度为111 bp;基因的定量分析使用β-actin作为对照,上游引物序列5'-CCCTGGAGAAGAGCTACGAG-3';下游引物序列5'-GGAAGGAAGGCTGGAAGAGT-3';引物长度为96 bp。采用2-ΔΔCt法计算SPNS2基因表达水平。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。结直肠癌组织和癌旁正常组织SPNS2蛋白表达水平的差异以及SPNS2蛋白表达和结直肠癌患者临床病理特征的关系均采用χ2检验;结直肠癌组织和癌旁正常组织SPNS2的mRNA表达水平差异采用独立样本t检验;采用Kaplan-Meier生存曲线分析SPNS2的过表达与结直肠癌患者总生存率(overall survival,OS)的关系;运用单因素分析及Cox回归多因素分析明确影响结直肠癌患者预后的相关因素。以P<0.05为差异具有统计学意义。
2. 结果
2.1 SPNS2蛋白在结直肠癌组织和癌旁正常组织中的表达情况
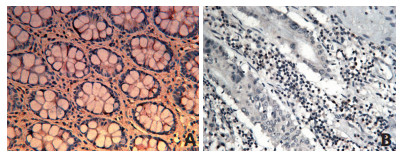
免疫组织化学法检测表明,SPNS2在结直肠癌组织中的阳性率为81.2%(108/133),在癌旁正常组织中的阳性率为22.6%(30/133),差异具有统计学意义(χ2=69.136,P<0.001,表 1,图 1)。
表 1 SPNS2蛋白在结直肠癌组织和癌旁正常组织中的表达(例)
2.2 SPNS2 mRNA在结直肠癌组织和癌旁正常组织中的表达
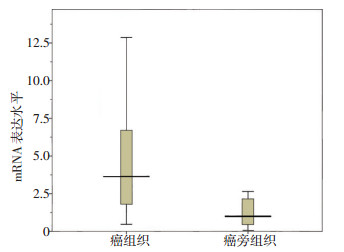
RT-qPCR检测结果表明,SPNS2 mRNA在结直肠癌组织中的表达水平明显高于其对应的癌旁正常组织,表达水平均值分别为4.68±4.21和1.12±0.86,差异具有统计学意义(t=3.974,P<0.001,图 2)。
2.3 SPNS2蛋白在结直肠癌组织中的表达水平与临床病理特征的关系
经免疫组织化学法检测133例结直肠癌组织中的SPNS2蛋白表达水平与相对应患者的临床病理特征关系的结果表明,SPNS2蛋白的阳性表达与肿瘤分化程度、淋巴结转移数、肿瘤大小和浸润深度密切相关,差异具有统计学意义(P<0.001),但与患者的年龄、性别无关,差异无统计学意义(表 2)。
表 2 结直肠癌组织中的SPNS2表达与患者临床病理特征的关系
2.4 SPNS2蛋白在结直肠癌组织中的表达水平与结直肠癌患者预后的关系
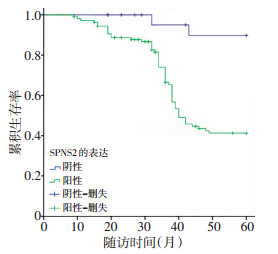
将结直肠癌组织中的SPNS2蛋白表达水平作为因变量绘制Kaplan-Meier生存曲线(图 3),结果表明SPNS2阴性表达患者的OS明显长于阳性表达患者(χ2=13.080,P<0.001)。单因素分析表明,淋巴结转移数、肿瘤大小、SPNS2表达异常、远处转移、浸润深度、分化程度与结直肠癌患者预后相关(P<0.05),患者的年龄、性别等与患者预后无显著相关性(表 3)。多因素分析结果表明,淋巴结转移数、SPNS2表达异常、远处转移、浸润深度是结直肠癌患者预后的独立影响因素(P<0.05,表 4)。
表 3 结直肠癌患者影响预后的单因素分析 表 4 结直肠癌患者影响预后的Cox多因素分析
表 4 结直肠癌患者影响预后的Cox多因素分析
3. 讨论
SPNS2最初定义于对果蝇的研究,其生理功能最早发现于对斑马鱼的研究[7-8]。SPNS2主要参与S1P的外排,结构与甘油-3-磷酸转运蛋白相似,是一个具有12个跨膜区域的蛋白质,含有504个氨基酸残基[9-10],属于主要协助转运蛋白超家族(major facilitator superfamily,MFS)的一员。
关于S1P的研究,Adada等[11]通过相关蛋白、基因、细胞学的研究表明,S1P是表皮生长因子(epidermal growth factor,EGF)促近肿瘤细胞生长侵袭的一种新途径。通过建立结直肠肿瘤模型,对S1P在结直肠肿瘤中的研究结果表明,S1P在结直肠肿瘤细胞中高表达,而在正常结直肠表面上皮细胞中不表达,进一步通过免疫组织化学法、基因转染、细胞学实验等研究表明S1P可以促进结直肠癌细胞增殖[12-13]。2012年,Hisano等[14]首次在哺乳动物中研究SPNS2与S1P的关系,结果表明SPNS2是哺乳动物中第一个生理S1P转运体,是淋巴细胞从胸腺流出的关键决定因素。Weyden等[15]对于SPNS2的研究结果表明,当缺乏SPNS2时,会使S1P对于淋巴细胞的转运调控能力下降,导致组织内淋巴细胞循环减少,T细胞、NK细胞比例升高,从而更有效地杀伤肿瘤细胞,并且在整体上减少肿瘤的转移,该研究先后在小鼠的肺、肝脏组织中得到证实,并且利用结直肠肿瘤细胞株MC-38进行验证,也得到SPNS2可以促进结直肠肿瘤转移的结果。
本研究对于SPNS2在结直肠肿瘤中采用人体肿瘤组织进行验证,免疫组织化学法检测SPNS2蛋白在结直肠癌组织中的表达,表明SPNS2蛋白在结直肠癌组织中的表达明显高于癌旁正常组织,进一步分析SPNS2蛋白的表达结果与结直肠癌患者临床病理学特征的关系,发现SPNS2阳性表达与肿瘤分化程度、淋巴结转移数、肿瘤大小、浸润深度密切相关,与患者的年龄、性别无关。此外,本研究还采用RT-qPCR检测结直肠癌组织和癌旁正常组织中SPNS2 mRNA的表达,结果与蛋白表达结果相一致,癌组织中SPNS2 mRNA的表达明显高于癌旁组织。单因素分析结果表明,SPNS2的表达、淋巴结转移数、肿瘤大小、肿瘤分化程度、浸润深度、肿瘤远处转移与结直肠癌患者的OS密切相关。进一步通过多因素Cox回归分析显示,SPNS2的表达、淋巴结转移数、浸润深度、肿瘤远处转移可作为结直肠癌患者预后的独立影响因素。
综上所述,SPNS2在结直肠癌中的阳性表达与结直肠肿瘤的发生发展有关,SPNS2可作为新型结直肠肿瘤标记物,在临床上可作为评估患者预后、监测术后肿瘤侵袭转移的指标及诊疗的新靶点,为改善结直肠癌的诊疗效果提供新的研究方向。
-
表 1 SPNS2蛋白在结直肠癌组织和癌旁正常组织中的表达(例)

表 2 结直肠癌组织中的SPNS2表达与患者临床病理特征的关系

表 3 结直肠癌患者影响预后的单因素分析

表 4 结直肠癌患者影响预后的Cox多因素分析

-
[1] Favoriti P, Garbone G, Greco M, et al. Worldwide burden of colorectal cancer: a review[J]. Updates Surg, 2016, 68(1):7-11. DOI: 10.1007/s13304-016-0359-y
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1):7-30. DOI: 10.3322/caac.21332
[3] 魏友芬, 李桂香.PD-1/PD-L1抑制剂在结直肠癌中的研究进展[J].中国肿瘤临床, 2018, 45(3):157-160. DOI: 10.3969/j.issn.1000-8179.2018.03.860 [4] 霍雄伟, 王效龙, 魏光兵, 等.手辅助腹腔镜与腹腔镜辅助手术治疗结直肠癌的对比研究[J].西安交通大学学报(医学版), 2017, 38(1): 92-95. http://d.old.wanfangdata.com.cn/Periodical/xaykdxxb201701019 [5] Weyden LV, Arends MJ, Campbell AD, et al. Genome-wide in vivo screen identifies novel host regulators of metastatic colonization[J]. Nature, 2017, 541(7636):233-236. DOI: 10.1038/nature20792
[6] 王燕, 扈金萍.鞘氨醇-1-磷酸转运体Spns2的研究进展[J].国际药学研究杂志, 2016, 43(6):1043-1048. http://d.old.wanfangdata.com.cn/Periodical/gwyx-yxfc201606004 [7] Nakano Y, Fujitani K, Kurihara J, et al. Mutations in the novel membrane protein spinster interfere with programmed cell death and cause neural degeneration in drosophila melanogaster[J]. Mol Cell Biol, 2001, 21(11):3775-3788. DOI: 10.1128/MCB.21.11.3775-3788.2001
[8] Kawahara A, Nishi T, Hisano Y, et al. The sphingolipid transporter Spns2 functions in migration of zebrafish myocardial precursors[J]. Science, 2009, 323(5913):524-527. DOI: 10.1126/science.1167449
[9] Li P, Gu YZ, Li J, et al. Mycobacterium tuberculosis major facilitator superfamily transporters[J]. J Membr Biol, 2017, 250(6):573-585. DOI: 10.1007/s00232-017-9982-x
[10] Yan N. Structural biology of the major facilitator superfamily transporters[J]. Annu Rev Biophys, 2015, 44:257-283. DOI: 10.1146/annurev-biophys-060414-033901
[11] Adada MM, Canals D, Jeong N, et al. Intracellular sphingosine kinase 2-derived sphingosine-1-phosphate mediates epidermal growth factorinduced ezrin-radixin-moesin phosphorylation and cancer cell invasion [J]. FASEB J, 2015, 29(11):4654-4669. DOI: 10.1096/fj.15-274340
[12] El-Emir E, Dearling JL, Huhalov A, et al. Characterisation and radioimmunotherapy of L19-SIP, an anti-angiogenic antibody against the extra domain B of fibronectin, in colorectal tumour models[J]. Br J Cancer, 2007, 96(12):1862-1870. DOI: 10.1038/sj.bjc.6603806
[13] Zhai HH, Shi YQ, Chen X, et al. Cacy BP/SIP promotes the proliferation of colon cancer cells[J]. PLoS One, 2017, 12(2):1-16. http://pubmedcentralcanada.ca/pmcc/articles/PMC5308830/?report=reader
[14] Hisano Y, Kobayashi N, Yamaguchi A, et al. Mouse SPNS2 functions as a sphingosine-1-phosphate transporter in vascular endothelial cells[J]. PLoS One, 2012, 7(6):1-11. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3379171
[15] Weyden LV, Arends MJ, Campbell AD, et al. Genome-wide in vivo screen identifies novel host regulators of metastatic colonization[J]. Nature, 2017, 541(7636):233-236. DOI: 10.1038/nature20792
-
期刊类型引用(3)
1. 刘江华,刘炜,郭明发. 神经母细胞瘤SPNS2表达及相关机制探讨. 社区医学杂志. 2022(20): 1146-1153 .  百度学术
百度学术
2. 张鹤松,张传海,马金良,荚卫东,余继海. SPNS2在肝细胞性肝癌中的表达及其与上皮间质转化的关系. 安徽医科大学学报. 2021(07): 1143-1147 .  百度学术
百度学术
3. 王晓军,曹鹏,朱新华. SPNS2和Lgr5在喉鳞状细胞癌中的表达及其与预后的相关性. 国际肿瘤学杂志. 2020(03): 135-140 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: