-
摘要:目的 通过现有实体瘤临床评估体系,对骨来源恶性肿瘤术前化疗前后的影像学资料进行总结,对比病理学评估结果,进一步提出并完善适合骨来源恶性肿瘤疗效的临床评估体系。方法 回顾性分析自2014年6月至2017年3月就诊于北京大学人民医院的190例连续病例,最后纳入研究157例,通过病理学Huvos分级将病例进行分组,对术前化疗前后的临床资料(肿瘤最大径变化、代谢参数的变化,以及一些公认的描述性参数)进行差异性检验及通过受试者工作曲线(receiver operating characteristic curve,ROC)计算肿瘤各项参数的变化率对术前化疗病理反应的ROC曲线下面积,并判断病理学分级的截点。结果 对原发肢体骨包含软组织包块的病例,判断坏死率为100%、90%及50%的最大径变化率截点分别为86%、50.7%和0.02%,骨扫描的T/B值变化率对坏死率预测效果不好,而PET/CT的SUVmax变化率对应坏死率为90%和50%的截点分别为60.7%和31.4%;而骨性边界变清晰及骨性密度增高为90%以上的病理学特异性表现形式。对不含软组织包块的原发纯骨内病变的病例,尚未发现有意义的临床评估指标。对中轴骨(包括颌面骨、脊柱及骨盆等)的病灶,由于病例数少,临床评估的截点目前区分度不大。结论 本研究对骨来源肿瘤的疗效临床评估提出了更具体的定义和不同病理学分级的界值,该临床评估体系的完善需通过前瞻、多中心、大宗数据进一步验证和讨论。Abstract:Objective To evaluate whether clinical imaging findings of sarcomas after preoperative chemotherapy correlate with tumor responses by pathological evaluation using the rate of necrosis, so as to develop reliable and quantitative evaluation of clinical response.Methods We retrospectively reviewed the medical records of 190 patients with high-grade sarcomas (mainly osteosarcomas and Ewing's sarcomas) that originated from the bone and who received neoadjuvant chemotherapy from June 1, 2014 to March 1, 2017 at Peking University People's Hospital. Finally, 157 lesions were evaluated by clinical imaging, including X-ray, computed tomography, magnetic resonance imaging, and bone scans or PET/CT. All patients underwent surgery at our center and pathological evaluation by tumor necrosis rates, which were graded by Huvos' classification, where grade Ⅰ is 0 to 49%, gradeⅡ is 50% to 89%, grade Ⅲ is 90% to 99%, and grade Ⅳ is 100% necrosis. Statistical diversity analysis was performed by different pathological groups and receiver operating characteristic (ROC) curves. ROC curves were generated to determine the dividing clinical parameters (cut-off values) to distinguish different pathological groups.Results The cut-off values of the rate change in maximum diameters of tumors located in the extremities were 86%, 50.7%, and 0.02% for Huvos' Ⅳ, Ⅲ, Ⅱ, and Ⅰgroups, respectively. The differentiation was not obvious using bone scans to distinguish different pathological responses. The cut-off value for SUVmax for Huvos' Ⅲ, Ⅱ, andⅠ groups were 60.7% and 31.4%, respectively. We did not identify any valuable clinical parameters to evaluate the lesion restricted inside the bone. For sarcomas that originated from the axial skeleton, because of the small size of the sample, the differentiation was not so obvious.Conclusions This study clearly defined the measuring methods for sarcomas primarily originating from the bone and attempted to determine meaningful cut-off values for multiple pathological response groups. A prospective multicenter trial is warranted to expand the sample size to make this clinical evaluation more precise and practical.
-
Keywords:
- osteosarcoma /
- Ewing's sarcoma, /
- clinical evaluation /
- pathological evaluation /
- chemotherapy /
- targeted therapy
-
在药物治疗及肿瘤临床试验的过程中,需实时对疗效做出评价,以便指导治疗。自1979年WHO及2009年RECIST1.1临床评估的统一标准提出以来[1-6],临床评估的各项概念目前已成为各种实体瘤临床试验中疗效评估的有效手段。
但是,对骨来源的恶性肿瘤,临床评估较为困难。骨组织对药物的反应表现为骨修复,不像实体瘤的软组织体积的变化那么直观而敏感,并且,骨来源的肿瘤中还有成骨肉瘤等常见的肿瘤,肿瘤性成骨与用药有效的修复性成骨往往难以区分。
Rosen等[7]在1982年提出Huvos分级系统的理论。本研究拟通过病理学评估对骨来源恶性肿瘤术前化疗的临床评估中各项参数变化进行界定,以期完善和丰富实体瘤的临床评估标准。
1. 材料与方法
1.1 一般资料
回顾性分析自2014年6月至2017年3月就诊于北京大学人民医院的190例连续病例。纳入标准:1)初治于本院,经粗针穿刺活检病理证实为高级别骨肉瘤或尤文肉瘤;2)均行规范的术前化疗;3)行手术切除局部病灶,并获得标本的坏死率;4)术前化疗前后均行局部X线片、CT、MRI及骨扫描或局部断层PET/CT检查,资料完整。最后入组病例157例,其中,23例为中轴骨肿瘤,134例为肢体骨肿瘤(120例为肢体骨肿瘤包含软组织包块的病例,14例为纯骨内的病灶)。排除标准:1)未经手术治疗(软组织包块最大径≥1 cm)无法获得病理学评估;2)化疗前后资料不全无法进行临床评估。
1.2 方法
1.2.1 标准化定义
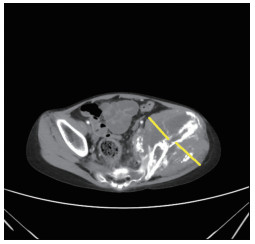
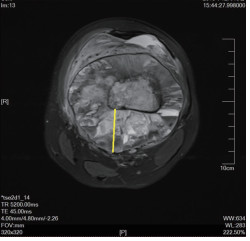
1)参考RECIST1.1标准[8],所有骨来源的肿瘤病灶的测量须在增强CT或增强MRI上进行。2)无论大小或代谢变化如何,化疗前后均应在同一个层面测量同一个部分经线的变化。所有的测量参数,均应由3个不同年资的影像科医生分别完成,且最后取其所测数据的均值。肢体骨包含软组织包块的经线测量D1:测量薄层CT/MRI轴位的软组织垂直于纵轴的最大径(图 1),记为D1。肢体骨纯骨内病变的经线测量D2(对骨破坏不伴软组织包块或软组织包块不明显的病灶):为断层轴位CT/MRI上两个垂直经线的加和(图 2),记为D2。中轴骨软组织包块的经线测量D3(中轴骨的病灶一般均包含软组织包块),由于骨的形状不规则,在定义测量的最大经线D3为断层轴位CT/MRI上垂直于骨面的单侧最大经线[例如,髂骨板内外侧均含软组织包块,则应分别测量内外侧软组织包块的最大径,选择更大的一侧作为测量基线,而不是将两者叠加(图 3)]。
1.2.2 骨显像T/B值的测量
无论是肢体骨还是中轴骨,骨显像量化(肿瘤/本底比值(tumor/base value,T/B)值的测量方法均是勾画肿瘤化疗前后的感兴趣区域(region of interest,ROI),计算平均核素放射性计数值,勾画化疗前后左、右髂嵴处固定大小的方形ROI,计算其平均放射性计数值作为本底比值,T/B值等于两个值之比。PET-CT的SUVmax的测量:患者需在化疗前后均行正电子发射计算机断层显像仪/X-射线计算机体层显像技术检查(positron emission tomography/computed tomography with fluorine-18-fluorodeoxyglucose,18F-FDG PET-CT)。SUV是半定量指标[9](指局部组织摄取的显像剂的放射性活度标准化处理后的数值)。SUV=病灶的放射性浓度(kBq/mL)/注射剂量(MBq)/体重(kg)。病灶内最大SUV摄取值即为SUVmax。
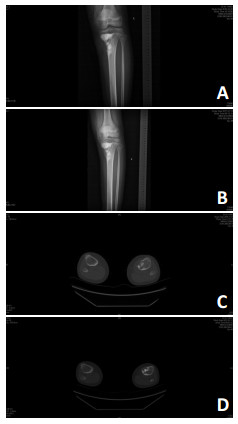
本研究中部分评估概念相对主观,如肿瘤中心坏死:指化疗前后肿瘤中心出现明显液化区域范围较前增加50%,肺实质病变及已存在液化区域的肿瘤除外[10]。骨性边界清晰:指化疗前后的平片及局部CT骨窗下观察到原骨质破坏区域出现完整骨壳形成(图 4)。骨性密度增高:指化疗后的平片或局部CT骨窗下观察到骨质破坏区域出现骨化密度明显增高(相比化疗前CT值,单位Hu至少增加50%以上)的现象。化疗前已经为成骨表现为主或溶骨与成骨混合的病灶不属于此评估标准。
1.2.3 研究流程
所有研究对象在术前化疗前后均行局部X线片、增强CT、增强MRI及代谢显像检查(包括骨扫描或局部断层PET/CT检查,但化疗前后需行同一检查),所有病例均遵循本中心的治疗流程进行术前化疗。骨肉瘤的术前化疗方案包含以下4种药物为主的联合方案(阿霉素、顺铂、大剂量甲氨蝶呤和异环磷酰胺)[11]。对尤文肉瘤的病例,术前需行2~3个周期VDC-IE的方案[12](共4~6组药物),具体剂量为:长春新碱1.4 mg/m2(最大2 mg)d1、阿霉素60 mg/m2 d1,2、环磷酰胺1.2 g/m2 d1,序贯异环磷酰胺1 800 mg/m2/d d1-5、依托泊苷100 mg/m2/d d1-5。
1.2.4 病理学评估
手术后,所有的标本均按照Huvos系统进行分级[13]。根据手术病理坏死率的不同,研究者将肿瘤对新辅助化疗的反应分为4种级别,其中Ⅰ级为化疗无效或效果极不明显;Ⅱ级为化疗部分有效,肿瘤坏死率超过50%,但部分区域可见残余活跃肿瘤细胞;Ⅲ级为肿瘤坏死率超过90%,但部分区域局灶可见残余活跃肿瘤细胞;Ⅳ级为全部区域均无活跃肿瘤细胞。随后以T10方案为基础进行多项临床试验[14-15],均证明Huvos分级Ⅲ级以上(坏死率>90%)是预后良好的独立影响因素。
1.3 统计学分析
采用SPSS15.0软件进行统计学分析,将所有病例按Huvos分级分组,判断术前化疗前后肿瘤最大径及代谢参数的变化率是否均服从正态分布。对两组的最大径缩小率进行两组独立样本t检验比较(非正态分布的数据进行Mann-Whitney U检验)。以术后病理反应性分组作为“金标准”,采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析,计算肿瘤各项参数的变化率对术前化疗病理反应性评估的ROC的曲线下面积值,并判断诊断的截断点(cut-off值)。P < 0.05为差异具有统计学意义。
2. 结果
2.1 数据分布
最终共157例完整病例资料入组。141例为骨肉瘤,16例为尤文肉瘤。其中120例为肢体骨包含软组织包块的病例,14例为肢体骨纯骨内病变的病例,23例为中轴骨的病例。在肢体骨中,Huvos分级Ⅳ级6例,Ⅲ级49例,Ⅱ级61例,Ⅰ级18例。由于中轴骨的病例数太少未行正态分布检验。在肢体骨中,D1变化率在Huvos分级的Ⅲ级,Ⅱ级均不呈正态分布(P= 0.000,P=0.020),Ⅳ级、Ⅰ级呈正态分布(P=0.112,P= 0.200);T/B值变化率在Ⅲ级、Ⅱ级呈正态分布(均P= 0.200);SUVmax变化率在Huvos分级的Ⅳ级、Ⅲ级、Ⅰ级成正态分布(P=0.879,P=0.200,P=0.200),Ⅱ级成非正态分布(P=0.011)。
2.2 肢体骨包含软组织包块的各项参数
2.2.1 肢体骨软组织包块的最大径D1
1)D1变化率:对肢体骨包含软组织包块的病例,已经提到2种不同的测量方法。通过方法D1测量的病灶,D1变化率在Huvos不同分级间差异有统计学意义(P=0.000),并且D1的变化率在Ⅳ及Ⅲ分牟间的差异性(P=0.322),Ⅲ及Ⅱ分牟间的差异性(P=0.028),Ⅱ及Ⅰ分牟间差异性(P=0.000)均具有统计学意义。通过行ROC曲线分析,判断不同病理学分级间的截点及敏感度、特异度的情况详见表 1。2)D1化疗后的值:针对坏死率为100%即临床认为完全缓解的病例,对单纯化疗后的D1测量值(而非变化率)行ROC曲线分析,坏死率为100%的D1化疗后测量值的截点为0.45cm,曲线下面积为0.688,该截点的敏感度为55.8%,特异度为100%。
表 1 预测组织学坏死率的各项参数
2.2.2 骨扫描中的T/B值
本研究中肢体骨包含软组织包块的病例化疗前后行骨扫描检查的病例共15例,其中Huvos分级Ⅳ级0例,Ⅲ级7例,Ⅱ级7例,Ⅰ级1例。通过秩和检验发现T/B值的变化率在Huvos不同分级间差异无统计学意义(P=0.829)。Huvos Ⅲ级与Ⅱ级间做ROC曲线分析,发现曲线下面积为0.490,不适合找截点,差异无统计学意义。
2.2.3 PET/CT中的病灶内SUVmax的检测
本研究中,肢体骨带软组织包块的病例,共有41例行化疗前后的PET/CT检查,其中,Huvos Ⅳ级3例,Ⅲ级11例,Ⅱ级21例,Ⅰ级6例,通过行ROC曲线分析,判断坏死率为100%的SUVmax变化率的ROC曲线下面积 < 0.50,未作截点分析。坏死率为90%的SUVmax变化率的截点为60.7%,曲线下面积为0.687,该截点的敏感度为45.5%,特异度为95.7%。坏死率为50%的SUVmax变化率的截点为31.4%,曲线下面积为0.739,该截点的敏感度为56.5%,特异度为100%。
2.2.4 描述性参数定义
在观察肢体肿瘤化疗前后的影像学表现时,发现一些描述性的变化,例如:肿瘤中心坏死、骨性边界清晰、骨性密度增高。对这些参数作为分类变量加以记录,并以肿瘤手术病理坏死率为连续变量,倒过来做ROC曲线分析。结果发现在所有肢体骨的病例中,出现肿瘤中心坏死8例,未出现肿瘤中心坏死126例,两组间未发现肿瘤坏死率差异有统计学意义(P=0.444),ROC曲线下面积 < 0.50,未找到有意义的截点。45例出现骨性边界变清晰,89例未出现骨性边界变清晰,两组坏死率差异无统计学意义(P=0.138),ROC曲线下面积为0.557,坏死率的截点为92.04%,该截点的敏感度为46.7%,特异度为71.9%。32例出现骨性密度增高,102例未出现骨性密度增高,两组坏死率差异无统计学意义(P=0.153),ROC曲线下面积为0.596,坏死率的截点为88.01%,该截点的敏感度为62.5%,特异度为62.7%。
2.3 肢体纯骨内病变的各项参数
对肢体纯骨内病变的D2变化率、T/B值、SUVmax以及各项描述性参数在化疗前后病理学分级间差异无统计学意义(P=0.233,P=0.895、P=0.295,P=0.109),ROC曲线无法获得有效的截点。
2.4 中轴骨化疗前后各项参数的变化
2.4.1 D3变化率
本研究中共有23例中轴骨的病灶,其中14例为骨肉瘤,9例为尤文肉瘤。由于病例数较少,D3变化率在Ⅳ及Ⅲ分级间的差异性P值为0.643,Ⅲ及Ⅱ分级间的差异性P值为0.108,Ⅱ及Ⅰ分级间差异性P值为0.694。通过行ROC曲线分析,判断坏死率为100%的D3变化率的截点为44.7%,曲线下面积为0.667,该截点的敏感度为100%,特异度为50%。坏死率为90%的D3变化率的截点为36%,曲线下面积为0.771,该截点的敏感度为66.7%,特异度为87.5%。坏死率为50%的D3的ROC曲线下面积为0.429,未找到有意义的截点。
2.4.2 T/B值
中轴骨的病例只有3例行化疗前后的骨扫描检查,不足以行统计学分析T/B值对坏死率的影响。
2.4.3 SUVmax中轴骨
因病例只有1例行化疗前后的PET/CT检查,也不足以进行统计学分析SUVmax对坏死率的预测情况。
2.4.4 中轴骨的描述性参数
本研究的中轴骨病例中,由于病例数较少,通过秩和检验,发现肿瘤中心坏死、骨性边界变清晰和骨性密度增高均在不同坏死率间差异无统计学意义(P=0.177,P=0.505,P=0.870)。由于病例数的限制,未行ROC曲线进一步分析各个分类变量的参数分组对坏死率的影响。
本研究对一些肢体骨包含软组织包块的参数检验发现,肿瘤经线D1的变化率对坏死率的预测准确性优于PET/CT中SUVmax的预测,同时,一些分类变量的参数可作为辅助评估的工作,或可将骨来源肿瘤药物治疗的临床评估手段进一步完善(表 2)。
表 2 骨来源病灶的临床评估
3. 讨论
2009年,RECIST工作委员会通过基于EORTC的病例数据库(包含>6 500例病例的>1 800个靶目标对临床反应和疾病无进展生存期的影响)的研究结果,提出了RECIST 1.1的临床评估体系[16]。目前,这项临床评估系统已沿用至今,仍然是各种实体瘤临床评估最常用和最实用的系统。
本研究由于样本量较小,很多参数的检测ROC曲线下面积均 < 0.7,数据量小易导致的误差和偏倚。目前本研究仅提供一个方法学的评估手段,不足以成为骨来源临床评估系统指南式的提纲。
在本研究中肢体骨纯骨内病变的(不含软组织包块)病例数为14例,但是在临床评估中尚未发现有意义的指标以利于预测肿瘤的病理学反应情况。Choi等[2]评估GISTs使用伊马替尼的临床疗效,发现RECIST的指标不够敏感,一些有临床受益的病例并未出现病灶形态学最大径线的变化。于是对40例GISTs患者的172个病灶进行病灶局部增强CT和PET/CT的检查,提出薄层CT上肿瘤增强信号减弱15%或肿瘤最大径减少10%的病例可算临床缓解。在本研究中,对1例纯骨内病变的左胫骨近端骨肉瘤患者进行测量,结果发现化疗前后病灶同层面溶骨部分选取ROI,化疗前增强较平扫CT值增加约200%,化疗后增加约67%,术后病理坏死率81%,有明显变化。因此,是否可以采用类似的CT值来进行客观评估,是值得探讨的问题。
本研究还有许多亟待解决的不足。1)临床评估是为了指导进一步用药的有效手段,往往在临床化疗或靶向治疗的过程中,只有肿瘤出现进展,才更换药物。而本研究中主要是通过坏死率的Huvos分级来分组,而肿瘤坏死率 < 50%是否就是临床用药中肿瘤进展的病例有待商议。也许其中的部分病例虽然没有肿瘤的缓解,但也属于疾病稳定的范畴。如何通过病理学评估划分出更为有临床意义的患者组群来是研究的宗旨。2)中轴骨的病例是否应该用Huvos分级来划分,也是一个亟待讨论的问题。中轴骨对化疗的反应更差,是否结合临床情况需要区别对待,需要进一步增加临床参数,例如CT值增强信号的减弱,进而提出不同参数的不同权重,使临床评估更加合理;这些问题的解决有待于临床医师进一步讨论和多中心联合大宗数据库进行前瞻性临床试验来验证。
本研究通过单中心回顾性数据对骨来源的肿瘤的疗效临床评估提出了更具体的定义和不同病理学分组的界值,该临床评估体系的完善需通过前瞻、多中心、大宗数据进一步验证和专家讨论完善。
-
表 1 预测组织学坏死率的各项参数

表 2 骨来源病灶的临床评估

-
[1] Moertel CG, Hanley JA. The effect of measuring error on the results of therapeutic trials in advanced cancer[J]. Cancer, 1976, 38 (1):388-394. DOI: 10.1002/(ISSN)1097-0142
[2] Choi H, Charnsangavej C, Faria SC, et al. Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria[J]. J Clin Oncol, 2007, 25(13):1753-1759. DOI: 10.1200/JCO.2006.07.3049
[3] Hamaoka T, Madewell JE, Podoloff DA et al. Bone imaging in metastatic breast cancer[J]. J Clin Oncol, 2004, 22(14):2942-2953. DOI: 10.1200/JCO.2004.08.181
[4] Smith AD, Shah SN, Rini BI, et al. Morphology, Attenuation, Size, and Structure (MASS) criteria: assessing response and predicting clinical outcome in metastatic renal cell carcinoma on antiangiogenic targeted therapy[J]. AJR Am J Roentgenol, 2010, 194(6):1470- 1478. DOI: 10.2214/AJR.09.3456
[5] Smith AD, Lieber ML, Shah SN. Assessing tumor response and detecting recurrence in metastatic renal cell carcinoma on targeted therapy: importance of size and attenuation on contrast-enhanced CT[J]. AJR Am J Roentgenol, 2010, 194(1):157-165. DOI: 10.2214/AJR.09.2941
[6] Costelloe CM, Chuang HH, Madewell JE, et al. Cancer response criteria and bone metastases: RECIST 1.1, MDA and PERCIST[J]. J Cancer, 2010, 1:80-92. http://d.old.wanfangdata.com.cn/OAPaper/oai_doaj-articles_cae9e54c0e34a7adee83cf752efbf653
[7] Rosen G, Caparros B, Huvos AG et al. Preoperative chemotherapy for osteogenic sarcoma: selection of postoperative adjuvant chemotherapy based on the response of the primary tumor to preoperative chemotherapy[J]. Cancer, 1982, 49(6):1221-1230. DOI: 10.1002/(ISSN)1097-0142
[8] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(7):228-247. DOI: 10.1016-j.ejca.2008.10.026/
[9] O JH, Lodge MA, Wahl RL. Practical PERCIST: A Simplified Guide to PET Response Criteria in Solid Tumors 1.0[J]. Radiology, 2016, 280 (2):576-584. DOI: 10.1148/radiol.2016142043
[10] Stacchiotti S, Collini P, Messina A et al. High-grade soft-tissue sarcomas: tumor response assessment--pilot study to assess the correlation between radiologic and pathologic response by using RECIST and Choi criteria[J]. Radiology, 2009, 251(2):447-456. DOI: 10.1148/radiol.2512081403
[11] Xie L, Guo W, Tang X, et al. Effects of arsenic trioxide on minor progressive high-grade osteosarcoma of the extremities metastatic to the lung: results of 39 patients treated in a single institution[J]. Case Rep Oncol, 2016, 9(3):1-19. http://cn.bing.com/academic/profile?id=19b0b974a55ae9408816769df54eda70&encoded=0&v=paper_preview&mkt=zh-cn
[12] Esiashvili N, Goodman M, Marcus RB, Jr. Changes in incidence and survival of Ewing sarcoma patients over the past 3 decades: Surveillance Epidemiology and End Results data[J]. J Pediatr Hematol Oncol, 2008, 30(2):425-430. http://cn.bing.com/academic/profile?id=fa317cf4d49790b4d7a34d1f8ec4d022&encoded=0&v=paper_preview&mkt=zh-cn
[13] Picci P, Bacci G, Campanacci M, et al. Histologic evaluation of necrosis in osteosarcoma induced by chemotherapy. Regional mapping of viable and nonviable tumor[J]. Cancer, 1985, 56:1515-1521. DOI: 10.1002/(ISSN)1097-0142
[14] Meyers PA, Heller G, Healey J, et al. Chemotherapy for nonmetastatic osteogenic sarcoma: the Memorial Sloan- Kettering experience [J]. J Clin Oncol, 1992, 10(1):5-15. DOI: 10.1200/JCO.1992.10.1.5
[15] Boussen H, Mezzi F, Gamoudi A, et al.[Primary chemotherapy with the Rosen T10 protocol before conservative surgery in limb primitive osteosarcomas: results about 56 cases][J]. Bull Cancer, 2000, 87 (2):183-188. https://www.researchgate.net/publication/12611006_Primary_chemotherapy_with_the_Rosen_T10_protocol_before_conservative_surgery_in_limb_primitive_osteosarcomas_Results_about_56_cases
[16] Wahl RL, Jacene H, Kasamon Y, et al. From RECIST to PERCIST: evolving considerations for PET response criteria in solid tumors[J]. J Nucl Med, 2009, 50(Suppl 1):122S-150S. http://cn.bing.com/academic/profile?id=62d2452a9a2a922868048cd640d2fbad&encoded=0&v=paper_preview&mkt=zh-cn
-
期刊类型引用(4)
1. 翁翔,姜婷,赵明哲,胡慧仙. 弥漫大B细胞淋巴瘤化疗前后18F-FDG PET/CT参数肿瘤与非肿瘤摄取比的变化程度与预后的相关性研究. 浙江中西医结合杂志. 2024(08): 720-723 .  百度学术
百度学术
2. 刘霄龙,李庄严,张良,张士杰. 人工股骨头置换术治疗股骨转移瘤患者的疗效. 癌症进展. 2024(24): 2730-2733 .  百度学术
百度学术
3. 中国骨肿瘤热消融治疗专家共识. 中国肿瘤临床. 2023(13): 649-653 .  本站查看
本站查看
4. 唐司亚,田明波,李凯龙. 绞链式与非绞链式人工全膝关节置换术治疗股骨下端恶性骨肿瘤患者的临床效果比较. 癌症进展. 2021(07): 715-717 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: