The effect of entinostat on NK killing effect on non-small cell lung cancer in vitro
-
摘要:目的 观察Entinostat对非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞A549和HCC-827表面NKG2D配体表达的影响,比较经Entinostat处理前后A549和HCC-827细胞对NK细胞杀伤作用的敏感性。方法 通过MTT法检测Entinostat对A549和HCC-827细胞增殖的影响,流式细胞术检测NKG2D配体表达的变化,RT-PCR检测配体在mRNA水平的变化,并用ELISA检测细胞培养上清中可溶性MICA的含量。乳酸脱氢酶释放实验检测Entinostat作用后的A549和HCC-827细胞对NK细胞杀伤作用的敏感性。结果 Entinostat对A549和HCC-827细胞的生长抑制作用具有时间-剂量依赖性。以0.5、1 μmol/L Entinostat诱导A549和HCC-827细胞48h后,细胞表面NKG2D配体表达水平升高,MICA和MICB的mRNA转录水平升高。1 μmol/L Entinostat提高了A549细胞培养上清中可溶性MICA表达水平。0.5、1 μmol/L Entinostat增强了HCC-827细胞对NK细胞杀伤作用的敏感性。结论 Entinostat通过上调NSCLC NKG2D配体的表达,提高NK细胞对NSCLC的杀伤作用,为探讨NSCLC的治疗提供了新的方法和理论依据。
-
关键词:
- Entinostat /
- 非小细胞肺癌 /
- NKG2D配体 /
- NK细胞
Abstract:Objective To investigate the Effects of entinostat on the expression of NKG2D ligands in the non- small cell lung cancer (NSCLC) cell lines, A549 and HCC-827, and to detect the effect of entinostat-mediated NK cell killing of A549 and HCC-827 cells.Methods The effect of entinostat on A549 and HCC-827 cell proliferation was measured by MTT assay. Flow cytometry was used to detect the expression of NKG2D ligands. mRNA levels of the ligands were detected by RT-PCR. The level of soluble MICA in cell culture supernatant was evaluated by ELISA. The cytotoxicity of NK cells against A549 and HCC-827 cell lines (treated with entinostat) was assessed using lactate dehydrogenase release assay.Results Entinostat showed a time- and dose-dependent inhibition effect on the proliferation of A549 and HCC-827 cell lines. The expression of NKG2D ligands and mRNA transcription levels of MICA and MICB were enhanced after treatment with 0.5, 1 μmol/L entinostat for 48 h. The soluble MICA level in A549 cell culture supernatant was increased by 1 μmol/L entinostat. The sensitivity of HCC-827 cells to NK cells was enhanced upon treatment with 0.5, 1 μmol/L entinostat.Conclusions entinostat enhanced the killing effect of NK cells on non-small cell lung cancer cells by up-regulating the expression of NKG2D ligands. This provides a new method and theory for the treatment of NSCLC.-
Keywords:
- entinostat /
- non-small cell lung cancer (NSCLC) /
- NKG2D ligands /
- NK cell
-
肺癌是最常见的恶性肿瘤,中国国家癌症中心发布的数据显示,肺癌发病率(0.57‰)和死亡率(0.46‰)均居国内恶性肿瘤首位[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌患者的80%~85%,多数患者确诊时已发展至晚期,5年生存率不足15% [3-4]。
组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类对染色体结构修饰、基因表达调控具有重要作用的蛋白酶,其异常活动与肿瘤发生有关[5-6]。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACi)能够抑制HDAC的活性,抑制癌细胞增殖,促进凋亡[7]。Rohner等[8]和Kato等[9]研究表明HDACi(Trichostatin A)能够上调急性髓细胞白血病和急性淋巴细胞白血病中NKG2D(natural-killer group 2,member D)配体的表达,进而增强了白血病细胞对表达NKG2D的免疫细胞介导的杀伤敏感性。目前,已有多种HDACi被美国食品及药物管理局(FDA)批准上市或正在进行抗肿瘤的临床试验,其中Entinostat对NSCLC的治疗正在进行临床Ⅱ期研究[10]。Entinostat可强烈抑制HDAC1和HDAC3的活性,并能显著抑制NSCLC、肝癌和乳腺癌等细胞的增殖,同时上调主要组织相容性复合物(major histocompatibility complex,MHC)Ⅰ类和Ⅱ类分子的表达[11-14]。本实验拟研究Entinostat对NSCLC细胞A549和HCC-827细胞表面NKG2D配体表达的影响,以及配体表达的变化是否会影响肿瘤细胞对免疫细胞杀伤作用的敏感性,进而为Entinostat治疗NSCLC提供新的理论依据。
1. 材料与方法
1.1 材料
1.1.1 细胞和外周静脉血标本
NSCLC细胞HCC- 827购自中国科学院典型培养物保藏委员会细胞库,A549为本实验室保存。用于NK细胞制备的外周静脉血采自签署知情同意书的健康志愿者,研究得到本院伦理委员会的审查和批准。
1.1.2 试剂和耗材
荧光素标记的抗体(MICA-PE、MICB-APC、ULBP2/5/6-PE)、相应同型对照抗体购自美国BD公司。Entinostat购自美国Selleck公司。噻唑蓝(MTT)购自爱必信(上海)生物科技有限公司、DMSO购自美国Sigma公司。人MICA酶联免疫吸附实验试剂盒购自美国Abcam公司。RNeasy总RNA纯化mini试剂盒、Quanti Tect®反转录试剂盒、Quanti NovaTMSYBR®Green染料法PCR试剂盒均购自德国QIAGEN公司。CytoTox® 96非放射性细胞毒性检测试剂盒购自美国Promega公司。DMEM/F-12培养基和RPMI 1640培养基购自上海源培生物科技股份有限公司。
1.2 方法
1.2.1 细胞培养
A549和HCC-827细胞分别用含10%胎牛血清的DMEM/F-12培养基和10%胎牛血清的RPMI 1640培养基,于37℃、5%CO2饱和湿度的培养箱中培养。细胞处于80%融合时进行传代,取对数生长期细胞用于实验。
1.2.2 NK细胞制备
采取健康成年人外周静脉血10 mL,Ficoll离心分离,制备外周血单个核细胞(PBMCs),计数后参照文献方法培养NK细胞[15]。培养14 d后检测NK细胞表型,并收集NK细胞用于杀伤实验。
1.2.3 MTT法检测细胞增殖
取对数生长期的细胞以4×103个/孔的密度接种于96孔板,贴壁后,以不同浓度Entinostat处理A549和HCC-827细胞24、48、72 h。然后向每孔中加入10%体积的MTT(5 mg/mL),避光孵育4 h,弃掉上层培养基后,每孔加100 μL DMSO,避光低速震荡10 min,用酶标仪检测492 nm波长处的吸光值(OD值),计算Entinostat对细胞增殖的抑制率及IC50。根据下列公式计算细胞生长抑制率:
细胞生长抑制率(%)= [1-(实验组OD值-调零组OD值)(/对照组OD值-调零组OD值)] ×100%
1.2.4 流式细胞术检测细胞表面配体表达
收集0.25、0.5、1 μmol/L Entinostat处理48 h后的细胞,取2×105个细胞分别加入抗MICA抗体、抗MICB抗体、抗ULBP-2/5/6抗体及相应同型对照抗体,避光孵育30 min,PBS洗涤两次后使用美国BD公司的FACS Canto®Ⅱ流式细胞仪进行检测。
1.2.5 ELISA检测可溶性MICA(soluble MICA,sMICA)水平
收集0.25、0.5、1 μmol/L Entinostat处理48 h后的细胞培养基,3 000 r/min,离心10 min,留取上清,按ELISA试剂盒说明书进行操作。
1.2.6 RT-PCR检测基因表达
收集0.25、0.5、1 μmol/L Entinostat处理48 h后的细胞,取2×106个细胞,使用RNeasy总RNA纯化mini试剂盒提取RNA,使用Quanti Tect®Reverse Transcription Kit将RNA反转录成cDNA,以GAPDH作为内参,使用Quanti NovaTMSYBR®Green染料法PCR试剂盒对样本进行染色,具体操作步骤按上述试剂盒说明书进行。使用引物序列如下:
MICA- For 5'- AAGACCAAGACACTCTATCACG C-3';MICA-Rev 5'-GGTGTCGTGGCTCAAAGATAC- 3';MICB-For 5'-CTGATGGGAATGGAACCTACC-3';MICB-Rev 5'-GTCTGTCCGTTGACTCTGAAGC-3'
1.2.7 细胞毒性检测
以0.25、0.5、1 μmol/L Entinostat处理48 h的A549和HCC-827细胞作为靶细胞,NK细胞作为效应细胞,效靶细胞比(effector-to-target,E:T)为20:1,采用乳酸脱氢酶释放实验检测NK细胞对A549和HCC-827细胞的杀伤率,操作步骤按CytoTox®96非放射性细胞毒性检测试剂盒使用说明书进行。根据下列公式计算细胞毒性百分率。
细胞毒性百分率=(A实验孔-A靶细胞自然释放孔-A效应细胞自然释放孔)(/ A靶细胞最大释放孔- A靶细胞自然释放孔)×100%。
1.3 统计学分析
采用SPSS 20.0软件进行统计分学析。每组实验独立重复3次,计量资料以x±s表示,不同数据组间的比较采用单因素方差分析检验,P < 0.05为差异具有统计学意义。
2. 结果
2.1 Entinostat对A549和HCC-827细胞的增殖抑制作用
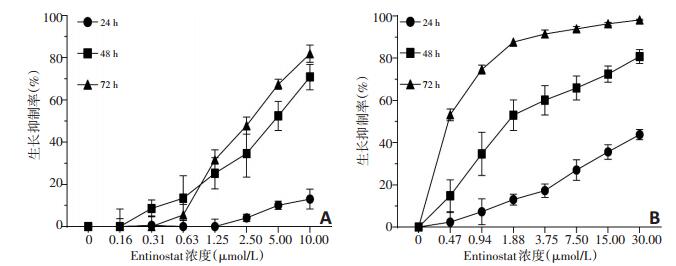
不同浓度的Entinostat处理细胞24、48、72 h后,药物能够抑制细胞增殖,且具有时间-剂量依赖性(图 1)。Entinostat处理A549细胞24、48、72h的IC50分别为(40.78± 2.08)μmol/L、(4.38±0.40)μmol/L和(2.74±0.11)μmol/L;处理HCC-827细胞24、48、72 h的IC50分别为(39.79±4.01)μmol/L、(2.40±0.25)μmol/L和(0.4±0.03)μmol/L。故此后续实验采用 < 2 μmol/L(即0.25、0.5、1 μmol/L)Entinostat及48 h作为实验浓度和处理时间。
2.2 Entinostat对A549和HCC-827细胞表面NKG2D配体表达的影响
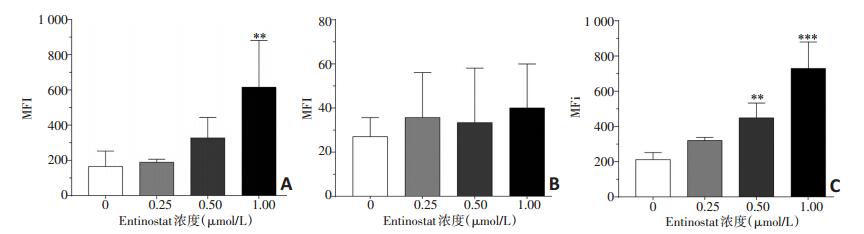
以0.25、0.5、1 μmol/L Entinostat分别处理A549和HCC-827细胞48 h,流式细胞术检测细胞表面NKG2D配体的表达。A549细胞1 μmol/L Entinostat处理组MICA的平均荧光强度(mean fluoyescence intensity,MFI)值为(615.67±265.68),与对照组MFI值(165.67±87.8)相比差异具有统计学意义(P < 0.05);0.5、1 μmol/L Entinostat处理组ULBP-2/5/6的MFI值分别为(448.67±17.62)和(729.67±149.60),与对照组MFI值(212.33 ± 40.01)相比差异具有显著性(P < 0.05);但各Entinostat处理组MICB的MFI值与对照组相比差异无统计学意义(P>0.05,图 2)。
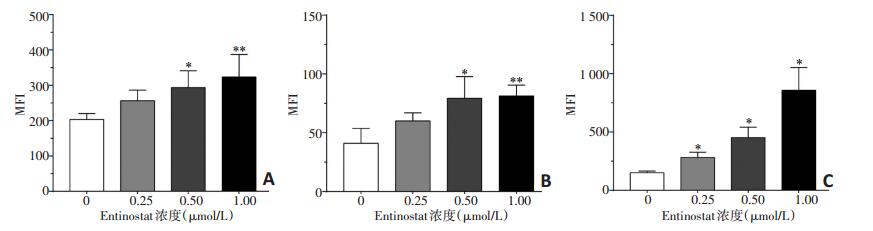
HCC-827细胞,0.5、1 μmol/L Entinostat处理组MICA的MFI值分别为(293.67±47.52)和(323.67±63.52),与对照组MFI值(203.33±16.86)相比差异具有统计学意义(P < 0.05);0.5、1 μmol/L Entinostat处理组MICB的MFI值分别为(79.33±18.48)和(81.33±9.24),与对照组MFI值(41.00±12.73)相比差异具有统计学意义(P < 0.05);0.25、0.5、1 μmol/L Entinostat处理组ULBP-2/5/6的MFI值分别为(282.00±44.81)、(452.00±90.10)和(857.50± 196.23),与对照组MFI值(150.50±15.29)相比,差异均具有统计学意义(P < 0.05,图 3)。
2.3 Entinostat对A549和HCC-827细胞培养上清中sMICA水平的影响
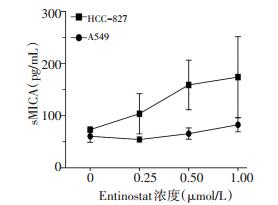
肿瘤细胞表面配体MICA可能脱落形成sMICA,sMICA的表达可能是肿瘤细胞发生免疫逃逸的原因之一[16-17]。因此,本研究又检测了细胞培养上清中sMICA的水平。结果发现,1 μmol/L Entinostat处理A549细胞48 h后,sMICA的水平为(82.54±13.34)pg/mL,与对照组(60.57±11.66)pg/mL相比,1 μmol/L Entinostat能显著上调A549细胞培养上清中sMICA的水平(P < 0.05)。但是Entinostat对HCC-827细胞培养上清中sMICA水平的影响并不显著(P>0.05,图 4)。
2.4 Entinostat对A549和HCC-827细胞NKG2D配体基因表达的影响
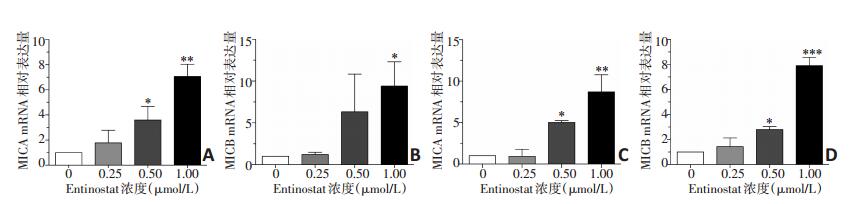
RT-PCR结果显示,0.5、1 μmol/L Entinostat能显著上调A549细胞MICA基因表达水平,分别是对照组的(5.04±0.22)倍和(8.72±2.06)倍;1 μmol/L Entinostat能显著上调MICB基因表达水平,是对照组的(7.90±0.66)倍。0.5、1 μmol/L Entinostat能显著上调HCC-827细胞MICA基因表达水平,分别是对照组的(3.60±1.08)倍和(7.06±0.98)倍;MICB基因表达水平分别是对照组的(6.33±4.50)倍和(9.40±2.90)倍(图 5)。
2.5 Entinostat诱导A549和HCC-827细胞表面配体上调对NK细胞杀伤敏感性的影响
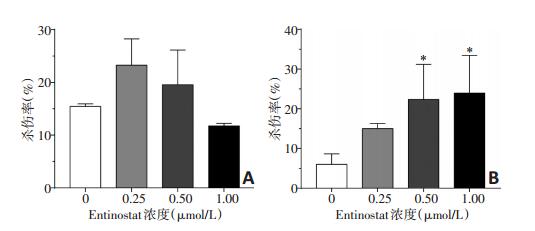
通过研究发现,Entinostat能诱导A549和HCC-827细胞表面活化性配体MICA、MICB和ULBP-2/5/6表达的上调,为了检测配体的上调是否影响NK细胞的杀伤活性,本研究以0.25、0.5、1 μmol/L Entinostat处理48h的A549和HCC-827细胞作为靶细胞,NK细胞作为效应细胞,效靶细胞比为20:1,进行了乳酸脱氢酶释放实验。结果发现,NK细胞对0.25、0.5、1 μmol/L Entinostat处理组A549细胞的杀伤率分别为(23.25±5.02)%、(19.55± 6.58)%和(11.75±0.5)%,与对照组(15.45±0.49)%相比均无显著性差异(P>0.05)。NK细胞对0.25、0.5、1 μmol/ L Entinostat处理组HCC-827细胞的杀伤率分别为(15.00±1.27)%、(22.35±8.84)%和(25.90±12.59)%,与对照组(7.35±1.77)%相比,0.5、1 μmol/L Entinostat能显著提高HCC-827对NK细胞杀伤作用的敏感性(P < 0.05,图 6)。
3. 讨论
全球范围内,NSCLC的发病率和死亡率均占恶性肿瘤的首位[1],多数患者发现时已经发展为晚期,手术切除已不是最佳的治疗方案,而化疗的毒性反应较多,严重影响患者的生存质量,因此,靶向药物的出现为患者带来曙光。根据美国临床试验数据库数据显示,目前有多项Entinostat治疗NSCLC的临床试验正在开展。
研究表明Entinostat能够上调骨肉瘤NKG2D配体的表达,增强免疫细胞对肿瘤细胞的杀伤作用[5]。还有研究者在白血病细胞上也得到了类似的结果[8-9]。本研究中,根据MTT检测结果,采用0.25,0.5、1μmol/L的Entinostat诱导A549和HCC-827细胞48h。流式细胞术和RT-PCR结果显示,1μmol/L的Entinostat能够显著上调A549细胞表面NKG2D配体(MICA和ULBP-2/5/6)的表达,提高MICA和MICB基因的表达水平。0.5、1μmol/L的Entinostat能显著上调HCC-827细胞表面NKG2D配体(MICA、MICB和ULBP-2/5/6)的表达,并提高MICA和MICB基因的表达水平。MICA、MICB和ULBP-2/5/6属于活化性配体,能够与NK细胞表面相应的受体结合,激活免疫细胞,杀伤肿瘤细胞[18-20]。NKG2D受体和配体相互作用所介导的免疫细胞杀伤作用被认为在抗肿瘤活动中具有重要作用[21]。因此,采用乳酸脱氢酶释放实验检测了不同浓度Entinostat诱导A549和HCC- 827细胞48h后,NK细胞对其的杀伤作用。结果发现0.5、1μmol/L的Entinostat显著提高了NK细胞对HCC-827细胞的杀伤作用,而Entinostat未提高NK细胞对A549细胞的杀伤作用。有研究表明,MIC分子的脱落是肿瘤细胞免疫逃逸的机制,MICA/B分子的脱落可能诱导了抗肿瘤免疫效应细胞功能的下调[22-24]。MICA/B可以被去整合素-金属蛋白酶(a disintegrin and metalloproteinase,ADAM)切割,sMICA能够诱导CD8+T细胞和NK细胞上NKG2D受体的内在化和溶酶体降解,从而下调抗肿瘤免疫细胞的功能[25]。已有研究证实HDAC抑制剂丙戊酸(Valproic acid)能下调参与产生sMICA/B的基质金属蛋白酶(matrix metalloproteinases,MMPs)的活性[26]。本研究结果显示,1μmol/L的Entinostat上调了A549细胞培养上清中sMICA含量,推测这可能是Entinostat未能提高NK细胞对A549细胞杀伤作用的原因。由于NK细胞的杀伤功能受多种活化性和抑制性受体-配体信号的动态调节,而本研究只检测了NKG2D活化性配体,可能还有其他活化性或抑制性受体配体的表达受到调节,这也可能是造成A549细胞对NK细胞杀伤作用不敏感的原因,具体机制还有待进一步研究。
如何上调活化性配体的表达,并抑制活化性配体的脱落,抑制肿瘤免疫逃逸是一个研究焦点。本研究中,Entinostat上调了HCC-827细胞表面NKG2D配体的表达,并提高了NK细胞对HCC-827细胞的杀伤作用,虽然未增强A549细胞对NK细胞杀伤作用的敏感性,但这也为Entinostat治疗NSCLC提供了新的理论依据。
-
-
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. DOI: 10.3322/caac.v68.6
[2] 陈万青, 孙可欣, 郑荣寿, 等.2014年中国分地区恶性肿瘤发病和死亡分析[J].中国肿瘤, 2018, 27(1):1-14. http://d.old.wanfangdata.com.cn/Periodical/zgzl201801001 [3] 张杰, 刘索, 甘毅, 等.非小细胞肺癌中lncRNA DLEU1的表达对肿瘤细胞转移的影响[J].中国肿瘤临床, 2018, 45(23):1181-1186. DOI: 10.3969/j.issn.1000-8179.2018.23.013 [4] 李伟, 刘文斌, 刘海丹.白藜芦醇靶向EGFR和c-Met信号通路抑制非小细胞肺癌细胞增殖的机制[J].肿瘤防治研究, 2017, 44(1):11- 16. DOI: 10.3971/j.issn.1000-8578.2017.01.003 [5] Zhu S, Denman CJ, Cobanoglu ZS, et al. The narrow-spectrum hdac inhibitor entinostat enhances NKG2D expression without NK cell toxicity, leading to enhanced recognition of cancer cells[J]. Pharmaceutical Research, 2015, 32(3):779-792. DOI: 10.1007/s11095-013-1231-0
[6] Chatterji BP, Souza CD. HDAC Inhibitors as novel anti-cancer therapeutics[J]. Recent Pat Anticancer Drug Discov, 2015, 10(2):145-162. DOI: 10.2174/1574892810666150317144511
[7] 黄维, 黄蓝, 夏百荣, 等.组蛋白去乙酰化酶抑制剂在卵巢癌中的研究进展[J].肿瘤学杂志, 2018, 24(7):717-721. http://d.old.wanfangdata.com.cn/Periodical/zlxzz201807014 [8] Rohner A, Langenkamp U, Siegler U, et al. Differentiation-promoting drugs up- regulate NKG2D ligand expression and enhance the susceptibility of acute myeloid leukemia cells to natural killer cellmediated lysis[J]. Leukemia Research, 2007, 31(10):1393-1402. DOI: 10.1016/j.leukres.2007.02.020
[9] Kato N, Tanaka J, Sugita J, et al. Regulation of the expression of MHC class I-related chain A, B (MICA, MICB) via chromatin remodeling and its impact on the susceptibility of leukemic cells to the cytotoxicity of NKG2D-expressing cells[J]. Leukemia (Basingstoke), 2007, 21(10):2103- 2108. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=c984159c170641ceea26a9adf448144e
[10] Yoon S, Eom GH. HDAC and HDAC inhibitor: from cancer to cardiovascular diseases[J]. Chonnam Med J, 2016, 52(1):1-11. DOI: 10.4068/cmj.2016.52.1.1
[11] Ruiz R, Raez LE, Rolfo C. Entinostat (SNDX-275) for the treatment of nonsmall cell lung cancer[J]. Expert Opin Investig Drugs, 2015, 24(8):1101- 1109. DOI: 10.1517/13543784.2015.1056779
[12] McCaw TR, Randall TD, Arend RC. Revisiting entinostat as an immunepotentiating adjuvant[J]. Oncotarget, 2018, 9(99):37278-37279.
[13] Connolly RM, Rudek MA, Piekarz R. Entinostat: a promising treatment option for patients with advanced breast cancer[J]. Future Oncol, 2017, 13(13):1137-1148. DOI: 10.2217/fon-2016-0526
[14] Rinaldi L, Folliero V, Palomba L, et al. Sonoporation by microbubbles as gene therapy approach against liver cancer[J]. Oncotarget, 2018, 9(63):32182-32190.
[15] 陈伟, 杨冀, 于卉影, 等.IL-15与IL-21细胞因子组合优化临床级人NK细胞培养体系[J].临床军医杂志, 2017, 45(1):64-68. http://d.old.wanfangdata.com.cn/Periodical/lincjyzz201701018 [16] 陈钢, 王春利, 郭石平, 等.肺癌患者血清中可溶性MICA(sMICA)表达及临床意义[J].临床医药实践, 2009, 18(2):118-120. DOI: 10.3969/j.issn.1671-8631.2009.02.017 [17] 赵欣, Acheampong DO, 张娟, 等.MICA脱落与肿瘤免疫逃逸:肿瘤免疫治疗新靶标和新策略[J].药学进展, 2014, 38(12):905-909. http://www.cnki.com.cn/Article/CJFDTOTAL-YXJZ201412008.htm [18] LópezSoto A, Huergozapico L, Acebeshuerta A, et al. NKG2D signaling in cancer immunosurveillance[J]. Int J Cancer, 2015, 136(8):1741-1750. DOI: 10.1002/ijc.28775
[19] Sheppard S, Ferry A, Guerra N, et al. The paradoxical role of NKG2D in cancer immunity[J]. Front Immunol, 2018, 9:1808. DOI: 10.3389/fimmu.2018.01808
[20] Sauer M, Schuldner M, Hoffmann N, et al. CBP/p300 acetyltransferases regulate the expression of NKG2D ligands on tumor cells[J]. Oncogene, 2016, 36(7):933-941. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=5319c5db803d3f7f64c67b88a7854c76
[21] Schmiedel D, Mandelboim O. NKG2D ligands-critical targets for cancer immune escape and therapy[J]. Front Immunol, 2018, 9:2040. DOI: 10.3389/fimmu.2018.02040
[22] Salih HR, Rammensee HG, Steinle A. Cutting edge: down-regulation of MICA on human tumors by proteolytic shedding[J]. J Immunol, 2002, 169(8):4098-4102. DOI: 10.4049/jimmunol.169.8.4098
[23] Duan S, Guo W, Xu Z, et al. Natural killer group 2D receptor and its ligands in cancer immune escape[J]. Molecular Cancer, 2019, 18(1):29. DOI: 10.1186/s12943-019-0956-8
[24] Onyeaghala G, Nelson HH, Thyagarajan B, et al. Soluble MICA is elevated in pancreatic cancer: Results from a population based case-control study[J]. Molecular Carcinogenesis, 2017, 56(9):2158-2164. DOI: 10.1002/mc.v56.9
[25] Jinushi M, Takehara T, Tatsumi T, et al. Impairment of natural killer cell and dendritic cell functions by the soluble form of MHC class I-related chain A in advanced human hepatocellular carcinomas[J]. J Hepatol, 2005, 43(6):1013-1020. DOI: 10.1016/j.jhep.2005.05.026
[26] Miyashita T, Miki K, Kamigaki T, et al. Low-dose valproic acid with lowdose gemcitabine augments MHC class I-related chain A/B expression without inducing the release of soluble MHC class I-related chain A/ B[J]. Oncology Letters, 2017, 14(5):5918-5926.
-
期刊类型引用(1)
1. 郝琳,康娟,宋英. GOLPH3与非小细胞肺癌上皮间质转化的相关性研究. 实用癌症杂志. 2022(11): 1805-1808 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: