Change of peripheral blood sPD- L1 during chemotherapy in patients with small cell lung cancer and its clinical significance
-
摘要:目的 肿瘤微环境中,免疫相关机制使程序性死亡分子配体1(programmed death ligand 1,PD-L1)表达上调,从而异常激活PD-L1信号通路,介导肿瘤免疫逃逸。可溶性程序性死亡配体1(soluble programmed death ligand 1,sPD-L1)是PD-L1的一种存在形式。有研究证实sPD-L1在肺鳞癌及腺癌中的表达与疾病进展相关,而小细胞肺癌(small cell lung cancer,SCLC)恶性程度高侵袭性强,相关研究较少。本研究旨在观察sPD-L1在SCLC患者血浆中的表达变化及临床意义。方法 筛选2018年3月至2018年11月山西省肿瘤医院经病理学检查诊断为SCLC的初治患者94例作为试验组,选取同期健康体检者17例作为对照组,比较两组血浆sPD-L1的动态变化,并分析sPD-L1表达与TNM分期、远处转移以及胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP)的相关性。结果 SCLC组血浆sPD-L1水平高于健康人组(P < 0.05和P < 0.01)。疾病缓解期的SCLC患者化疗后血浆sPD-L1水平比化疗前显著降低(P < 0.01);疾病进展期患者化疗后血浆sPD-L1水平比化疗前显著升高(P < 0.01)。SCLC患者sPD-L1异常高表达与疾病进展显著相关(P < 0.05)。血浆sPD-L1表达与肿瘤标志物ProGRP呈正相关。结论 SCLC患者外周血浆sPD-L1的表达较健康人增高,且与疗效密切相关。
-
关键词:
- 小细胞肺癌 /
- 可溶性程序性死亡配体1 /
- PD-L1表达
Abstract:Objective In tumor microenvironment, immune-related mechanisms up-regulate the expression of programmed death ligand 1 (PD-L1), which abnormally activates PD-L1 signaling pathway and mediates tumor immune escape. Soluble programmed death ligand 1 (sPD-L1) is a form of PD-L1. It has been confirmed that the expression of sPD-L1 in lung squamous cell carcinoma and adenocarcinoma is related to disease progression, while small cell lung cancer (SCLC) has a high degree of malignancy, strong invasiveness and few related studies. The purpose of this study was to observe the changes in expression of sPD-L1 in the plasma of SCLC patients and their clinical significance.Methods A total of 94 patients with SCLC diagnosed by pathological examination in Shanxi Provincial Cancer Hospital from March 2018 to November 2018 were selected as test group, and 17 healthy persons in the same period were selected as control group. The dynamic changes of plasma sPD-L1 were compared between the two groups, and the correlations among the expression of sPD-L1 and TNM stage, distant metastasis, and pro-gastrin-releasing peptide (ProGRP) was analyzed.Results The level of sPD-L1 in the test group was higher than that in the control group (P < 0.05 and P < 0.01, respectively). In patients with SCLC in the remission stage, the serum sPD-L1 level after chemotherapy was significantly lower than that before chemotherapy (P < 0.01); in patients with advanced stage, the serum sPD-L1 level after chemotherapy was significantly higher than that before chemotherapy (P < 0.01). The abnormal high expression of sPD-L1 in SCLC patients was significantly correlated with the progression of the disease (P < 0.05). The expression of sPD-L1 in serum was positively correlated with the tumor marker ProGRP.Conclusions The expression of sPDL1 in peripheral plasma of patients with SCLC is higher than that in healthy individuals and is closely related to the clinical effect. -
肺癌是人类最常见的导致死亡的癌症之一[1],其中小细胞肺癌(small cell lung cancer,SCLC)约占肺癌总数的15%[2]。SCLC患者目前主要的治疗方案为全身化疗[3]。有研究表明程序性死亡受体1(programmed death 1,PD-1)及其配体程序性死亡配体1(programmed death ligand 1,PD-L1)在肿瘤组织中表达异位上调[4]。该通路能减弱T细胞的活化并抑制抗肿瘤免疫应答[5]。因此,PD-1/PD-L1通路作为新的免疫治疗靶点,其抑制剂已经被用于治疗多种肿瘤包括SCLC。有研究发现[6],可溶性程序性死亡配体1(soluble programmed death ligand 1,sPD-L1)在化疗前后肺癌患者外周血变化与疾病进展相关,但此项研究仅包括鳞癌、腺癌患者,sPD-L1在SCLC患者中的变化尚未得到充分研究。本研究旨在评价sPD-L1在SCLC患者表达水平,分析其在不同疗效中的变化趋势、以及与肿瘤标志物胃泌素释放肽前体(pro gastrin releasing peptide,ProGRP)相关性。
1. 材料与方法
1.1 病例资料
筛选2018年3月至2018年11月山西省肿瘤医院经病理学检查诊断为SCLC的初治患者94例作为试验组,其中男性72例、女性22例,年龄(28~82)岁;选取健康体检者17例作为对照组,其中男性10例、女性7例,年龄(26~83)岁。两组性别及年龄差异均无统计学意义(P > 0.05)。所选患者有完整的病历资料,包括性别、年龄、吸烟状况、病理类型、肿瘤TNM分期和远处转移等情况。通过94例SCLC患者治疗前、后动态监测血浆sPD-L1水平,观察其与疗效的相关性;检测17例健康体检者sPD-L1水平。
1.2 方法
1.2.1 化疗方案
肺癌患者使用化疗方案:顺铂+依托泊甙(EP)、卡铂+依托泊甙(CE)全身化疗4个周期,化疗期间采外周血3 mL/次,在30 min内将外周血2 000 r/min离心10 min,取初上清液并在-70℃下保存备用。
1.2.2 检测指标
利用细胞程序性死亡蛋白1配体1(PDCD1LG1)酶联免疫吸附试验检测,试剂盒购自武汉优尔生云克隆科技股份有限公司。按试剂盒说明书操作,酶标仪测定OD450。sPD-L1Ig浓度为横坐标,吸光值为纵坐标,绘制标准曲线。
1.2.3 疗效评价
按照2009年版实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)评价非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的疗效,分为疾病进展(progressive disease,PD)组、部分缓解(partial response,PR)组和疾病稳定(stable disease,SD)组,分析患者治疗前后sPD-L1水平与临床疗效的相关性。
1.2.4 受试者工作特征曲线(receiver operating characteristic curve,ROC)分析
可溶性程序性死亡配体1(sPD-L1)以特异性为横坐标,敏感性为纵坐标作ROC曲线,观察sPD-L1曲线下面积。
1.3 统计学分析
采用R3.4.3软件进行统计学分析。计量资料以x±s 表示,进行Wilcoxon Signed Rank Test检验;计数资料用率表示,采用χ2检验。以P < 0.05为差异具有统计学意义。
2. 结果
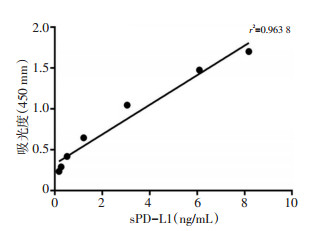
2.1 sPD-L1标准曲线
sPD-L1浓度与OD450值之间的线性关系(r2 = 0.96,图 1)。
2.2 sPD-L1测定结果
试验组外周血sPD-L1水平为(1.59±1.02)ng/mL,对照组为(0.67±0.21)ng/mL;试验组外周血sPD-L1水平高于对照组(P < 0.01,图 2)。
2.3 治疗过程中外周血中sPD-L1水平的变化
SCLC患者接受全身化疗,比较PR组、PD组和SD组化疗过程中sPD-L1水平变化。PR组和PD组化疗前后sPD-L1含量的均值差异显著,具有统计学意义(均P < 0.01,表 1)。SD组化疗前后sPD-L1含量无显著性差异(表 1)。
表 1 SCLC患者化疗过程中外周血中sPD-L1水平的变化
2.4 治疗前后外周血中ProGRP水平的变化
SCLC患者接受全身化疗,比较PR组、PD组和SD组化疗过程中ProGRP水平变化。PR组和PD组化疗前后ProGRP含量的均值差异具有统计学意义(均P < 0.01,表 2);SD组化疗前后ProGRP含量无显著性差异。
表 2 SCLC患者化疗前后外周血中ProGRP水平的变化
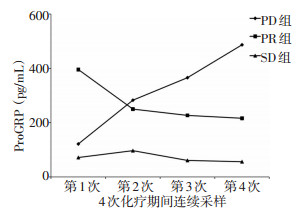
2.5 SCLC患者治疗期间sPD-L1变化趋势
PR组患者sPD-L1动态变化呈下降趋势;PD组患者sPD-L1动态变化呈上升趋势;SD组患者sPD-L1动态变化较平稳(图 3)。
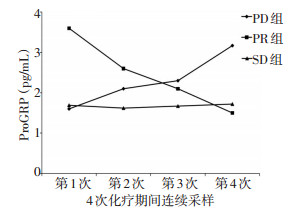
2.6 小细胞肺癌患者治疗期间ProGRP变化趋势
PR组患者ProGRP动态变化呈现下降趋势;PD组患者ProGRP动态变化呈上升趋势;SD组患者ProGRP动态变化较平稳(图 4)。
2.7 相关性分析
sPD-L1与SCLC患者临床特征的相关性分析,根据本研究结果中SCLC患者的中位sPD-L1水平,将其分为sPD-L1高表达组(≥2.14 ng/mL)及低表达组(< 2.14 ng/mL)。SCLC患者sPD-L1表达与性别、年龄、吸烟史、肿瘤分期、淋巴结转移、肝脏或脑转移差异无统计学意义(均P > 0.05,表 3)。
表 3 sPD-L1与SCLC患者临床特征的相关性
2.8 临床评价
以SCLC患者和健康对照组sPD-L1水平进行ROC曲线分析。以特异性为横坐标,敏感性为纵坐标作ROC曲线。ROC曲线下的面积为sPD-L1:0.94(95%CI:0.89~0.99,P < 0.01);按照最佳临界点选择的原则,sPD-L1为1.36 ng/mL时,为最佳临界点,此时sPD-L1的灵敏度为95.0%,特异性为79.62%,阳性似然比为4.66。
3. 讨论
免疫治疗目前已成为治疗肿瘤除手术、化疗、放疗以及靶向治疗之外的重要手段。SCLC具有恶性程度高、侵袭性强和易转移等特点,主要治疗方法为放化疗。PD-1/PD-L1通路阻滞抑制剂联合化疗在临床研究中取得了显著的疗效[7-8],其潜在增效机制尚在探讨,其也成为近20年来SCLC治疗新的突破点。体内免疫系统中PD-L1以两种形式存在,细胞膜型(mPD-L1)和sPD-L1。有研究发现[9],PD-L1表达阳性的细胞系上清中可以检测到高浓度的sPD-L1,而且sPD-L1的含量与mPD-L1的表达强度有关,由此推测sPD-L1是mPD-L1剪切形成的,并且两者的生物学功能相似[10],且都可以与T细胞表面PD-1受体结合,导致T细胞失活,负向调控免疫系统[11]。
本研究发现,试验组sPD-L1水平显著高于对照组,提示sPD-L1在SCLC患者中高表达。比较患者化疗期间sPD-L1的动态变化,PR组患者sPD-L1水平呈下降趋势,PD患者sPD-L1水平呈上升趋势,SD组患者sPD-L1水平波动幅度相对较小。导致趋势不同的原因可能是患者体内sPD-L1表达水平与对T细胞的抑制作用成正比,抑制后失活的T细胞无法清除肿瘤细胞,使其逃避免疫监视从而更容易的进行组织浸润,远处转移。有研究提示[12],sPD-L1的表达与肿瘤的分期、淋巴结的转移、腹部的脏器转移等因素密切相关。而本研究中分析试验组sPD-L1表达与性别、年龄、吸烟史、肿瘤分期、淋巴结转移、肝脏或脑转移差异均无统计学意义(均P > 0.05)。血浆sPD-L1在SCLC患者中高表达,但具体的人群特征尚不明确,需要进一步的大样本及分层因素更加均衡样本加以验证。
依据本研究结果,在sPD-L1为1.36 ng/mL时,可能为最佳临界点,提示血浆sPD-L1在反映SCLC肿瘤负荷方面有较高的特异性和灵敏度。有研究显示[13],sPDL1浓度升高可作为SCLC化疗患者预后不良的潜在指标。ProGRP对于SCLC患者的预后判断有较高价值[14],本研究对比了sPD-L1和ProGRP在SCLC患者病情进展,部分缓解和稳定期间的变化幅度基本一致。提示sPD-L1在评估SCLC肿瘤负荷方面的作用和肿瘤标志物ProGRP接近。
SCLC治疗方法近20年来无新突破,主要治疗方法为放化疗。PD-1/PD-L1通路阻滞抑制剂有望成为新的突破点,其中nivolumab的CheckMate 032研究[15],pembrolizumab的KEYNOTE 158研究[16],以及atezolizumab的IMpower 133研究[17]均在SCLC治疗方面取得重大进展。相关研究发现[18],在NSCLC中组织PD-L1肿瘤细胞阳性比例分数(tumor proportion score,TPS)水平更高的患者客观缓解率和无进展生存期获益更为显著,而且总生存期呈获益趋势。有研究提示[19],96例SCLC患者中PD-L1 TPS表达 < 1%的例数占83.9%,≥50%的例数占1.1%。
在SCLC免疫治疗CheckMate 032研究[15]中组织PD-L1 TPS表达与肿瘤反应无显著相关性,而在KEYNOTE 028研究[20]以及KEYNOTE 158研究中组织PD-L1阳性联合分数(combined positive score,CPS)表达较高的SCLC患者免疫治疗获益更大。CPS不局限于TPS仅计数肿瘤细胞PD-L1表达,包括淋巴细胞、巨噬细胞等免疫细胞以及间质细胞等PD-L1表达,说明SCLC对于细胞PD-L1表达总量的水平可能更加敏感。然而组织样本检测,存在临床预测效果不一致、无法兼顾肿瘤的异质性、治疗等干预因素的影响、检测可重复性差以及难以同时检测肿瘤细胞和肿瘤浸润免疫细胞的表达量等因素。组织中PD-L1免疫组织化学法检测难以成为精准选择免疫治疗获益人群最好的可动态观察的预测性指标。相对于组织标本,血浆检测可在一定程度上均质肿瘤的异质性,更客观地反映肿瘤的实际情况,且在临床中取材相对简便,能够动态连续观察指标的变化。随着PD-1/PD-L1通路阻滞抑制在临床上的广泛应用,筛选准确且便于观察的生物标志物的需求也更加迫切,sPD-L1潜在的应用价值逐渐被关注。
-
表 1 SCLC患者化疗过程中外周血中sPD-L1水平的变化

表 2 SCLC患者化疗前后外周血中ProGRP水平的变化

表 3 sPD-L1与SCLC患者临床特征的相关性

-
[1] Didkowska J, Wojciechowska U, Manczuk M, et al. Lung cancer epidemiology: contemporary and future challenges worldwide[J]. Ann Transl Med, 2016, 4(8):150. DOI: 10.21037/atm
[2] Temraz S, Charafeddine M, Mukherji D, et al. Trends in lung cancer incidence in Lebanon by gender and histological type over the period 2005-2008[J]. J Epidemiol Glob Health, 2017, 7(3):161-167. DOI: 10.1016/j.jegh.2017.04.003
[3] Hann CL, Rudin CM. Management of small-cell lung cancer: incremental changes but hope for the future. Oncology (Williston Park) [J]. Oncology (Williston Park), 2008, 22(13):1486-1492. http://cn.bing.com/academic/profile?id=fbe5813bb0e66058c45e47ae5bd2221a&encoded=0&v=paper_preview&mkt=zh-cn
[4] Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients [J]. Nature, 2014, 515(7528):563-567. DOI: 10.1038/nature14011
[5] Gatalica Z, Snyder C, Maney T, et al. Programmed cell death 1 (PD- 1) and its ligand (PD-L1) in common cancers and their correlation with molecular cancer type[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(12):2965-2970. DOI: 10.1158/1055-9965.EPI-14-0654
[6] 王晓景, 施敏骅, 陈永井.肺癌患者化疗前后外周血sPD-L1变化及其临床意义[J].江苏医药, 2013, 39(6):654-657. http://d.old.wanfangdata.com.cn/Periodical/jsyy201306011 [7] Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non- squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study[J]. Lancet Oncol, 2016, 17(11): 1497-1508. DOI: 10.1016/S1470-2045(16)30498-3
[8] Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J]. N Engl J Med, 2018, 378(22):2078-2092. DOI: 10.1056/NEJMoa1801005
[9] Chen Y, Wang Q, Shi B, et al. Development of a sandwich ELISA for evaluating soluble PD-L1 (CD274) in human sera of different ages as well as supernatants of PD-L1+ cell lines[J]. Cytokine, 2011, 56 (2):231-238. DOI: 10.1016/j.cyto.2011.06.004
[10] 施敏骅, 邢玉斐, 张增利, 等.肺癌细胞中可溶性程序性死亡配体1的表达及其对T淋巴细胞功能的影响[J].中华肿瘤杂志, 2013, 35 (2):85-88. DOI: 10.3760/cma.j.issn.0253-3766.2013.02.002 [11] Li Y, Xiao Y, Su M, et al. Role of soluble programmed death-1 (sPD-1) and sPD-ligand 1 in patients with cystic echinococcosis[J]. Exp Ther Med, 2016, 11(1):251-256. DOI: 10.3892/etm.2015.2876
[12] Zhang J, Gao J, Li Y, et al. Circulating PD-L1 in NSCLC patients and the correlation between the level of PD-L1 expression and the clinical characteristics[J]. Thorac Cancer, 2015, 6(4):534-538. DOI: 10.1111/tca.2015.6.issue-4
[13] Jin J, Si J, Liu Y, et al. Elevated serum soluble programmed cell death ligand 1 concentration as a potential marker for poor prognosis in small cell lung cancer patients with chemotherapy[J]. Respir Res, 2018, 19(1):197. DOI: 10.1186/s12931-018-0885-x
[14] 荆结线, 杜丽莉, 徐晓琴, 等.ProGRP对小细胞肺癌的疗效与预后评价的价值[J].中华检验医学杂志, 2013, 36(8):708-712. DOI: 10.3760/cma.j.issn.1009-9158.2013.08.009 [15] Antonia SJ, Lopez-Martin JA, Bendell J, et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small- cell lung cancer (CheckMate 032):a multicentre, open-label, phase 1/2 trial[J]. Lancet Oncol, 2016, 17(7):883-895. DOI: 10.1016/S1470-2045(16)30098-5
[16] Chung HC, Ros W, Delord JP, et al. Effcacy and safety of pembrolizumab in previously treated advanced cervical cancer. resuits from the phase Ⅱ KEYNOTE-158 study[J]. J Clin Oncol, 2019, (3):JCO1801265. https://www.ncbi.nlm.nih.gov/pubmed/30943124
[17] Horn L, Mansfield AS, Szczęsna A, et al. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer[J]. N Engl J Med, 2018, 379(23):2220-2229. DOI: 10.1056/NEJMoa1809064
[18] Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1- expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet. 2019, 393(10183):1819- 1830. DOI: 10.1016/S0140-6736(18)32409-7
[19] Yu H, Batenchuk C, Badzio A, et al. PD-L1 Expression by two complementary diagnostic assays and mRNA in situ hybridization in small cell lung cancer[J]. J Thorac Oncol, 2017, 12(1):110-120. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=WK_LWW2017052520121839
[20] Ott PAE, Hiret S, Kim D, et al. Pembrolizumab(MK-3475) in patients with extensive-stage small cell lung cancer: preliminary safety and efficacy results from KEYNOTE- 028[J]. J Clin Oncol, 2015, (Suppl 33):a7502. DOI: 10.1200/jco.2015.33.15_suppl.7502
-
期刊类型引用(7)
1. 李言冰,石鑫,蔡玲玉,左宏波,王志. 卡瑞利珠单抗联合安罗替尼治疗小细胞肺癌的效果及安全性. 中国当代医药. 2022(02): 82-84+88 .  百度学术
百度学术
2. 赵鹏,刘冬,兰飞,刘红岗,张卉,康艳霞. 非小细胞肺癌化疗前后血清糖类抗原125、基质金属蛋白酶-9、可溶性程序性死亡配体1水平变化及其与疗效关系研究. 陕西医学杂志. 2022(12): 1564-1567 .  百度学术
百度学术
3. 卢佳荣. 胃泌素释放肽前体在小细胞肺癌诊断及治疗中应用探讨. 数理医药学杂志. 2021(03): 328-330 .  百度学术
百度学术
4. 张双. 原发性肾病综合征患者sPD-1、sPD-L1信号通路的变化及其与预后的相关性. 慢性病学杂志. 2021(05): 800-802 .  百度学术
百度学术
5. 雷泽洪,林志潮,李荣岗,林秀欣,甄文光,林忠顺,黄胜起. ProGRP和NSE在小细胞肺癌诊断中的应用研究. 中国医药指南. 2021(13): 25-26 .  百度学术
百度学术
6. 沈剑,霍仁,张正辉. 百令胶囊联合化疗治疗肺癌疗效观察及对肿瘤标志物影响. 新中医. 2021(18): 123-126 .  百度学术
百度学术
7. 王会敏,李春,王丹,朱争艳,李春燕,杨菁. 血清维生素D、sPD-L1及HCG与复发性流产主动免疫治疗预后的关系研究. 国际检验医学杂志. 2020(18): 2268-2271 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: