-
摘要: 自噬是一种正常的细胞生理活动,当正常细胞内存在异常蛋白、损坏的细胞器或处于饥饿状态时被激活,蛋白质和细胞器被捕获后送入到溶酶体降解,再将降解产物作为新合成蛋白和细胞器的底物加以循环利用,从而维持细胞内的平衡;溶瘤病毒(oncolytic virus,OV)是自然存在的或由人工生物技术合成的具有高度肿瘤靶向性及溶瘤性等特点的病毒。作为一种新颖的抗癌治疗方法其作用机制尚未明确。近年来研究发现OV引起肿瘤细胞死亡涉及到细胞自噬相关的机制。为了推进利用OV作为抗癌药物的研制,本文就OV诱导肿瘤细胞发生自噬的机制予以综述。Abstract: Autophagy is a physiological process of normal cells that is activated in response to accumulation of abnormal proteins, damaged organelles, and cell starvation and involves their transport to lysosomes for degradation and recycling, enabling the maintenance of cellular homeostasis. Oncolytic viruses, which are obtained from naturally occurring or genetically modified viruses, specifically target and kill tumor cells. Despite receiving much attention, the mechanisms underlying this process remain unclear, although recent studies have implicated autophagy in the phenomenon. Here we outline how oncolytic viruses cause cell death via autophagy and how they can be exploited for the treatment of cancer.
-
Keywords:
- autophage /
- oncolytic virus /
- tumor cell
-
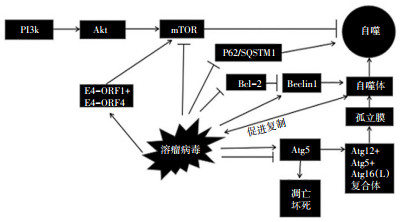
溶瘤病毒(oncolytic virus,OV)自身或借助人工生物工程的方式改造,使其可以特异性的感染并杀伤肿瘤靶细胞。虽然同时感染非肿瘤细胞,但不会在正常细胞内复制,不会改变正常细胞内的基因序列,而且对人体几乎无明显的不良反应[1]。常见的OV包括腺病毒(adenovirus,Ad)、麻疹病毒(measles virus,MV)和水疱性口炎病毒(vesicular stomatitis virus,VSV)、呼肠孤病毒、新城疫病毒(newcastle disease virus,NDV)、单纯疱疹病毒Ⅰ型(herpes simplex virus type 1,HSV1)、脊髓灰质炎病毒、牛痘病毒。改造后OV具有多种肿瘤杀伤机制,包括病毒选择性地在肿瘤细胞内大量复制并直接引起肿瘤细胞裂解死亡[2];通过溶解肿瘤细胞激活损伤相关分子模式,释放肿瘤相关抗原刺激免疫系统诱导抗肿瘤免疫反应[3]。此外,鉴于多数实体肿瘤表达表皮生长因子受体(epidermal growth factor receptor,EGFR),溶瘤Ad携带可以靶向作用EGFR元件-双特异性T细胞衔接蛋白,以加强抗肿瘤效果[4];呼肠孤病毒3型联合光动力学疗法有效杀伤胰腺癌细胞[5]。一项通过改造后使单纯疱疹病毒(talimogene laherparepvec,T-VEC)诱导体内产生粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)以治疗转移性黑色素瘤的研究,已被美国食品药品监督管理局(FDA)批准用于Ⅲ期临床试验[6]。随着对肿瘤机制研究的深入,自噬在抗肿瘤生长中的重要性逐渐被认识。自噬的形成是在环境的刺激下和(或)营养物质缺乏时被激活[7]。由自噬相关基因(autophagy associated gene,Atg)来调控自噬的过程。营养缺乏激活雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、能量(adenosine monophosphate,AMP)、缺氧诱导因子(hypoxia inducible factor,HIF)感应机制均可调节Atg基因产物。上述基因产物调控自噬通路的开通与闭合[8]。通过生物工程技术改造病毒来激活肿瘤细胞的自噬通路,从而促进肿瘤的自噬性死亡。
1. OV与mTOR
当某些因素诱导自噬程序激活后可出现细胞死亡,又称为Ⅱ型程序性细胞死亡。营养物质和mTOR抑制自噬,而AMP活化蛋白激酶(AMPK)和HIF激活自噬。因为胞内磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,又名Akt)/mTOR通路是一个自噬负性调控通路,通过对其下游因子mTOR作用来调控自噬[9]。所以当mTOR被抑制时,自噬程序便被激活。L-肌肽是雷帕霉素的类似物,具有mTOR的抑制作用。将L-肌肽包装到Ad中,再去感染肿瘤细胞就会诱导肿瘤的自噬产生[10]。EphA3是一种在血液系统肿瘤、淋巴瘤、肾癌、黑色素瘤等中有着高表达和高突变的癌基因,有研究通过使Ad携带人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)转基因及1504-siRNA,可靶向作用于潜在致癌基因EphA3,特异性抑制和杀伤表达TERT和EphA3的肿瘤细胞,引起经典自噬负性调节信号通路PI3K/Akt/mTOR的抑制,从而诱导自噬的发生[11]。由此实现了通过人工方法制备OV,主动激活肿瘤细胞中的自噬,诱导肿瘤细胞的死亡。此外,通过NDV(FMW株)抑制Akt/mTOR通路提高自噬水平抑制肺癌[12]。同时,mTOR抑制剂-雷帕霉素可以提高肿瘤中溶瘤T-VEC的含量和分布[13-14],说明溶瘤T-VEC与mTOR抑制剂有协同抗肿瘤作用。mTOR可能成为OV治疗肿瘤的一个重要靶点。Ad通过编码两种蛋白(E4-ORF1和E4-ORF4)来模拟营养/生长信号激活哺乳动物的mTOR,抑制自噬,促进病毒的复制。其中E4-ORF1通过激活PI3K,以活化mTOR;E4-ORF4和糖类堆积可以促进mTOR活化[15],对自噬的抑制行为有利于病毒保证自身最大程度的复制。OV在肿瘤细胞中引起mTOR变化出现两种相反的情况的深层机制尚待研究。
2. OV与Atg5
OV感染的肿瘤细胞中有Atg5参与自噬发生。Atg5为自噬标志分子LC3-Ⅰ(人微管相关蛋白1A/ 1B轻链A)转变到LC3-Ⅱ(人微管相关蛋白1A/1B轻链B)的关键因子。有研究发现,Atg5参与经典和非经典的自噬。Atg5与Atg12、Atg16(L)构成Atg12-Atg5-Atg16(L)复合物。这种复合物定位在孤立膜的表面,其功能是使孤立膜延长,同时也是自噬体重要的膜标志物。Atg5参与自噬体的形成,是自噬程序开启和运行的标志。呼肠孤病毒可以诱导神经胶质母细胞瘤细胞Atg12-Atg5的共轭、LC3的酯化、酸性空泡的形成,导致自噬过程的发生[16]。溶瘤Ad感染脑肿瘤干细胞后可使Atg12-Atg5复合物上调,从而生成大量的自噬体损坏胞膜,引起细胞死亡[17]。有研究通过抗氧化化合物萝卜硫素(sulforaphane,SFN)激活的转录因子NF-E2相关因子2(NRF2)信号途径,诱导VSVΔ51的复制量增加,从而提高OV在肿瘤中的感染范围。野生型小鼠成纤维细胞的OV滴度以及LC3-Ⅱ明显高于Atg5敲除的小鼠(Atg5−/−)成纤维细胞的OV滴度以及LC3-Ⅱ水平[18]。结果提示肿瘤细胞自噬整体上可能阻断了Ⅰ型干扰素的反应,有利于OV的复制。利用siRNA介导敲低Atg5和Beclin-1的方式可以抑制NDV在神经胶质瘤U251细胞中介导的自噬,使瘤中的病毒复制水平明显下降[19]。携带狂犬病毒糖蛋白(rL-RVG)的NDV感染人胃癌细胞系SGC-7901和AGS,可以增加自噬水平、抑制肿瘤细胞的生长,而通过siRNA技术特异性沉默Atg5后又使OV感染细胞自噬下降[20]。将Beclin-1 cDNA联合SG511-BECN克隆到溶瘤Ad中,SG511-BECN诱导的细胞自噬性死亡,但这一过程可以通过敲低ATG5和ATG7而产生自噬部分逆转,而且ATG5、ATG7敲低后可使SG511-BECN诱导的细胞生长抑制得以恢复生长[21]。由此可见,OV发挥良好的自噬效果,需以Atg5存在为前题。利用siRNA敲低肺癌A549/DDP(顺铂抗性)细胞的Atg5后,在NDV(FMW株)感染的肿瘤细胞中出现更多的坏死和凋亡,同时激活负性调节途径抑制自噬[22]。研究结果提示OV抑制自噬,可能与Atg5的另一个功能相关:细胞死亡程序被诱导时,当Atg5存在则细胞走向自噬的方向;当钙蛋白酶介导Atg裂解,则会激活细胞凋亡。
3. OV与自噬体
自噬的活性还依赖于自噬体的活化程度和溶酶体内囊泡降解的程度。如果OV能诱发自噬体的形成及增加,便可将自噬程序进行下去。有研究发现,NDV在紫杉醇抵抗的A549细胞(A549/PTX)中诱导自噬体的形成。NDV(FMW株)的感染可以减少A549/PTX细胞中的Akt磷酸化水平,因PI3K/Akt/ mTOR途径对自噬有抑制作用,所以当Akt减少时自噬程序便会激活[22]。此研究还观察到在NDV感染的A549/PTX的细胞中有时间依赖性的Beclin-1增强表达。Beclin-1在自噬程序的首要阶段中发挥重要作用,提示NDV感染的A549/PTX的细胞中Beclin-1诱导自噬体的形成。这个模型中Atg5也参与其中,因为Atg12-Atg5-Atg16(L)复合物参与了自噬体的形成,所以NDV可能诱导Beclin-1/Atg5/自噬体的通路激活自噬。HSV-1病毒因子ICP34.5可与Beclin结合,有利于Beclin-1和PI3KCⅢ的作用,促进自噬体的形成[23],此外HSV-1还表达1种TOLL样受体的重要配体-HMGB1,当沉默HMGB1基因则发现自噬体的形成明显减少[24]。除了OV正向诱导自噬程序外,已发生的自噬又可以反过来引起OV在肿瘤细胞中的扩增,使这个过程呈正反馈的表现,提示病毒对肿瘤细胞自噬的易化作用。有研究发现,某些病毒可以利用自噬体作为复制的位点,从而促进OV的复制和聚集[25]。利用这种机制,溶瘤效果便可产生瀑布样扩大,其所产生的自噬效果也会同级扩大,就可能实现利用最小量的病毒量杀伤相当数量肿瘤细胞。此外,在LC3相关吞噬作用中,LC3阳性吞噬体通过MHCⅡ类分子延长抗原呈递时间[26]。由此可见,在OV的溶瘤效应中自噬体扮演着主导自噬发生、易化自噬和抗原传递等“多面手”的角色。
4. OV与B淋巴细胞瘤-2基因
B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)基因编码蛋白是Bcl-2家族中的抗凋亡蛋白成员之一。Bcl-2家族分为:1)抗凋亡组(Bcl-2、Mcl-1、BclXL);2)促凋亡组(BAX、BAK);3)BH3蛋白组(NOXA、PUMA、BID、BIM、BAD、BIK和BMF)。Beclin-1为BH3蛋白组的一员,也是具有调节自噬的核心作用的肿瘤抑制因子。Bcl-2蛋白通过BH3域与Beclin-1结合,Bcl-2蛋白抑制Beclin-1,进而抑制Beclin-1介导的自噬。如果抑制Bcl-2的功能,干扰Bcl-2的亲Beclin-1作用,可以使Beclin-1执行其正常诱导自噬的功能。有研究发现,通过VSV联合Bcl-2抑制剂可以干扰Bcl-2对Beclin-1抑制作用,从而使慢性淋巴细胞白血病细胞发生更多的自噬和凋亡。如果单独使用VSV或Bcl-2抑制剂则对阻止Bcl-2/Beclin-1结合作用甚微,但将二者联合应用几乎完全地阻断Bcl-2对Beclin-1的抑制。其中可能的机制为在Bcl-2抑制剂的协助下,VSV会通过Beclin-1激活自噬体的形成进而激活自噬通路[27]。NDV感染的肿瘤细胞通过下调Bcl-2,来增强Beclin-1介导的自噬[28]。溶瘤Ad感染肿瘤细胞,激活细胞中的JNK(cJun N-terminal kinase,JNK)途径,引起Bcl-2磷酸化,并使Bcl-2与Beclin-1分离,从而诱导自噬产生[29]。溶瘤Ad作用于白血病细胞,可使细胞内Bcl-2蛋白家族里的Bcl-2和Mcl-1下调,诱导细胞凋亡从而杀伤肿瘤细胞[30]。由此可见,利用OV作用Bcl-2既能推动自噬程序进行,同时又能使凋亡程序启动,使这两个机制协同发挥抗肿瘤作用。
5. OV与P62/SQSTM1
P62/SQSTM1为一种泛素结合蛋白核自噬受体(sequestosome 1,SQSTM1)。通常在自噬发生时其表达下降。P62有调节NRF2、mTOR和NF-κB的作用,而这些因子则在肿瘤信号通路中较为重要[31]。当自噬被诱导时,会引起P62水平的降低和LC3的酯化。有研究发现在对骨肉瘤细胞系使用OV的Ad5-Δ24-RGD后可引起P62水平的下降、Beclin 1升高和LC3 Ⅰ向LC3Ⅱ转化的增加[32]。其中机制可能为P62可以选择性的与底物结合,激活自噬机制促进自噬体的形成,再与溶酶体结合形成自噬溶酶体,最后P62随着底物降解而降解[33]。还有研究发现,减毒MV的Edmonston株可以触发P62/SQSTM1介导的线粒体自噬,同时诱导肿瘤细胞内线粒体相关的线粒体抗病毒信号蛋白(mitochondria antiviral signaling protein,MAVS)生成和减低内部免疫反应,由此可能为病毒的复制扫清障碍。其中可能的机制为线粒体自噬可以特异性清除被病毒损坏的线粒体,从而使被感染的肿瘤细胞发生死亡[34]。OV也可以控制肿瘤干细胞,ΔPK是一种单纯疱疹病毒Ⅱ型突变体,有研究发现OV的ΔPK可对富含肿瘤干细胞的乳腺癌和黑色素瘤细胞产生溶瘤效应,其可能机制是ΔPK诱导肿瘤细胞中的钙蛋白激酶激活,再通过P62/SQSTM1的下调诱导抗肿瘤效应[35]。所以,P62/SQSTM1也许是杀伤肿瘤干细胞的一个重要靶点。
综上所述,OV通过多种正向及负向自噬相关途径激活自噬发生(图 1)。比如通过抑制PI3K/Akt/ mTOR通路中的mTOR,降低其对自噬的抑制作用,促进自噬发生;通过影响P62下降引起的线粒体自噬;也可以通过抑制Bcl-2对Beclin 1的干扰,诱导自噬的发生;还可以通过提高Beclin 1和Atg5的水平、促进自噬体形成。自噬体的形成也可以增加OV的复制水平。当Atg5裂解后,自噬途径则转向坏死和凋亡方向。溶瘤Ad蛋白E4-ORF1及E4-ORF4激活mTOR,促进病毒复制,虽对自噬程序有抑制作用,但可以通过增加病毒量,增强直接溶瘤效果。
6. 问题与展望
OV作为新的治疗手段存在诸多问题需要解决。如OV的滴度在肿瘤细胞内可有效扩增,会引起细胞溶解。但是过多的扩增会引起细胞固有免疫反应,与此同时会消耗病毒数量,降低自噬水平。许多研究是基于通过人工方法使OV携带有某些功能性元件,从而作用于自噬途径,诱导自噬发生。其优点在于有良好的靶向性,但是携带的功能元件是否可以使所有或者大部分的肿瘤发生自噬程序性死亡尚未可知,如作用在Atg5的病毒,感染细胞发生自噬或坏死、凋亡上应该如何控制;作用在SQSTM1/P62的病毒,同时也可以诱导细胞发生Ⅰ类干扰素反应。寻找自噬与免疫反应间的的平衡点使患者的治疗效果最大化,则可能是OV研制的难点之一。
尽管如此,利用OV技术抗肿瘤已开展许多临床试验。在中国,对头颈部的肿瘤治疗着重利用OV基因治疗的方法。如利用表达P53的重组Ad和T-VEC(HSV)-胸苷激酶(TK)来治疗肿瘤[36]。溶瘤Ad(CG0070)在35例非肌层浸润性膀胱癌患者中开展了Ⅰ期临床试验[37];在前列腺肿瘤、脑部肿瘤、肝脏肿瘤和胰腺肿瘤中都开展了OV的Ⅰ期临床试验[38-41]。经欧洲药品管理局(EMA)人用药品委员会(CHMP)和美国FDA批准,T-VEC可用于Ⅲb、Ⅲc、Ⅳ M1a期黑色素瘤的治疗[42]。OV作为一种新兴的抗肿瘤手段前景广阔。
-
[1] Kaufman HL, Kohlhapp FJ, Zloza A. Oncolytic viruses:a new class of immunotherapy drugs[J]. Nat Rev Drug Discov, 2015, 14(9):642-662. DOI: 10.1038/nrd4663
[2] Khuri FR, Nemunaitis J, Ganly I, et al. a controlled trial of intratumoral ONYX-015, a selectively-replicating adenovirus, in combination with cisplatin and 5-fluorouracil in patients with recurrent head and neck cancer[J]. Nat Med, 2000, 6(8):879-885. DOI: 10.1038/78638
[3] Koks CA, De Vleeschouwer S, Graf N, et al. Immune suppression during oncolytic virotherapy for high-grade glioma; Yes or No[J]? J Cancer, 2015, 6(3):203-217. DOI: 10.7150/jca.10640
[4] Wing A, Fajardo CA, Avery D, et al. Improving CART-cell therapy of solid tumors with oncolytic virus-driven production of a bispecific T-cell engager[J]. Cancer Immunol Res, 2018, 6(5):605-616. DOI: 10.1158/2326-6066.CIR-17-0314
[5] Khaled YS, Wright K, Melcher A, et al. Anti-cancer effects of oncolytic viral therapy combined with photodynamic therapy in human pancreatic cancer cell lines[J]. Lancet, 2015, 385(Suppl 1):S56. http://cn.bing.com/academic/profile?id=f15d13de0a4f2753158595e639b6937e&encoded=0&v=paper_preview&mkt=zh-cn
[6] Andtbacka RH, Kaufman HL, Collichio F, et al. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma[J]. J Clin Oncol, 2015, 33(25):2780-2788. DOI: 10.1200/JCO.2014.58.3377
[7] Levine B, Kroemer G. Autophagy in the pathogenesis of disease[J]. Cell, 2008, 132(1):27-42. DOI: 10.1016/j.cell.2007.12.018
[8] White E, Mehnert JM, Chan CS. Autophagy, metabolism, and cancer[J]. Clin Cancer Res, 2015, 21(22):5037-5046. DOI: 10.1158/1078-0432.CCR-15-0490
[9] Mukhopadhyay S, Panda PK, Sinha N, et al. Autophagy and apoptosis:where do they meet[J]? Apoptosis, 2014, 19(4):555-566. DOI: 10.1007/s10495-014-0967-2
[10] Garofalo M, Iovine B, Kuryk L, et al. Oncolytic adenovirus loaded with L-carnosine as novel strategy to enhance the antitumor activity[J]. Mol Cancer Ther, 2016, 15(4):651-660. DOI: 10.1158/1535-7163.MCT-15-0559
[11] Zhao Y, Li H, Wu R, et al. Antitumor effects of oncolytic adenoviruscarrying siRNA targeting potential oncogene EphA3[J]. PLoS One, 2015, 10(5):e126726. http://cn.bing.com/academic/profile?id=d378a8d7f9281f38a236b6a88182f116&encoded=0&v=paper_preview&mkt=zh-cn
[12] Hu L, Sun S, Wang T, et al. Oncolytic newcastle disease virus triggers cell death of lung cancer spheroids and is enhanced by pharmacological inhibition of autophagy[J]. Am J Cancer Res, 2015, 5(12):3612-3623. http://cn.bing.com/academic/profile?id=3f25eb80bddd47b31f986dd5108b10f4&encoded=0&v=paper_preview&mkt=zh-cn
[13] Fu X, Tao L, Rivera A, et al. Rapamycin enhances the activity of oncolytic herpes simplex virus against tumor cells that are resistant to virus replication[J]. Int J Cancer, 2011, 129(6):1503-1510. DOI: 10.1002/ijc.25808
[14] Zakaria C, Sean P, Hoang HD, et al. Active-site mTOR inhibitors augment HSV1-dICP0 infection in cancer cells via dysregulated eIF4E/4E-BP axis[J]. PLoS Pathog, 2018, 14(8):e1007264. DOI: 10.1371/journal.ppat.1007264
[15] O'Shea C, Klupsch K, Choi S, et al. Adenoviral proteins mimic nutrient/growth signals to activate the mTOR pathway for viral replication[J]. EMBO J, 2005, 24(6):1211-1221. DOI: 10.1038/sj.emboj.7600597
[16] Kemp V, JC I, Ronald W, et al. Oncolytic reovirus infection is facilitated by the autophagic machinery[J]. Viruses, 2017, 9(10):1-15.
[17] Jiang H, White EJ, Gomez-Manzano C, et al. Adenovirus's last trick:you say lysis, we say autophagy[J]. Autophagy, 2008, 4(1):118-120. DOI: 10.4161/auto.5260
[18] Olagnier D, Lababidi RR, Hadj SB, et al. Activation of Nrf2 signaling augments vesicular stomatitis virus oncolysis via autophagy-driven suppression of antiviral immunity[J]. Mol Ther, 2017, 25(8):1900-1916. DOI: 10.1016/j.ymthe.2017.04.022
[19] Meng S, Xu J, Wu Y, et al. Targeting autophagy to enhance oncolytic virus-based cancer therapy[J]. Expert Opin Biol Ther, 2013, 13(6):863-873. DOI: 10.1517/14712598.2013.774365
[20] Bu XF, Wang MB, Zhang ZJ, et al. Autophagy is involved in recombinant Newcastle disease virus (rL-RVG)-induced cell death of stomach adenocarcinoma cells in vitro[J]. Int J Oncol, 2015, 47(2):679-689. DOI: 10.3892/ijo.2015.3039
[21] Tong Y, You L, Liu H, et al. Potent antitumor activity of oncolytic adenovirus expressing Beclin-1 via induction of autophagic cell death in leukemia[J]. Oncotarget, 2013, 4(6):860-874. http://d.old.wanfangdata.com.cn/Conference/8671195
[22] Jiang K, Li Y, Zhu Q, et al. Pharmacological modulation of autophagy enhances newcastle disease virus-mediated oncolysis in drug-resistant lung cancer cells[J]. BMC Cancer, 2014, 14(1):551. DOI: 10.1186/1471-2407-14-551
[23] Yin HC. Interactions between autophagy and DNA viruses[J]. Viruses, 2019, 11(9):539-546.
[24] Wei J. Enhancing oncolytic immunotherapy through induction of immunogenic cell death[D]. 2019.
[25] Lin LT, Dawson PW, Richardson CD. Viral interactions with macroautophagy:a double-edged sword[J]. Virology, 2010, 402(1):1-10. http://cn.bing.com/academic/profile?id=f6cee3b95b800c67b62470e89054f25c&encoded=0&v=paper_preview&mkt=zh-cn
[26] Germic N, Frangez Z, Yousefi S, et al. Regulation of the innate immune system by autophagy:monocytes, macrophages, dendritic cells and antigen presentation[J]. Cell Death Differ, 2019, 26(4):715-727. DOI: 10.1038/s41418-019-0297-6
[27] Samuel S, Beljanski V, Van Grevenynghe J, et al. BCL-2 inhibitors sensitize therapy-resistant chronic lymphocytic leukemia cells to VSV oncolysis[J]. Mol Ther, 2013, 21(7):1413-1423. DOI: 10.1038/mt.2013.91
[28] Bu X, Zhao Y, Zhang Z, et al. Recombinant newcastle disease virus (rLRVG) triggers autophagy and apoptosis in gastric carcinoma cells by inducing ER stress[J]. Am J Cancer Res, 2016, 6(5):924-936. http://cn.bing.com/academic/profile?id=5aebd69f73bbfec27807d6d6d8c743d1&encoded=0&v=paper_preview&mkt=zh-cn
[29] Klein SR, Piya S, Lu Z, et al. C-Jun N-terminal kinases are required for oncolytic adenovirus-mediated autophagy[J]. Oncogene, 2015, 34(41):5295-5301. DOI: 10.1038/onc.2014.452
[30] Jin J, Liu H, Yang C, et al. Effective gene-viral therapy of leukemia by a new fiber chimeric oncolytic adenovirus expressing TRAIL:in vitro and in vivo evaluation[J]. Mol Cancer Ther, 2009, 8(5):1387-1397. http://cn.bing.com/academic/profile?id=b44213a26189d7903a34955f10aba237&encoded=0&v=paper_preview&mkt=zh-cn
[31] Moscat J, Diaz-Meco MT. p62:a versatile multitasker takes on cancer[J]. Trends Biochem Sci, 2012, 37(6):230-236. DOI: 10.1016/j.tibs.2012.02.008
[32] Martinez-Velez N, Xipell E, Jauregui P, et al. The oncolytic adenovirus Delta24-RGD in combination with cisplatin exerts a potent anti-osteosarcoma activity[J]. J Bone Miner Res, 2014, 29(10):2287-2296. DOI: 10.1002/jbmr.2253
[33] Lamark T, Svenning S, Johansen T. Regulation of selective autophagy:the p62/SQSTM1 paradigm[J]. Essays Biochem, 2017, 61(6):609-624. http://cn.bing.com/academic/profile?id=4dceb4c7414c5f278ac0d95c2b4b6e26&encoded=0&v=paper_preview&mkt=zh-cn
[34] Xia M, Gonzalez P, Li C, et al. Mitophagy enhances oncolytic measles virus replication by mitigating DDX58/RIG-I-like receptor signaling[J]. J Virol, 2014, 88(9):5152-5164. DOI: 10.1128/JVI.03851-13
[35] Colunga A, Bollino D, Schech A, et al. Calpain-dependent clearance of the autophagy protein p62/SQSTM1 is a contributor to DeltaPK oncolytic activity in melanoma[J]. Gene Ther, 2014, 21(4):371-378. DOI: 10.1038/gt.2014.6
[36] Guo W, Song H. Development of gene therapeutics for head and neck cancer in China:rrom bench to bedside[J]. Hum Gene Ther, 2018, 29(2):180-187. DOI: 10.1089/hum.2017.230
[37] Burke JM, Lamm DL, Meng MV, et al. A first in human phase 1 study of CG0070, a GM-CSF expressing oncolytic adenovirus, for the treatment of nonmuscle invasive bladder cancer[J]. J Urol, 2012, 188(6):2391-2397. DOI: 10.1016/j.juro.2012.07.097
[38] Delwar Z, Zhang K, Rennie PS, et al. Oncolytic virotherapy for urological cancers[J]. Nat Rev Urol, 2016, 13(6):334-352. DOI: 10.1038/nrurol.2016.84
[39] Lang FF, Conrad C, Gomez-Manzano C, et al. PhaseⅠstudy of DNX-2401(Delta-24-RGD) oncolytic adenovirus:replication and immunotherapeutic effects in recurrent malignant glioma[J]. J Clin Oncol, 2018, 36(14):1419-1427. DOI: 10.1200/JCO.2017.75.8219
[40] Heo J, Reid T, Ruo L, et al. Randomized dose-finding clinical trial of oncolytic immunotherapeutic vaccinia JX-594 in liver cancer[J]. Nat Med, 2013, 19(3):329-336. DOI: 10.1038/nm.3089
[41] Noonan AM, Farren MR, Geyer SM, et al. Randomized phase 2 trial of the oncolytic virus pelareorep (Reolysin) in upfront treatment of metastatic pancreatic adenocarcinoma[J]. Mol Ther, 2016, 24(6):1150-1158. DOI: 10.1038/mt.2016.66
[42] Greig SL. Talimogene laherparepvec:first global approval[J]. Drugs, 2016, 76(1):147-154. http://cn.bing.com/academic/profile?id=2acf765672bf90f9346224a660de7e95&encoded=0&v=paper_preview&mkt=zh-cn
-
期刊类型引用(0)
其他类型引用(1)



 下载:
下载:
