Effect of Bmal1 expression on radiotherapy sensitivity of nasopharyngeal carcinoma xenograft
-
摘要:目的 探讨双向调控时钟基因Bmal1(brain and muscle arnt-like1)对鼻咽癌CNE1裸鼠移植瘤生长的影响及与放疗敏感性的关系。方法 采用慢病毒感染方法,构建Bmal1基因CNE1OE(过表达组)、CNE1OENC(过表达对照组)、CNE1sh3(低表达组)、CNE1shNC(低表达对照组)4株细胞,Western blot验证各组细胞Bmal1蛋白表达情况;4株细胞分别皮下注射相应的4组裸鼠,移植瘤生长后测量其体积;给予6-MeV电子线15 Gy照射裸鼠移植瘤,观察放疗后各组移植瘤体积变化情况。剥离移植瘤,RTPCR及Western blot分别检测Bmal1、P53、P21 mRNA及蛋白表达情况。结果 Western blot结果提示,与各自对照组对比,CNE1OE组Bmal1蛋白过表达,CNE1sh3组Bmal1蛋白低表达,表明细胞转染成功。成功构建裸鼠移植瘤模型,CNE1OE组裸鼠移植瘤体积明显小于CNE1OENC组,CNE1sh3组体积明显大于CNE1shNC组(P < 0.05)。放疗后,CNE1OE、CNE1OENC、CNE1shNC组裸鼠移植瘤体积均缩小(P < 0.05),其中CNE1OE组缩小最明显。CNE1sh3组放疗前后自身体积变化差异无统计学意义。Bmal1基因、P53及P21的mRNA及蛋白相对表达量在CNE1OE组明显高于CNE1OENC组(P < 0.05),CNE1sh3组则明显低于CNE1shNC组(P < 0.05)。结论 Bmal1基因过表达能抑制鼻咽癌CNE1裸鼠移植瘤生长,增强其放疗敏感性,可能与P53、P21蛋白上调相关;敲低则促进移植瘤生长,导致其辐射抗拒,可能与P53、P21蛋白下调相关。Abstract:Objective To explore the effects of up- and down-regulation of circadian clock gene Bmal1 on the growth and radiation sensitivity of nasopharyngeal carcinoma after CNE1 xenograft in nude mice.Methods We produced four groups of cells using lentiviral transfection:cells overexpressing CNE1 (CNE1OE), negative control in which there was no overexpression of CNE1 (OENC), cells with short hairpin RNAi (CNE1sh3), and RNAi negative cells (CNE1shNC). We investigated the expression of Bmal1 protein in the aforementioned groups with Western blot. After subcutaneously injecting the four groups of cells in nude mice, the size of the xenograft was measured. Subsequently, the xenografts were irradiated with 15 Gy at 6 MeV, and variation in the xenograft volume was recorded. mRNA and protein expression levels of Bmal1, p53, and p21 in the xenograft were measured with RT-PCR and Western blot, respectively.Results The CNE1OE group highly expressed Bmal1 protein whereas the CNE1sh3 group was silenced by RNAi as shown with the Western blot, indicating successful transfection. The xenograft in the nude mice developed well. The CNE1OE xenograft volume was lower than that of the CNE1OENC xenograft, whereas the CNE1sh3 xenograft was larger than the CNE1shNC xenograft (P < 0.05). CNE1OE, CNE1OENC, and CNE1shNC xenograft volumes shrank after being irradiated (t=4.32, 5.38, 5.16, respectively; P < 0.05) and the effect was the highest in the CNE1OE group. However, there was almost no variation in xenograft volume in the CNE1sh3 group. The relative amounts of mRNA and protein of Bmal1, P53, and P21 were higher in the CNE1OE group than in the CNE1OENC group, while they were lower in the CNE1sh3 group compared to the CNE1shNC group (P < 0.05).Conclusions Overexpression of Bmal1 inhibited the growth of the CNE1 xenograft in nude mice and enhanced its radiation sensitivity whereas silencing the Bmal1 gene by RNAi promoted the growth of the xenograft and led to radiation resistance. We believe that Bmal1 overexpression leads to P53 and P21 overexpression, thereby inhibiting the growth of the xenograft.
-
Keywords:
- nasopharyngeal carcinoma /
- Bmal1 gene /
- nude mice /
- xenograft /
- radiation sensitivity
-
鼻咽癌治疗失败的主要原因是局部复发和远处转移,导致局部复发的常见原因是肿瘤辐射抗性细胞的产生,如何增强鼻咽癌放疗敏感性为当前研究热点之一。Elshazley等[1]研究发现恶性胸膜间皮瘤细胞Bmal1基因(brain and muscle arnt-like1)是一个促癌基因。然而Jung等[2]发现Bmal1基因在肺癌和胶质瘤细胞是抑癌基因。Zeng等[3]研究发现Bmal1基因在结直肠癌细胞是抑癌基因,并且可增加结直肠癌对化疗药物奥沙利铂的敏感性。以上研究表明,Bmal1基因与肿瘤的关系复杂,具有促癌作用或抑癌作用。针对Bmal1基因在鼻咽癌的发生发展中产生何种作用,能否增强鼻咽癌细胞的放疗敏感性等问题,本课题组前期体外细胞研究发现[4],鼻咽癌细胞株过表达Bmal1(H-ARNTL)基因能抑制肿瘤生长,增加肿瘤细胞的放射敏感性。Bmal1基因可能通过降低S期比例、增加G2/M期阻滞,从而增加放疗后细胞凋亡,增强放射敏感性。然而,体外环境与体内环境差别较大,本研究采用慢病毒感染方法,研究Bmal1基因过表达和低表达时对鼻咽癌CNE1裸鼠移植瘤生长及放疗敏感性的影响。
1. 材料与方法
1.1 材料
1.1.1 细胞系
鼻咽癌细胞CNE1来自于中山大学附属肿瘤医院。
1.1.2 主要试剂
PCR试剂Primer购自上海生工公司;琼脂糖凝胶DNA回收试剂盒GK2042-500购自上海Generay公司;T4DNA ligase购自立陶宛Fementas公司;琼脂糖购自上海前尘公司;Positive clone测序由美国Invitrogen公司完成。高纯度质粒抽提试剂盒购自德国QIAGEN公司。限制性内切酶(BamH I、EcoR I)购自立陶宛Fermentas公司。兔多抗Bmal1购自英国Abcam公司,兔多抗GAPDH购自杭州贤至生物公司,兔多抗P53、P21购自武汉三鹰生物公司,HRP标记羊抗兔二抗购自武汉博士德生物公司。
1.1.3 实验动物
SPF级BALB/c裸鼠,雌性,4~6周龄,共20只,购自江苏集萃药康生物科技有限公司。动物合格证号:SCXK(苏)2018-0008。本实验符合国家有关实验动物保护规范和管理条例。
1.2 方法
1.2.1 Bmal1基因过表达慢病毒载体的构建
根据NCBA中Bmal1基因序列,设计合成引物。引物序列为:上游引物:5'-CCGGAATTCGCCACCATGGCAGACCAGAGA ATGGACATTTCTTC-3';下游引物:5'-CCGGGATCCTT ACAGCGGCCATGGCAAGTC-3'。在T4DNA连接酶的作用下,将慢病毒载体PGMLV-PA6与Bmal1片段进行连接;将连接产物加入感受态大肠杆菌细胞中,热休克促进连接产物转化。培养后送测序公司进行测序鉴定。
1.2.2 Bmal1基因慢病毒干扰载体的构建
针对目的基因Bmal1基因序列,设计合成shRNA寡聚单链DNA,序列为(5' to 3'):Bmal1sh3T:GATCCGCACGCGATAGA TGGAAAGTTCTCGAGAACTTTCCATCTATCGCGTGCTT TTTT;Bmal1sh3B:AATTAAAAAAGCACGCGATAGATG GAAAGTTCTCGAGAACTTTCCATCTATCGCGTGCg。将其退火形成双链结构,在T4DNA连接酶作用下,将RNAi慢病毒载体PGMLV-SB3与引物连接;后续步骤同1.2.1。
1.2.3 慢病毒的包装和病毒滴度的测定
将构建成功的慢病毒过表达质粒、干扰质粒、包装质粒用质粒抽提试剂盒进行提取;293T细胞培养,细胞长至70%~80%时行慢病毒感染;将DMEM、质粒、LentiHG mix、HG TransGene reagent混匀配置感染体系;将感染体系滴加到293T细胞培养皿中;换液后,吸取细胞上清离心,用滤器过滤上清液后将滤液转移至浓缩装置中,离心,收集病毒浓缩液。病毒保存于-80℃冰箱。
将HEK293T细胞进行培养;冻存病毒液冰浴融化,用细胞培养液进行梯度稀释;慢病毒稀释液均匀滴加到HEK293T细胞进行感染;慢病毒感染成功后,提取细胞RNA行RT-PCR;PCR反应条件:预变性,95℃,45 s;PCR循环95℃、15 s,60℃、60 s,40个循环;融解曲线:60℃→95℃。
1.2.4 慢病毒感染目的细胞
接种CNE1细胞于培养皿中,将冻存病毒原液冰浴融化,按合适的MOI值稀释病毒原液,吸出对照组和处理组原有培养基,将慢病毒稀释液及慢病毒阴性对照稀释液分别滴加到处理组和对照组细胞中。用嘌呤霉素进行稳转株细胞筛选。
1.2.5 Western blot验证稳转CNE1细胞中Bmal1蛋白的表达
将Bmal1基因过表达、Bmal1基因干扰稳转株细胞进行培养,去除培养液,IP裂解液冰上裂解细胞,提取蛋白后将蛋白样品上样至SDS-PAGE胶加样孔,按电泳、转膜、封闭、一抗孵育、二抗孵育、化学发光、显影、定影步骤进行。
1.2.6 裸鼠饲养及接种
裸鼠饲养在贵州医科大学临床医学研究中心SPF级饲养室。裸鼠的饮水、饲料、垫料均高压灭菌,12 h光照、12 h黑夜交替;20只裸鼠按随机数字表法随机分为4组,5只/组。每组裸鼠分别接种细胞CNE1OE(Bmal1基因过表达组)、CNE1OENC(过表达对照组)、CNE1sh3(低表达组)、CNE1shNC(低表达对照组)。用接种细胞命名相应的裸鼠组别。细胞活力98%,细胞密度为2.5×107个/mL,每只裸鼠接种PBS细胞悬液0.2 mL,接种细胞个数为5×106个,接种部位右上肢腋下皮下注射。裸鼠成瘤率100%,无自然死亡。
1.2.7 肿瘤体积测量与计算
裸鼠移植瘤接种后3天开始用游标卡尺测量移植瘤大小,每3天测量1次。测量移植瘤长径a和短径b。根据公式V=1/2×a× b2计算肿瘤体积[5-6]。肿瘤体积缩小比例=(V放疗前- V放疗后)/V放疗前×100%。
1.2.8 裸鼠移植瘤放疗
移植瘤种植后第23天CNE1OE组裸鼠移植瘤最大长径为10.94 mm,CNE1sh3组最大长径为19.20 mm,予放疗。采用瑞典医科达Synergy型医用直线加速器行裸鼠移植瘤放疗。用自制装置固定裸鼠,给予6-MeV电子线照射,放疗剂量为15 Gy;剂量率600 cGy/min;源皮距(SSD)100 cm;用1.0 cm铅块遮挡裸鼠正常组织,照射野2.5 cm×2.0 cm;瘤体表面垫0.5 cm蜡块作为补偿;放疗后第12天CNE1OE组最大长径为7.70 mm,CNE1sh3组最大长径为21.22 mm,次日采用颈椎脱位处死裸鼠。
1.2.9 RT-PCR检测裸鼠移植瘤Bmal1、P53、P21 mRNA表达水平
用Trizol法提取移植瘤组织RNA,用微量分光光度计测定其浓度及纯度。将总RNA反转录为cDNA。每个待测样品设置3个平行样。RT-PCR反应条件为:50℃、2 min、95℃、10 min;95℃、30 s、60℃、30 s,40个循环。引物序列:GAPDH上游5'-TCAAGAAGGT GGTGAAGCAGG-3',下游5'-TCAAAGGTGGAGGAG TGGGT-3';Bmal1上游5'-GGATGTGACCGAGGGAAGA T-3',下游5'-ATAATCGAGATGGCCCAGGG-3';P53上游5'-AGGTTGGCTCTGACTGTACC-3',下游5'-GATTC TCTTCCTCTGTGCGC-3';P21上游5'-CACCGAGACAC CACTGGAG-3',下游5'-AGGCACAAGGGTACAAGAC A-3'。
1.2.10 Western blot检测裸鼠移植瘤Bmal1、P53、P21蛋白表达
处死裸鼠后剥离移植瘤组织,提取组织蛋白后把蛋白样品上样至SDS-PAGE胶加样孔,余步骤同1.2.5行Western blot检测。
1.3 统计学分析
采用SPSS 19.0统计学软件对多组样本均数间比较行方差分析,数据用x±s表示。方差齐者组间两两比较采用LSD法,方差不齐者组间两两比较采用Dunnett's T3法。每组裸鼠放疗前后体积变化行自身配对t检验。P < 0.05为差异具有统计学意义。
2. 结果
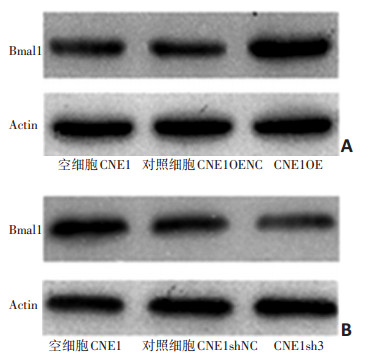
2.1 Western blot验证CNE1细胞Bmal1基因过表达及干扰效果
CNE1OE组Bmal1蛋白免疫印迹条带较CNE1OENC组明显增强,说明细胞感染后CNE1OE组能高效表达Bmal1 mRNA和蛋白;CNE1sh3组Bmal1蛋白免疫印迹条带较CNE1shNC组显著减弱,说明细胞感染后CNE1sh3组Bmal1 mRNA和蛋白的表达受到明显抑制(图 1)。
2.2 构建移植瘤模型后肿瘤生长情况
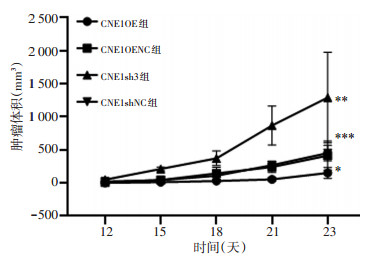
CNE1OE、CNE1OENC、CNE1sh3、CNE1shNC组移植瘤体积在第12天分别为(2.47±2.40)、(7.17±8.81)、(49.17±23.19)、(20.75±8.67)mm3;第15天分别为(10.34±7.21)、(44.71±26.30)、(211.84±27.36)、(40.16± 17.63)mm3,第18天分别为(28.16±13.75)、(142.91± 94.23)、(372.05±110.72)、(109.91±49.63)mm3;第21天分别为(54.90 ± 26.47)、(240.80 ± 81.43)、(868.49 ± 294.54)、(269.18±52.88)mm3;第23天分别为(151.00± 81.69)、(413.32±220.27)、(1 291.14±686.10)、(451.38±117.29)mm3。结果表明,与对照组CNE1OENC、CNE1shNC组相比,CNE1OE组裸鼠移植瘤生长最慢、体积最小(F=20.06,P < 0.05);CNE1sh3组生长最快、体积最大(F=19.60,P < 0.05)。CNE1OENC与CNE1shNC组肿瘤体积比较差异无统计学意义(P>0.05,图 2)。
2.3 放疗后裸鼠移植瘤生长情况
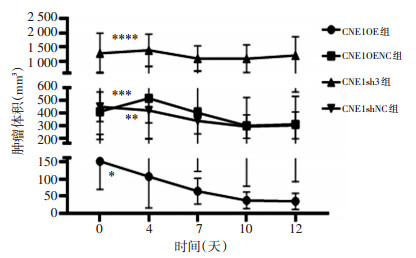
CNE1OE、CNE1OENC、CNE1sh3、CNE1shNC组移植瘤体积在放疗后第4天分别为(106.62±90.71)、(518.74± 320.97)、(1 394.00±557.23)、(421.83±99.00)mm3,第7天分别为(64.45±37.22)、(403.19±281.38)、(1 108.75± 431.32)、(339.25±102.95)mm3,第10天分别为(37.52± 23.91)、(301.14±222.35)、(1 103.26±471.56)、(294.36± 93.16)mm3,第12天分别为(34.93±23.23)、(312.84± 220.74)、(1 218.34±649.92)、(304.13±105.67)mm3。结果表明,CNE1OE组(t=4.32,P < 0.05)、CNE1OENC组(t= 5.38,P < 0.05)、CNE1shNC组(t=5.16,P < 0.05)放疗后肿瘤体积均缩小,CNE1OE组缩小比例最大,为77.2%± 7.4%,CNE1OENC、CNE1shNC组缩小比例分别为29.2%± 18.5%、33.8%±14.4%(F=17.45,P < 0.05)。然而,CNE1sh3组放疗前后自身体积变化差异无统计学意义(t=0.63,P>0.05)。提示CNE1OE组放疗敏感性增强,而CNE1sh3组表现为辐射抗拒(图 3)。
2.4 RT-PCR检测Bmal1、P53、P21 mRNA的相对表达
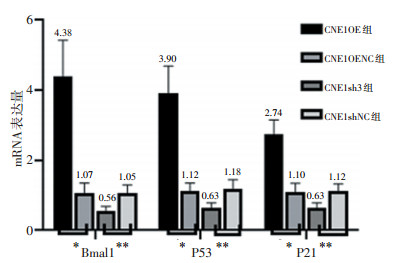
处死裸鼠后剥离移植瘤,行RT-PCR检测结果提示,CNE1OE、CNE1OENC、CNE1sh3、CNE1shNC组Bmal1 mRNA相对表达量分别为4.38±1.04、1.07±0.28、0.56± 0.12、1.05±0.25,行单因素方差分析(F=50.03,P < 0.05);P53 mRNA相对表达量分别为3.90±0.79、1.12±0.23、0.63± 0.16、1.18±0.27(F=56.28,P < 0.05);P21 mRNA相对表达量分别为2.74±0.41、1.10±0.24、0.63±0.16、1.12±0.21,差异有统计学意义(F=57.77,P < 0.05)。CNE1OENC组与CNE1shNC组相比,差异无统计学意义(P>0.05)。上述结果表明,与对照组相比,CNE1OE组移植瘤Bmal1、P53、P21 mRNA表达上调,CNE1sh3组则下调(图 4)。
2.5 Western blot检测移植瘤Bmal1、P53、P21蛋白的相对表达
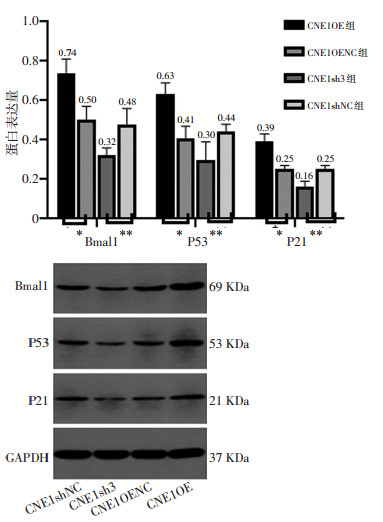
剥离移植瘤行Western blot检测,结果提示CNE1OE、CNE1OENC、CNE1sh3、CNE1shNC组Bmal1蛋白相对表达量分别为0.74±0.07、0.50±0.07、0.32±0.04、0.48±0.08,行单因素方差分析(F=36.08,P < 0.05);P53蛋白相对表达量分别为0.63±0.06、0.41±0.06、0.30±0.09、0.44±0.04(F=21.39,P < 0.05);P21蛋白相对表达量分别为0.39± 0.04、0.25±0.02、0.16±0.03、0.25±0.02,差异有统计学意义(F=51.94,P < 0.05)。CNE1OENC组与CNE1shNC组相比差异无统计学意义(P>0.05)。上述结果表明,与对照组相比,CNE1OE组移植瘤Bmal1、P53、P21蛋白表达上调,CNE1sh3组则下调(图 5)。
3. 讨论
时钟基因是有机体调控系统多反馈环的基本组成元件[7],与有机体的各种生命活动如激素分泌、细胞代谢等密切相关[8]。目前已发现的时钟基因有Per1、Per2、Per3、Cry1、Cry2、Clock、Bmal1、TIM、CKIε、NPAS2、REVERBs、Dec1、Dec2和RORs[4, 9-10]。Bmal1基因又称为ARNTL(aryl hydrocarbon receptor nuclear translocatorlike)基因,是哺乳动物生命活动中重要的中央时钟元件,位于11号染色体短臂,编码蛋白质Bmal1,属于bHLH-PAS结构域转录因子家族[11]。Bmal1基因在生物节律中起着重要的调控作用,其发生突变或缺失时可导致机体节律紊乱,并引起一系列的病变。敲除小鼠视交叉上核中Bmal1基因,其昼夜节律会丧失[12]。
研究表明,Bmal1基因与肿瘤的发生发展有密切关系。Elshazley等[1]研究发现,在恶性胸膜间皮瘤的发生发展中,Bmal1基因起着促癌作用。然而,He等[13]研究发现,鼻咽癌组织中Bmal1基因的表达量明显低于正常组织,表明Bmal1基因可能抑制鼻咽癌的发生发展。Jung等[2]发现Bmal1基因可抑制肺癌和神经胶质瘤细胞的发生发展。Hsu等[14]发现头颈鳞癌组织中Bmal1基因表达水平明显低于正常组织,Bmal1基因在头颈鳞癌可能是一个抑癌基因。Jiang等[16]发现Bmal1基因在胰腺癌组织中呈低表达。
本实验采用慢病毒感染方法,构建了Bmal1基因过表达、过表达对照、低表达、低表达对照4株鼻咽癌CNE1细胞,Western blot验证Bmal1蛋白表达量提示细胞感染成功,成功构建裸鼠移植瘤模型。剥离移植瘤行RT-PCR及Western blot检测结果提示,CNE1OE组Bmal1 mRNA及蛋白表达量高于CNE1OENC组,CNE1sh3组则低于CNE1shNC组,差异有统计学意义,提示CNE1OE组裸鼠移植瘤Bmal1表达明显上调,CNE1sh3组裸鼠移植瘤Bmal1表达明显下调。
裸鼠移植瘤生长过程显示,与对照组相比,CNE1OE组肿瘤成瘤时间最晚,生长最慢,移植瘤种植后第15天,CNE1OE组肿瘤体积为(10.34±7.21)mm3,CNE1OENC组肿瘤体积为(44.71±26.30)mm3,CNE1OE组肿瘤体积小于CNE1OENC组,差异具有统计学意义。CNE1sh3组移植瘤生长最快,第15天其体积为(211.84±27.36)mm3,CNE1shNC组体积为(40.16±17.63)mm3,CNE1sh3组肿瘤体积大于CNE1shNC组,差异具有统计学意义。CNE1OENC组与CNE1shNC组体积相比差异无统计学意义。造移植瘤模型后肿瘤生长情况表明,Bmal1基因过表达能抑制鼻咽癌CNE1移植瘤的生长,而低表达则促进其生长,这证明在鼻咽癌的发生发展中,Bmal1基因是一个抑癌基因,与He等[13]研究结果一致。
本研究发现,放疗后CNE1OENC组、CNE1shNC组缩小比例分别为29.2% ± 18.5%、33.8% ± 14.4%,CNE1OE组肿瘤缩小比例为77.2%±7.4%,差异具有统计学意义,CNE1OE组肿瘤缩小最明显。然而CNE1sh3组肿瘤体积放疗前后自身配对t检验提示差异无统计学意义。本研究推测,CNE1OE组肿瘤由于Bmal1基因过表达,抑制放射线所致DNA损伤的修复,进一步导致肿瘤细胞凋亡,增加肿瘤细胞对放疗的敏感性。表明CNE1sh3组肿瘤呈现辐射抗拒。推测CNE1sh3组由于Bmal1基因低表达,导致放疗后DNA损伤修复较快,肿瘤对放射线的损伤敏感性较差。
Zeng等[3]研究发现,Bmal1基因可增加结直肠癌细胞对化疗药物奥沙利铂的敏感性,可能的机制是Bmal1基因通过ATM信号通路调控G2/M期阻滞,诱导细胞凋亡。Jung等[2]发现,Bmal1可能通过阻断PI3K-Akt-MMP-2途径,抑制基质金属蛋白酶MMP-2的表达,进一步抑制肺癌和神经胶质瘤细胞的转移。
Slat等[16]研究发现,替莫唑胺诱导肿瘤细胞凋亡的活性依赖于Bmal1基因。Sakamoto等[17]研究发现,在结直肠癌中Bmal1基因能够通过促进p53基因表达、增加癌细胞凋亡起到抑癌基因的作用。Zeng等[3]研究发现,Bmal1基因过表达直肠癌细胞株中,ATM、p53、Wee1的表达明显上调。
p53基因全长约20 kb,定位于人类染色体17p13.1,人类肿瘤约50%以上与p53基因变异有关[18-20]。p21基因是位于p53基因下游的细胞周期素依赖性激酶抑制因子[15, 21-23]。本研究处死裸鼠后剥离移植瘤进行RT-PCR及Western blot检测,结果发现CNE1OE组P53、P21 mRNA及蛋白表达量明显高于CNE1OENC组,CNE1sh3组明显低于CNE1shNC组,差异具有统计学意义;CNE1OENC组与CNE1shNC组相比则差异无统计学意义。Mullenders等[24]采用大规模的shRNA测序,表明Bmal1可正调控p53基因。Jiang等[15]研究发现,Bmal1过表达的胰腺癌细胞P21表达增加,发生了G2/M期阻滞,该研究探索了Bmal1基因诱导p53依赖性细胞凋亡和G2/M期细胞周期阻滞的机制。本研究发现,Bmal1基因过表达时P53、P21 mRNA及蛋白表达上调,推测Bmal1基因抑制肿瘤生长、增强放疗敏感性的机制可能与P53、P21蛋白表达上调有关,通过体内实验揭示了Bmal1基因与鼻咽癌CNE1生长及与放射敏感性的初步关系,为进一步研究Bmal1基因如何通过其反馈环及通路对肿瘤的影响奠定了良好的实验基础。
综上所述,Bmal1基因与鼻咽癌细胞CNE1的生长有密切关系,且能增强鼻咽癌细胞CNE1对放疗的敏感性,将为鼻咽癌复发及远处转移治疗靶点的研究提供一定的实验理论及数据。
-
-
[1] Elshazley M, Sato M, Hase T, et al. The circadian clock gene BMAL1 is a novel therapeutic target for malignant pleural mesothelioma[J]. Int J Cancer, 2012, 131(12):2820-2831. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3479344
[2] Jung CH, Kim EM, Park JK, et al. Bmal1 suppresses cancer cell invasion by blocking the phosphoinositide 3-kinase-Akt-MMP-2 signaling pathway[J]. Oncol Rep, 2013, 29(6):2109-2113. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=1f38e3683a841e4cf8cd90e021cda985
[3] Zeng ZL, Luo HY, Yang J, et al. Overexpression of the circadian clock gene bmal1 increases sensitivity to oxaliplatin in colorectal cancer[J]. Clin Cancer Res, 2014, 20(4):1042-1052. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=271a2889b4c9e3f716c786f6227ea335
[4] 陈越, 金风.生物钟Bmal1基因与肿瘤治疗的研究进展及未来新思路[J].中国肿瘤临床, 2019, 46(10):518-523. http://journal11.magtechjournal.com/Jwk_zgzllc/CN/abstract/abstract14194.shtml [5] 刚小青, 吴衡慧, 周文磊.白桦脂醇通过抑制PI3K/AKT途径抑制宫颈癌小鼠移植瘤增殖[J].中国免疫学杂志, 2019, 35(10):1227-1231. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgmyxzz201910016 [6] 何鑫, 游建, 肖定, 等.维生素K2对人肝癌裸鼠移植瘤生长及肝癌衍生生长因子表达的影响[J].中华实验外科杂志, 2019, 36(10):1752-1754. http://d.old.wanfangdata.com.cn/Periodical/zhsywk201910008 [7] Takahashi JS. Transcriptional architecture of the mammalian circadian clock[J]. Nat Rev Genet, 2017, 18(3):164-179. http://cn.bing.com/academic/profile?id=1a5830296ccb1211fb827e992d1c8580&encoded=0&v=paper_preview&mkt=zh-cn
[8] Zhao N, Tang H, Yang K, et al. Circadian rhythm characteristics of oral squamous cell carcinoma growth in an orthotopicxenograftmodel[J]. Onco Targets Ther, 2013, 6:41-46. https://www.ncbi.nlm.nih.gov/pubmed/23378773
[9] 孟熙, 金风.时钟基因与肿瘤转移的研究进展[J].中国癌症防治杂志, 2019, 11(4):341-345. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgyxwz-zlxfc201904014 [10] 岳敏, 杨禹, 秦曦明, 等.哺乳动物生物钟的遗传和表观遗传研究进展[J].遗传, 2017, 39(12):1122-1137. http://d.old.wanfangdata.com.cn/Periodical/yc201712002 [11] 王钧左, 陈励, 张斌, 等.时钟基因Bmall在昼夜节律行为调节中的研究进展[J].军事医学, 2019, 43(4):301-304. [12] Izumo M, Pejchal M, Schook AC, et al. Differential effects of light and feeding on circadian organization of peripheral clocks in a forebrain Bmal1 mutant[J]. Elife, 2014, 3(8):e04617. http://cn.bing.com/academic/profile?id=eb43937f0e4c3e1bdfc4b4a83ba273ae&encoded=0&v=paper_preview&mkt=zh-cn
[13] He QY, Jin F, Li YY, et al. Prognostic significance of downregulated BMAL1 and upregulated Ki-67 proteins in nasopharyngeal carcinoma[J]. ChronobiolInt, 2018, 35(3):348-357. http://cn.bing.com/academic/profile?id=5d4d835c47069e384bb4cea00851ad7c&encoded=0&v=paper_preview&mkt=zh-cn
[14] Hsu CM, Lin SF, Lu CT, et al. Altered expression of circadian clock genes in head and neck squamous cell carcinoma[J]. Tumour Biol, 2012, 33(1):149-155. http://cn.bing.com/academic/profile?id=9a959bfdedab33d9245ed1450c68c313&encoded=0&v=paper_preview&mkt=zh-cn
[15] Jiang WL, Zhao SL, Jiang XH, et al. The circadian clock gene bmal1 acts as a potential anti-oncogene in pancreatic cancer by activating the p53 tumor suppressor pathway[J]. Cancer Leu, 2016, 371(2):314-325. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=a42efcdcf188e0d667f8a69c381cd304
[16] Slat EA, Sponagel J, Marpegan L, et al. Cell-intrinsic, bmal1-dependent circadian regulation of temozolomide sensitivity in glioblastoma[J]. J Biol Rhythms, 2017, 32(2):121-129. http://cn.bing.com/academic/profile?id=5a7fe4a0e57b5663402208c7d59fe91e&encoded=0&v=paper_preview&mkt=zh-cn
[17] Sakamoto W, Takenoshital S. Overexpression of both clock and bmal1 inhibits entry to s phase in human colon cancer cells[J]. Fukushima J Med Sci, 2015, 61(2):111-124. http://cn.bing.com/academic/profile?id=cc194b4503caae571a70d2d154b1dcf9&encoded=0&v=paper_preview&mkt=zh-cn
[18] 田艳, 朱军.P53rsl625895基因多态性与弥漫大B细胞淋巴瘤预后相关性分析[J].北京大学学报(医学版), 2019, 51(5):791-796. http://www.cqvip.com/QK/98569B/201805/675404251.html [19] 郝欣, 王荣升, 李建辉.p53基因第72密码子基因多态性与胃溃疡患者Hp易感性、预后的关系[J].山东医药, 2019, 59(1):16-19. http://d.old.wanfangdata.com.cn/Periodical/shandyy201901006 [20] 李平, 陈敏斌.P53基因在宫颈癌发病中的意义及对放射敏感性的影响[J].中华放射肿瘤学杂志, 2017, 26(5):593-597. http://d.old.wanfangdata.com.cn/Periodical/zhfszl201705026 [21] 吴明彩, 蒋明, 董婷, 等.CHD5基因启动子甲基化调控P19Arf/p53/p21Cip1信号通路促进急性髓系白血病发病的研究[J].中国实验血液学杂志, 2019, 27(4):1001-1007. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgsyxyxzz201904003 [22] 王志红, 林芸, 苏婉婷, 等.骨髓间充质干细胞尾静脉注射治疗大鼠肝损伤的效果及机制[J].山东医药, 2017, 57(3):42-44. http://d.old.wanfangdata.com.cn/Periodical/shandyy201703013 [23] 张妍, 张艳君, 张业.结肠癌细胞HCT116中P53的R213突变对靶基因P21表达的影响[J].基础医学与临床, 2017, 37(5):663-667. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=jcyxylc201705016 [24] Mullenders J, Fabius AW, Madiredjo M, et al. A large scale shRNA barcode screen identifies the circadian clock component ARNTL as putative regulator of the p53 tumor suppressor pathway[J]. PLoS One, 2009, 4(3):e4798. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_2653142



 下载:
下载: