Clinical efficacy of hyperthermic intraperitoneal chemotherapy plus cytoreductive surgery for peritoneal metastasis of gallbladder cancer
-
摘要:目的 探讨腹腔热灌注化疗(hyperthermic intraperitoneal chemtheropy,HIPEC)治疗胆囊癌伴腹膜转移患者的临床疗效研究。方法 本文回顾性分析海军军医大学东方肝胆外科医院2015年1月至2018年1月收治的84例胆囊癌合并腹膜转移患者,31例患者给予HIPEC联合细胞减灭术(cytoreductive surgery,CRS)+术后1个月全身化疗为研究组,53例给予细胞减灭术+术后1个月全身化疗为对照组,观察比较两组临床疗效及不良反应发生情况。结果 研究组中位生存时间为(21.72±2.96)个月,显著长于对照组的(14.93±2.09)个月(P < 0.05)。研究组白细胞减少、血红蛋白减少、血小板减少、胃肠道反应、肝功能损伤和肾功能损伤较对照组无显著性差异(P>0.05)。结论 HIPEC治疗进展期胆囊癌临床疗效显著,可延长患者生存时间,不良反应较小,值得推广应用。Abstract:Objective To investigate the clinical efficacy of hyperthermic intraperitoneal chemotherapy (HIPEC) for gallbladder cancer with peritoneal metastasis.Methods Data of 84 patients, who were admitted to Shanghai Eastern Hepatobiliary Surgery Hospital from January 2015 to January 2018, were retrospectively analyzed. Of the total patients, 31 received HIPEC combined with cytoreductive surgery (CRS) plus postoperative systemic chemotherapy one month after surgery as the study group (Group A), and the other 53 underwent CRS plus postoperative systemic chemotherapy one momth after surgery as the control group (Group B). The clinical effects and adverse reactions in the two groups were observed and compared.Results The median survival time in the Group A was (21.72±2.96) months, significantly longer than that of (14.93±2.09) months in Group B (P < 0.05). There were no statistically significant differences in leukopenia, hemoglobinemia, thrombocytopenia, gastrointestinal reaction, liver function injury and renal function injurybetween the two groups (P>0.05).Conclusions HIPEC has significant clinical efficacy for gallbladder cancer with peritoneal metastasis. HIPEC can prolong the survival time and have less side effects.
-
胆囊癌是恶性程度较高的腹腔肿瘤之一,发病率为2.5/10万人,在消化道肿瘤的发病率居第5位[1]。胆囊癌预后差,起病隐匿,就诊时往往已经是进展期,容易出现转移,转移的主要途径有血行转移、淋巴结转移、腹膜种植转移[2],腹膜转移尤为常见,发生率约10%~20%[3]。无法根治性切除的患者的中位生存时间 < 6个月,全身化疗、靶向放射治疗效果不佳[4-5]。近年来,国内外肿瘤学界认为腹膜转移已不完全是癌广泛转移的表现,而是一种区域性转移[6],并探索发展了一套综合治疗新策略,即腹腔热灌注化疗(hyperthermic intraperitoneal chemtheropy,HIPEC)联合肿瘤细胞减灭术(cytoreductive surgery,CRS)。CRS可以切除肉眼可见的病灶,再由HIPEC消灭微转移癌和游离的癌细胞。该疗法已经在胃肠道肿瘤治疗中广泛应用,国内关于胆囊癌的治疗报道较少。本研究旨在探讨HIPEC治疗胆囊癌伴腹膜转移患者的临床疗效。
1. 材料与方法
1.1 研究对象
收集海军军医大学东方肝胆外科医院2015年1月至2018年1月的84例胆囊癌合并腹膜转移患者,均接受了CRS治疗。依照美国癌症联合委员会(AJCC)第八版胆道肿瘤的TNM分期,所有患者均为Ⅲ、Ⅳ期,按治疗方法将患者分成两组:研究组(CRS+ HIPEC+系统化疗组)31例,对照组(CRS+系统化疗组)53例。纳入标准:1)术中探查发现有腹膜侵犯或转移;2)术后病理明确诊断为胆囊癌;3)根据AJCC第八版TNM分期判断为Ⅲ、Ⅳ期;4)KPS评分≥70分;5)没有接受过化疗或放疗;6)所有患者均知情同意;7)无化疗或手术的禁忌证。
1.2 CRS与HIPEC的治疗方法
所有患者入院后根据自身综合情况给予手术治疗,均行CRS术。在全麻下行剖腹探查术,取右肋缘下切口,开腹后从膈面腹膜到盆腔腹膜探查肿瘤侵犯程度及腹膜转移范围,进行腹膜癌指数(peritoneal cancer index,PCI)评分。凡能完全缩瘤者行根治性切除,不能完全缩瘤者行最大程度CRS,并根据腹膜表面肿瘤国际联盟(PSGOI)进行CCR评分。CCR-0分:CRS后无腹膜残余瘤;CCR-1分:残余瘤直径 < 2.5 mm;CCR-2分:残余瘤直径2.5 mm~2.5 cm;CCR-3分:残余瘤>2.5 cm,或存在无法切除的病灶。
对照组:于1个月内,根据患者的全身情况、血清肿瘤学等结果,制定化疗方案,以氟尿嘧啶或者奥沙利铂为主。
研究组:患者均完成CRS后,关腹即行封闭式循环HIPEC。手术后第2天开始行HIPEC,每隔1天重复1次(根据患者能否耐受,分别行1~5次)。HIPEC术的方法:将4根灌注导管置入腹腔,左侧出口管位于肋弓下方4指与锁骨中线相交处,右侧出口管位于切口下方3指与锁骨中线相交处。两个出口管分别置入盆腔,两侧入口管位于脐与髂前上棘连线中外1/3处,两个入口管分别放于肝膈面和脾脏前方,内交叉置管方法使热灌注液体充盈整个腹腔,不留治疗盲区。用4 L灌注液进行循环灌注,流量200~400 mL/min,加入化疗药物(5-FU和顺铂),加热灌注液至43℃,热灌注化疗60~90 min。灌注机试验正常,无菌条件下连接专用循环通路与各预置的关注管,形成密闭环路,使加热的灌注液流入腹腔并持续循环。同时,给予盐酸哌替啶加盐酸异丙嗪止痛,灌注速度为400~600 mL/min,每隔1天重复1次,3次为1个疗程。整个灌注过程严密监测患者生命体征变化,若患者出现腹部不适,可适当调慢灌注速度。术后1月内,根据患者的全身情况、血清肿瘤学等结果,制定化疗方案。化疗方案以氟尿嘧啶或者奥沙利铂为主。
所有患者化疗后给予止吐,预防恶心、呕吐等消化道不良反应,同时给予保肝、水化、碱化及利尿等对症支持治疗。
1.3 随访
所有患者出院后,均采用门诊、电话、信函等方式进行随访。其中,随访频率为每年4次。2018年3月进行最后一次随访工作,其中最长随访时间为47个月,最短随访时间为1个月,失访率为0。将患者的病例编号、年龄、住院时间、住院天数、身高、体质量、住院KPS评分、心血管系统疾病史等基本资料,以及手术方式、热灌注的治疗次数、剂量药物等信息进行统计。
1.4 统计学分析
利用SPSS 23.0软件统计进行统计学分析。计数资料采用χ2检验,预后影响因素采用单因素ANOVA检验和Cox多因素回归分析,生存分析采用KaplanMeier法和Log rank检验。以P < 0.05为差异具有统计学意义。
2. 结果
研究组共31例患者,男10例,女21例;患者年龄范围为26~75岁,平均(57.91±5.75)岁;肉眼可见的残留病灶22例,肉眼未见的残留病灶9例。对照组53例患者,男24例,女29例。患者年龄范围为41~74岁,平均值等于(59.34±8.68)岁;肉眼可见的残留病灶35例,肉眼未见的残留病灶18例。两组PCI评分差异有统计学意义(P < 0.05),CCR评分、临床分期、病理分期、病理类型均无显著差异(P>0.05),见表 1。
表 1 胆囊癌患者的主要临床病理特征例 
研究组的患者中大部分接受3次热灌注化疗,8例接受胆肠吻合术,25例患者接受联合肝切除,手术中出血量超过4 U为12例(表 2)。
表 2 CRS+HIPEC治疗患者的相关治疗参数
2.1 生存分析比较
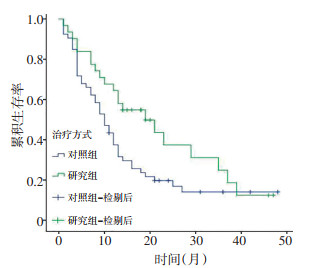
应用生存分析比较HIPEC疗法与常规化疗对患者总生存时间的影响。通过随访,我们收集了84例患者的预后资料,随访时间3~47个月。对照组的生存时间(14.93±2.09)个月,研究组生存时间为(21.72±2.96)个月,相较对照组,研究组的生存时间明显延长。两组比较差异具有统计学意义(P=0.044),见图 1。
2.2 影响胆囊癌伴腹膜转移预后的单因素分析
单因素生存分析显示影响预后因素为:肿瘤分化程度(P=0.001)、肿瘤分期(P=0.011)、CC(P=0.008)、HIPEC(P=0.045),见表 3。
表 3 胆囊癌伴腹膜转移预后的单因素分析
2.3 胆囊癌伴腹膜转移预后的多因素分析
进行Cox回归模型多因素分析显示:HIPEC、CCR评分、肿瘤分化程度、肿瘤分期为独立预后因素,见表 4。
表 4 胆囊癌伴腹膜转移预后的多因素分析
2.4 不良反应
对照组与研究组在白细胞减少、血红蛋白减少、血小板减少、胃肠道反应、肝功能损伤和肾功能损伤等不良反应方面的差异无统计学意义(P>0.05),见表 5。
表 5 两组不良反应比较例(%) 
2.5 并发症
在接受HIPEC时,部分患者有体温升高情况,大量出汗。保持通风、物理降温以及对症补液支持疗法后,状况会有所缓解。患者偶有恶心、呕吐及腹胀、腹痛症状,进行一般止痛、止吐及对症处理后,多数会缓解。本研究中,研究组发生较严重的并发症较少,肾功能不全1例治愈出院,肠瘘1例治愈出院。对照组肝功能不全1例,亦治愈出院。两组患者均未出现肠梗阻、肠黏连、腹膜炎及肝功能衰竭等严重并发症。
3. 讨论
胆囊癌的治疗效果差,目前外科手术切除是唯一可能治愈胆囊癌的治疗方法,新辅助疗法对胆囊癌的疗效仍不确切。虽然手术具有一定疗效,平均生存率得到改善,但5年生存率仍然较低[3]。据报道,约20%会发生腹腔种植转移。一旦形成腹膜转移,尚无十分有效的外科手段解决[4],而且由于血-腹膜屏障的存在,对全身化疗不敏感,患者生存期短,生活质量差,是威胁患者生命的严重并发症。腹膜转移主要源于自然因素或手术创伤因素所导致的癌肿脱落、转移淋巴结破裂、淋巴管癌栓破裂和癌栓破裂出血等形成的腹腔游离癌细胞(free cancer cell,FCC),FCC着床腹膜,形成微小癌灶、癌结节和广泛性腹膜转移结节[7-8]。HIPEC在预防与治疗胃癌、结直肠癌、卵巢癌、腹膜假性黏液瘤、腹膜恶性间皮瘤等腹腔恶性肿瘤的腹膜种植转移及其并发的恶性腹水方面,具有独特的疗效[9]。热疗具有通过抑制DNA复制、转录和修复必不可少的核基质介导的功能,选择性杀伤肿瘤细胞;还可加强化疗药物的细胞毒作用,并提高药物在组织间的渗透[10]。腹腔直接给药,细胞毒性药物可以增加与FCC接触的概率,最大限度地杀伤肿瘤细胞,减少全身静脉化疗引起的不良反应。一方面进入体循环,另一方面被吸收进入门静脉循环入肝,其对机体全身不良反应较轻。
本研究所选患者为胆囊癌伴有腹膜侵犯或转移的中晚期患者,研究组的生存时间为(21.72±2.96)个月,明显高于对照组的(14.93 ± 2.09)个月,提示HIPEC可有效延长患者生存时间,这与多项国内外的研究结果相近[11-12]。经过HIPEC+CRS治疗后,PCI评分的高低对患者的预后影响较小,这与以往腹膜假黏液瘤和结直肠癌的结果不一致[13-14],考虑可能与本研究的样本量偏低,并且胆囊癌的腹膜转移侵犯范围较小相关,需扩大样本量做进一步的验证。然而,CCR评分是影响患者的主要预后因素,0~1分的患者较2~3分的预后好。由此提示,胆囊癌患者虽有腹膜转移,但尽可能做到CCR-0分或CCR-1分,可以改善这部分患者的预后。
从不良反应来看,研究组与对照组比较差异无统计学意义,两组患者在术后1个月均接受了全身系统化疗,提示HIPEC并未增加不良反应的发生率。HIPEC的并发症发生率不高,1例肾功能不全的患者经积极治疗后,肾功能逐步改善出院。但有1例患者为胆囊癌结肠壁表面种植瘤,经过HIPEC治疗后,患者出现了肠瘘,发生率(3.23%)与常规胆囊癌手术的肠瘘发生率相当,属于可接受范围。在手术后对肠壁表面的破损、吻合口处进行更仔细的排查修补,可防止再次出现肠瘘。本研究中,有8例患者接受了胆肠吻合术,研究组无术后胆肠吻合口瘘,与文献报道结果相似[15]。因此本研究认为,HIPEC对胆肠吻合口瘘发生无明显影响。这部分患者中,有25例接受了部分肝切除术。研究组的肝功能与对照组比较无显著性差异,说明部分肝切除术后行HIPEC治疗是安全的。有研究报道,肝切除术后联合HIPEC并未增加术后肝功能衰竭的几率,因此是安全有效的[16]。总体而言,HIPEC不良反应较少,并发症发生率低,是安全可靠的。本研究不足在于,仅为单中心回顾性分析,样本量有限,需多中心临床研究来进一步验证。
综上所述,HIPEC+CRS治疗策略能为胆囊癌伴有腹膜转移或侵犯的患者带来明显的临床疗效,可延长患者生存时间,不良反应较小,对胆肠吻合口影响小,因此是安全的,值得推广应用。
-
表 1 胆囊癌患者的主要临床病理特征
例 
表 2 CRS+HIPEC治疗患者的相关治疗参数

表 3 胆囊癌伴腹膜转移预后的单因素分析

表 4 胆囊癌伴腹膜转移预后的多因素分析

表 5 两组不良反应比较
例(%) 
-
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1):7-30. DOI: 10.3322/caac.21387
[2] Hundal R, Schaffer EA. Gallbladder cancer:epidemiology and outcome[J]. Clin Epidemiol, 2014, 6:99-109. http://cn.bing.com/academic/profile?id=a330e677d7a7dd6f874f8e8bf4bc7ae9&encoded=0&v=paper_preview&mkt=zh-cn
[3] Radtke A, Königsrainer A. Surgical therapy of cholangiocarcinoma[J]. Visc Med, 2016, 32(6):422-426. DOI: 10.1159/000452921
[4] Wernberg JA, Lucarelli DD. Gallbladder cancer[J]. Surg Clin North Am, 2014, 94(2):342-360. http://d.old.wanfangdata.com.cn/Periodical/zhgdwk201712020
[5] Sasaki E, Nagino M, Ebata T, et al. Immunohistochemically demonstrated lymph node micrometastasis and prognosis in patients with gallbladder carcinoma[J]. Ann Surg, 2006, 244(1):99-105. DOI: 10.1097/01.sla.0000217675.22495.6f
[6] 李雁, 周云峰, 梁寒, 等.细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识[J].中国肿瘤临床, 2015, 42(4):198-206. DOI: 10.3969/j.issn.1000-8179.20150013 [7] 郝希山.细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识导读[J].中国肿瘤临床, 2015, 42(4):197. DOI: 10.3969/j.issn.1000-8179.20150184 [8] Yonemura Y, Kawamura T, Bandou E, et al. The natural history of free cancer cells in the peritoneal cavity[J]. Recent Results Cancer Res, 2007, 169:11-23. http://cn.bing.com/academic/profile?id=cf8f35fd6d93aff889e5b30f53a2b73d&encoded=0&v=paper_preview&mkt=zh-cn
[9] Arjona-Sanchez A, Muñoz-Casares C, Ortega-Salas R, et al. Long-term survival with peritoneal mucinous carcinomatosis from intraductal mucinous papillary pancreatic carcinoma treated with complete cytoreduction and hyperthermic intraperitoneal chemotherapy[J]. Int J Hyperthermia, 2014, 30(6):408-411. DOI: 10.3109/02656736.2014.952251
[10] Macrì A, Arcoraci V, Belgrano V, et al. Short-term outcome of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy:preliminary analysis of a multicentre study[J]. Anticancer Res, 2014, 34(10):5689-5693. http://cn.bing.com/academic/profile?id=3259d327554a07caad388172f28b6eee&encoded=0&v=paper_preview&mkt=zh-cn
[11] Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patien with peritoneal carcinomatosis from gastric cancer:final results of a phase HI randomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6):1575-1581. DOI: 10.1245/s10434-011-1631-5
[12] Cashin PH, Graf W, Nygren P, et al. Intraoperative hyperthermic versus postoperative normothermic intraperitoneal chemotherapy for colonic peritoneal carcinomatosis:a case-control study[J]. Ann Oncol, 2012, 23(3):647-652. DOI: 10.1093/annonc/mdr301
[13] 李鑫宝, 林育林, 姬忠贺, 等.肿瘤细胞减灭术加腹腔热灌注化疗治疗腹膜假黏液瘤182例分析[J].中国肿瘤临床, 2018, 45(18):943-949. DOI: 10.3969/j.issn.1000-8179.2018.18.607 [14] 黄超群, 周云峰, 谢丛华, 等.细胞减灭术加腹腔热灌注化疗治疗结直肠癌腹膜转移癌病例对照研究[J].中国肿瘤临床, 2013, 40(16):979-983. DOI: 10.3969/j.issn.1000-8179.20130155 [15] Hakia E, Efstathiou E, Rogdakis A, et al. Digestive fistulas after cytoreductive surgery & HIPEC in peritoneal carcinomatosis[J]. J BUON, 2015, 20(Suppl 1):S60-S63. http://cn.bing.com/academic/profile?id=15b35adc227fe698898bc4238bb6d429&encoded=0&v=paper_preview&mkt=zh-cn
[16] 何坤, 胡泽民, 阮嘉后, 等.肝切除联合腹腔热灌注化疗在肝癌自发破裂出血中的应用[J].肝胆胰外科杂志, 2017, 29(6):464-467. http://d.old.wanfangdata.com.cn/Periodical/gdywkzz201706007 -
期刊类型引用(3)
1. 周哲,杨越,杨自逸,龚伟. 微创入路胆囊癌根治术的进展与争议. 中华外科杂志. 2024(04): 278-283 .  百度学术
百度学术
2. 中国恶性肿瘤整合诊治指南:胆囊癌. 肿瘤. 2022(03): 188-202 .  百度学术
百度学术
3. 陈旭旭. 细胞减灭术联合腹腔热灌注对胃肠癌腹膜转移患者的治疗效果分析. 黑龙江科学. 2021(22): 50-51 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: