Application of an interim 18F- FDG PET/CT interpretation method for evaluating the prognosis of diffuse large B-cell lymphoma
-
摘要:目的 探讨中期正电子发射型计算机断层显像(positron emission tomography-computed tomography,PET-CT)Deauville五分法(Deauville five-point scale,5-PS)与最大标准摄取值缩减率(maximum standard uptake value variation,△SUVmax)两种图像判读法在弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)患者预后评估中的应用价值。方法 回顾性分析2012年10月至2018年6月重庆医科大学附属第一医院收治的94例DLBCL患者资料。采用Kaplan-Meier法及Cox比例风险回归模型进行生存资料分析,计算并采用χ2检验比较5-PS和△SUVmax对DLBCL患者预后预测的能力。结果 5-PS和△SUVmax分别以4分、86%进行分组。5-PS < 4分组、△SUVmax ≥ 86%组的患者无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)均优于5-PS ≥ 4分组、△SUVmax < 86%组的患者(P < 0.05)。△SUVmax与5-PS对患者PFS和OS均有影响,较高的阴性预测值(89.4%,93.6%;76.1%,85.9%),较低的阳性预测值(48.9%,31.9%;47.8%,34.8%),并且△SUVmax对于患者的敏感性优于5-PS(82.1%,83.3%vs.39.3%,44.4%)。单因素分析中国际预后指数(international prognostic index,IPI)(P=0.007)、△SUVmax(P < 0.001)、5-PS(P=0.014)及基线全身肿瘤代谢体积(total metabolic tumor volume,TMTV)(P=0.001)与PFS相关,△SUVmax(P=0.014)、5-PS(P=0.033)、TMTV(P=0.004)与OS相关;多因素分析显示TMTV是OS的独立预测因子(P=0.005),△SUVmax和TMTV是PFS的独立预测因子(P=0.002,P=0.020),并且△SUVmax < 86%且高水平TMTV患者较低TMTV患者的PFS明显缩短(P=0.001)。结论 5-PS和△SUVmax均能初步评估DLBCL患者预后,但△SUVmax具有更高的预测价值,并且联合基线TMTV可以对DLBCL患者进行再次危险度分层。
-
关键词:
- 弥漫性大B细胞淋巴瘤 /
- 正电子发射型计算机断层显像 /
- 预后 /
- 最大标准摄取值
Abstract:Objective To investigate the role of the Deauville five-point scale (5-PS) and maximum standard uptake value variation (△ SUVmax) measures of interim positron emission tomography/computed tomography (PET-CT) in the prognosis evaluation of patients with diffuse large B-cell lymphoma (DLBCL).Methods A total of 94 patients with histologically confirmed DLBCL at The First Affiliated Hospital of Chongqing Medical University from October 2012 to June 2018 were enrolled in this retrospective study. Clinical characteristics and prognostic factors of patients were analyzed. Survival data were analyzed using the Kaplan-Meier method and Cox proportional hazards model. The prognostic value of △SUVmax and 5-PS in patients with DLBCL was evaluated using the Chi-square test.Results 5-PS and △SUVmax were grouped by scores of 4 and 86%, respectively. Progression free survival (PFS) and overall survival (OS) were longer in the 5-PS score < 4 group than in the 5-PS score ≥4 group. Patients in the △SUVmax ≥86% group had better PFS and OS than those in the △SUVmax < 86% group (P < 0.05). △SUVmax and 5-PS measures had high negative predictive values (89.4% and 93.6%, respectively; 76.1% and 85.9%, respectively) and low positive predictive values (48.9% and 31.9%, respectively; 47.8% and 34.8%, respectively) for PFS and OS. △SUVmax was more sensitive than 5-PS for the corresponding parameters (82.1% vs. 39.3% and 83.3% vs. 44.4%, respectively). Univariate analysis showed that international prognostic index (IPI) (P=0.007), △SUVmax (P < 0.001), 5- PS (P=0.014) and baseline total metabolic tumor volume (TMTV) (P=0.001) were associated with PFS. △SUVmax (P=0.014), 5-PS (P= 0.033), and TMTV (P=0.004) were related to OS. Multivariate analysis showed that TMTV was an independent predictor of OS (P= 0.005). △SUVmax and TMTV were independent predictors of PFS (P=0.002, P=0.020). The PFS of patients with △SUVmax < 86% and high TMTV was significantly shorter than that of those with △SUVmax < 86% with low TMTV (P=0.001).Conclusions 5-PS and △SUVmax can be used to evaluate the prognosis of DLBCL patients. However, the predictive value of △SUVmax was higher than that of 5- PS, and combining △SUVmax with baseline TMTV could further stratify the risk of DLBCL patients. -
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)最常见的病理亚型,约占NHL的30%~40%[1]。DLBCL有高度的侵袭性及较强的异质性,患者预后水平存在差异[2]。为了及时了解患者对当前化疗方案的敏感程度并对患者的预后水平进行预判,DLBCL患者需在化疗中期(化疗2~4个周期)进行全身评估[3]。
18氟-脱氧葡萄糖正电子发射型计算机断层显像(18F-fluorodeoxyglucose positron emission tomography-computed tomography,18F-FDG PET-CT)不依赖于肿瘤形态学的变化,比其他影像检查方法更早、更准确地反映DLBCL患者的全身情况,是DLBCL患者进行中期评估首选的检查方法[4]。目前,中期18F-FDG PET-CT图像常采用Deauville五分法(Deauville fivepoint scale,5-PS)进行判读,但5-PS仅为一种视觉定性分析方法,受主观因素影响较大,可能会造成结果的偏差[5-6]。研究发现最大标准摄取值(maximum standarized uptake value,SUVmax)是能够反映肿瘤代谢的18F-FDG PET-CT半定量指标,通过病灶基线与中期的SUVmax缩减率(maximum standard uptake value variation,△SUVmax),其是否较5-PS更加有效地反映患者疾病变化情况目前尚未明确。本研究通过回顾性分析94例DLBCL患者的相关资料,探讨中期18F-FDG PET/CT Deauville五分法与△SUVmax两种图像判读法在DLBCL患者预后评估中的价值。
1. 材料与方法
1.1 病例资料
回顾性分析2012年10月至2018年6月重庆医科大学附属第一医院收治的94例DLBCL患者资料。其中男性38例,女性56例,中位年龄为57(21~ 84)岁。入组标准:1)确诊的初治DLBCL患者;2)治疗前(基线)及治疗2~4个周期后(中期)均完成18FFDG PET-CT检查;3)基线18F-FDG PET-CT显像有阳性病灶;4)无合并其他肿瘤病史。
1.2 方法
1.2.1 18F- FDG PET- CT显像方法
采用Philips Gemini TF 64 PET-CT对患者进行扫描,其中18F-FDG由重庆医科大学附属第一医院回旋加速器生产,放化纯度>90%。患者检查前需禁食至少6 h,空腹血糖≤7.0 mmol/L,18F-FDG注射剂量按照3.70~5.55 MBq/kg计算。图像采集范围从颅顶至股骨上段,先行CT扫描,后采集PET代谢图像。CT参数:层厚4.0 mm,电流100 mA,电压120 kV;PET参数:4D扫描,层厚4.0 mm,每个床位采集3~5 min。
1.2.2 18F-FDG PET-CT图像分析方法
18F-FDG PETCT显像图像由两位资深核医学科医师单独阅片,若结果不一致,则由科室医师会诊决定最终结果。采用系统3D ROI对每个病灶进行自动勾画(以41%SUVmax为阈值[7]),记录病灶的SUVmax、肿瘤代谢体积(metabolic tumor volume,MTV)等数据。若基线或中期18F-FDG PET-CT图像有多个病灶,则SUVmax取值均为放射性摄取最高病灶(优势病灶)的数值;若中期图像无明显异常摄取,则选择与基线优势病灶相同部位测量中期SUVmax。基线全身肿瘤代谢体积(total metabolic tumor volume,TMTV)是基线每个病灶的MTV之和。
5-PS评分标准[8]:1分为无明显异常摄取病灶;2分为病灶摄取程度≤纵隔血池;3分为纵隔血池 < 病灶摄取程度≤肝脏;4分为病灶摄取程度>肝脏;5分为病灶摄取程度>肝脏摄取程度2倍以上或有新发病灶,并以病灶摄取程度大于肝脏定义为阳性[9],即5-PS≥ 4分为阳性,5-PS < 4分为阴性。△SUVmax计算方法[10]:△SUVmax=(基线SUVmax-中期SUVmax)/基线SUVmax×100%。
1.2.3 随访及观察事件
本研究所有病例均采用电话随访,随访日期截至2019年6月30日。观察指标为无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)。PFS是指患者从确诊至疾病复发、进展或末次随访的时间;OS是指患者从确诊至死亡或末次随访的时间。疾病复发或进展根据随访过程中的组织病理学检查及影像学检查结果判定。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。△SUVmax、TMTV的最佳截断值利用ROC曲线确定。采用Kaplan-Meier、Log-rank进行组间生存分析,计算并采用χ2检验比较5-PS和△SUVmax对患者预后预测的敏感性、特异性、阳性预测值、阴性预测值的差异。预后单、多因素分析采用Cox比例风险回归模型,P < 0.05的单因素指标纳入多因素分析。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 病例临床特征
94例患者中≥60岁42例;国际预后指数(international prognostic index,IPI)评分中高危、高危组(≥3分)39例,低危、低中危组(< 3分)55例;Ann Arbor分期Ⅰ~ Ⅱ期38例,Ⅲ~Ⅳ期56例;结外病灶数≥2个44例, < 2个50例;乳酸脱氢酶(lactate dehydrogenase,LDH)水平升高40例,正常范围54例(表 1)。
表 1 94例DLBCL患者临床资料
2.2 随访结果
94例患者中位随访时间为24.6(7.9~81)个月;28例患者出现疾病复发或进展,中位时间为8.4(3.9~25.5)个月;18例患者死亡,病理确诊至死亡的中位时间为15.3(7.9~43.3)个月。
2.3 18F-FDG PET-CT定量参数分组结果
利用ROC曲线求得△SUVmax和TMTV在PFS和OS中的截断值分别为86%和86%,116 cm3和137.6 cm3。因此对于PFS分组方法:△SUVmax <86%为阳性组,≥86%为阴性组;TMTV≥116 cm3为高水平TMTV组, < 116 cm3为低水平组。同理,OS的分组方法:△SUVmax <86%为阳性组,≥86%为阴性组;TMTV≥137.6 cm3为高水平TMTV组, < 137.6 cm3为低水平组。
2.4 中期18F-FDG PET-CT图像判读结果与预后关系
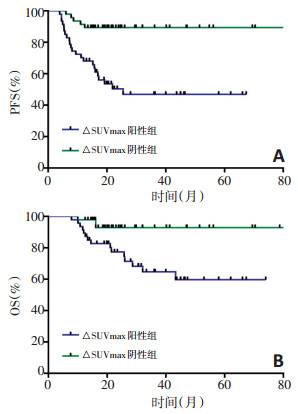
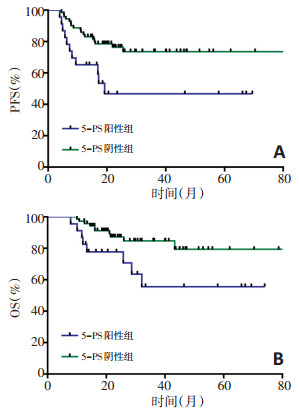
为探究两种图像判读法与预后的关系,进行组间生存曲线分析。△SUVmax阳性组中疾病复发或进展率为48.9%(23/47),死亡率为31.9%(15/47);阴性组复发或进展率为10.6%(5/47),死亡率为6.4%(3/47),阳性组与阴性组之间PFS和OS差异具有统计学意义(P < 0.001,P=0.007,图 1);5-PS阳性组疾病复发或进展率为47.8%(11/23),死亡率为34.8%(8/23);阴性组复发或进展率为23.9%(17/71),死亡率14.1%(10/71),两组组间预后差异显著(P=0.011,P=0.026,图 2)。由上述结果可得△SUVmax和5-PS均能有效对DLBCL患者PFS和OS情况进行分层,表明中期18F-FDG PET-CT阴性组患者预后均优于阳性组患者。
2.5 △SUVmax与5-PS对DLBCL患者预后预测的比较
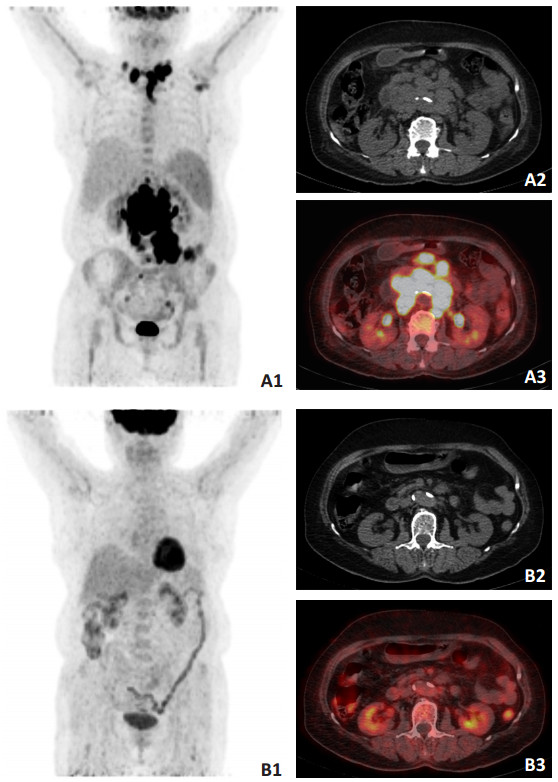
为进一步探究更适合评估DLBCL患者预后的图像判读方法,分别以PFS和OS为观察目标进行分析。△SUVmax和5-PS对患者预后预测的阳性预测值较低,阴性预测值较高;5-PS具有较高的特异性和过低的敏感性,而△SUVmax在敏感性明显优于5-PS的同时还具有较高的特异性(表 2)。同时,展现了△SUVmax和5-PS的差异(图 3),该患者中期△SUVmax判读为阳性而5-PS判读为阴性,但在随访15.2个月后疾病复发。上述研究结果均说明△SUVmax更能兼顾敏感性和特异性。
表 2 △SUVmax与5-PS对PFS和OS的预测
2.6 预后因素分析
单因素分析结果显示,与PFS相关的指标是IPI评分(P=0.007)、△SUVmax(P < 0.001)、5-PS(P=0.014)及TMTV(P=0.001),而性别、年龄、Ann Arbor分期、结外病灶数量、LDH水平均无统计学意义,并且△SUVmax(P= 0.014)、5-PS(P=0.033)、TMTV(P=0.004)也与OS显著相关(表 3)。Cox多因素分析中,△SUVmax(P=0.002,HR=4.937)与TMTV(P=0.020,HR=4.214)是DLBCL患者PFS的独立预测因子,且△SUVmax(P=0.054,HR= 3.705)、TMTV(P=0.005,HR=17.677)均与OS存在关联(表 4),但由于△SUVmax的P>0.05,故后续未联合△SUVmax和TMTV对OS进行分析。
表 3 94例DLBCL患者PFS和OS的单因素分析 表 4 94例DLBCL患者PFS和OS的多因素分析
表 4 94例DLBCL患者PFS和OS的多因素分析
2.7 △SUVmax联合TMTV对PFS的预测模型
基于Cox多因素分析结果建立中期△SUVmax联合基线TMTV对PFS预测的新模型。中期△SUVmax < 86%的阳性组患者,若基线TMTV属于高水平,则患者PFS明显比低水平TMTV的患者缩短(P=0.001);而对于△SUVmax≥86%的阴性组患者,高基线TMTV与低基线TMTV的患者PFS无显著性差异(表 5)。
表 5 中期△SUVmax联合基线TMTV模型对PFS的预测
3. 讨论
本研究分别采取△SUVmax、5-PS对中期18FFDG PET-CT图像进行判读,结果提示中期18F-FDG PET-CT阳性组患者(△SUVmax < 86%或5-PS≥4分)预后水平明显低于阴性组患者(△SUVmax≥86%或5-PS < 4分),表明两种图像判读法均可对其预后进行初步评估。△SUVmax和5-PS两者对PFS和OS都有较高的阴性预测值和较低的阳性预测值,并且△SU Vmax敏感性高于5-PS,与TMTV是PFS的独立预测因子。联合△SUVmax和TMTV两个指标进行分析,结果表明对于中期18F-FDG PET-CT阳性的患者(△SUVmax < 86%),基线TMTV低水平患者的PFS优于TMTV高水平患者。△SUVmax和5-PS分别是反映病灶摄取程度的定量和定性指标。因此,凡能影响病灶摄取程度的因素对结果均可能造成影响。Adams等[6]指出化疗所致的炎症反应会导致病灶摄取程度增高,并且难以准确评估位于生理性摄取程度较高部位(如口咽、鼻咽和肝脏等)中残存病灶的摄取情况,因此会造成判读的误差[9],这可能是导致两种图像判读法阳性预测值较低的原因。从单个指标的敏感性及特异性分析,5-PS具有比△SUVmax更高的特异性,可能有下述原因:1)由于大部分DLBCL患者化疗中期效果良好,因此5-PS阴性组与阳性组例数差异较大(n=71 vs. n=23);2)以4分为分组依据仍存争议,Kim等[11]认为仅将5分归为阳性组而1~4分归为阴性组可以提高对PFS预测的特异性及阳性预测值(74.8% vs. 96.4%;34.9% vs. 71.4%),原因是评分为4分可能受炎症影响所致,并不能真正代表残存肿瘤活性。而本研究5-PS阳性组中5分的例数较多(18/23),存在争议的4分例数较少(5/23),因此受上述原因影响较小因而特异度较高;3)基线SUVmax < 10可能会造成△ SUVmax的假阳性率增高[12],虽然DLBCL为亲FDG的淋巴瘤类型,但本研究中仍有6例患者基线SUVmax < 10,可能是△SUVmax特异性低于5-PS的原因之一。虽然5-PS在本次研究中特异性高但敏感性过低,不利于对高风险患者进行筛选,并且肝脏和纵隔血池的摄取程度也会影响5-PS的图像判读结果,而△SUVmax相较于5-PS能更好地兼顾敏感性及特异性,并且可以动态反映治疗前后病灶摄取情况,因此更加客观、准确,是评估DLBCL患者预后更好的指标。
在DLBCL患者预后因素分析中,△SUVmax比5-PS更有优势,但部分研究[9, 13]持有不同意见。Zhang等[9]认为5-PS(≥4分或 < 4分)是影响DLBCL患者PFS的独立预测因子(P=0.020,HR=5.280),在PFS评估中的表现优于△SUVmax。Winter等[13]认为△SUVmax≤66%与>66%的DLBCL患者PFS和OS无显著差异(P=0.760,P=0.790)。本研究结果不一致的主要原因:1)△SUVmax的分组截断值不同,上述研究均直接采用66%作为截断值,而本研究采用ROC曲线求得截断值是由于图像重建方法、感兴趣区测量手法、纳入患者异质性等多个因素的影响。目前,△SUVmax的截断值尚未统一,约为62.0%~ 91.8%[14-18],本研究采用86%作为截断值,处于该区间范围内,并且与Zhang等[14]分组截断值具有一致性;2)样本量的差异也可能造成影响(n=94 vs. n= 46)。此外,对于中期18F-FDG PET-CT △SUVmax < 86%的患者可以结合基线TMTV水平的高低对患者进行进一步危险度分层:若患者基线TMTV处于高水平,表明该患者肿瘤负荷重,疾病侵袭程度高,疾病复发或进展的风险明显高于TMTV低水平患者。但在关于OS的多因素分析中,△SUVmax不是预测OS的独立影响因素,原因为:1)对病例随访时间不够长,达到终点事件的病例较少(n=18);2)中期18FFDG PET-CT结果更多反映的是某个时刻的肿瘤代谢情况,而且通过后期加强治疗或者更换治疗方案也可以影响OS。本研究为了更加严谨,未进一步联合△SUVmax和TMTV对OS进行分析。
虽然本研究肯定了△SUVmax的价值,但也存在一定的局限性:1)Schoder等[19]认为化疗2个周期进行18FFDG PET-CT扫描的评估效果可能优于化疗4个周期,但本文由于回顾性研究的限制,不能对患者进行统一评估;2)纳入患者的治疗方案不完全一致也是影响因素之一。虽然利妥昔单抗是治疗DLBCL患者重要的靶向药物,但本研究中1例患者因为CD20阴性以及9例患者因为经济或其他因素而未使用该药物;3)△SUVmax仅能反映病灶的最大代谢活性变化情况,而患者的预后受疾病自身特性、治疗方案、身体基础情况等多个方面影响,因此对患者的预后评估还需结合其他相关指标进行综合考量;4)纳入患者至少进行2次18F-FDG PETCT检查,而每次扫描时患者血糖水平、从注射药物到实际扫描时间的长短等潜在因素也会对结果造成影响。因此,亟需更多的前瞻性、多中心、大样本的研究对此进行探讨。
综上所述,5-PS和△SUVmax均为评估DLBCL患者预后的有效指标,但是△SUVmax能兼顾敏感性及特异性,是DLBCL患者PFS的独立影响因素。因此,△SUVmax是评估DLBCL患者中期18F-FDG PETCT图像更好的指标,并且△SUVmax联合基线TMTV可以对DLBCL患者进行进一步危险度分层。
-
表 1 94例DLBCL患者临床资料

表 2 △SUVmax与5-PS对PFS和OS的预测

表 3 94例DLBCL患者PFS和OS的单因素分析

表 4 94例DLBCL患者PFS和OS的多因素分析

表 5 中期△SUVmax联合基线TMTV模型对PFS的预测

-
[1] Cheson BD. PET/CT in Lymphoma:current overview and future directions[J]. Semin Nucl Med, 2018, 48(1):76-81. DOI: 10.1053/j.semnuclmed.2017.09.007
[2] Jiang M, Chen P, Ruan X, et al. Interim (18) F-FDG PET/CT improves the prognostic value of S-IPI, R-IPI and NCCN-IPI in patients with diffuse large B-cell lymphoma[J]. Oncol Lett, 2017, 14(6):6715-6723. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3555293/
[3] Lavi N, Shapira G, Zilberlicht A, et al. Integration of CT-based measurements into surveillance PET/CT in patients with diffuse large B cell lymphoma[J]. Isr Med Assoc J, 2016, 18(7):411-417. http://cn.bing.com/academic/profile?id=9d78ddc7a5bcfb7f58c74363c4c67adb&encoded=0&v=paper_preview&mkt=zh-cn
[4] Ladetto M, Buske C, Hutchings M, et al. ESMO consensus conference on malignant lymphoma:general perspectives and recommendations for prognostic tools in mature B-cell lymphomas and chronic lymphocytic leukaemia[J]. Ann Oncol, 2016, 27(12):2149-2160. http://cn.bing.com/academic/profile?id=50e3b2b49858268e2dcc70717eb1f42f&encoded=0&v=paper_preview&mkt=zh-cn
[5] Barrington SF, Johnson P.(18) F-FDG PET/CT in lymphoma:has imagingdirected personalized medicine become a reality[J]?J Nucl Med, 2017, 58(10):1539-1544. DOI: 10.2967/jnumed.116.181347
[6] Adams H, Kwee TC. The deauville criteria cannot differentiate between responding and non-responding non-Hodgkin lymphoma patients[J]. Ann Hematol, 2018, 97(4):719-720. DOI: 10.1007/s00277-017-3202-8
[7] Boellaard R, Delgado-Bolton R, Oyen WJ, et al. FDG PET/CT:EANM procedure guidelines for tumour imaging:version 2.0[J]. Eur J Nucl Med Mol Imaging, 2015, 42(2):328-354. DOI: 10.1007/s00259-014-2961-x
[8] Meignan M, Gallamini A, Meignan M, et al. Report on the first international workshop on interim-PET-scan in lymphoma[J]. Leuk Lymphoma, 2009, 50(8):1257-1260. DOI: 10.1080/10428190903040048
[9] Zhang XY, Song L, Wang PJ, et al. Prognostic value of pre-autologous stem cell transplantation PET/CT in diffuse large B-cell lymphoma:The deauville score is prognostically superior to delta SUVmax[J]. Acta Haematol, 2019:1-7.
[10] 朱海燕, 李菲, 赵瑜, 等.组合临床国际预后指数、病理免疫分型及中期PET/CT建立的模型在弥漫大B细胞淋巴瘤预后评估中的应用[J].中国医学影像学杂志, 2019, 27(4):298-301. DOI: 10.3969/j.issn.1005-5185.2019.04.014 [11] Kim J, Song YS, Lee JS, et al. Risk stratification of diffuse large B-cell lymphoma with interim PET-CT based on different cutoff Deauville scores[J]. Leuk Lymphoma, 2018, 59(2):340-347. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=10.1080/10428194.2017.1339877
[12] Meignan M, Gallamini A, Itti E, et al. Report on the third international workshop on interim positron emission tomography in lymphoma held in menton, France, 26-27 september 2011 and menton 2011 consensus[J]. Leuk Lymphoma, 2012, 53(10):1876-1881. DOI: 10.3109/10428194.2012.677535
[13] Winter A, Rybicki L, Shah SN, et al. Prognostic value of pre-transplant PET/CT in patients with diffuse large B-cell lymphoma undergoing autologous stem cell transplantation[J]. Leuk Lymphoma, 2018, 59(5):1195-1201. DOI: 10.1080/10428194.2017.1369065
[14] Zhang YY, Song L, Zhao MX, et al. A better prediction of progression-free survival in diffuse large B-cell lymphoma by a prognostic model consisting of baseline TLG and Delta SUVmax[J]. Cancer Med, 2019, 8(11):5137-5147. DOI: 10.1002/cam4.2284
[15] 朱璐婷, 岑溪南, 欧晋平, 等.中期18F-FDG PET/CT显像不同评价方法对弥漫大B细胞淋巴瘤患者预后判断价值[J].中国实验血液学杂志, 2017, 25(2):431-437. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgsyxyxzz201702022 [16] Casasnovas RO, Meignan M, Berriolo-Riedinger A, et al. SUVmax reduction improves early prognosis value of interim positron emission tomography scans in diffuse large B-cell lymphoma[J]. Blood, 2011, 118(1):37-43. DOI: 10.1182/blood-2010-12-327767
[17] Li X, Sun X, Li J, et al. Interim PET/CT based on visual and semiquantitative analysis predicts survival in patients with diffuse large B-cell lymphoma[J]. Cancer Med, 2019, 8(11):5012-5022. DOI: 10.1002/cam4.2404
[18] Yang DH, Ahn JS, Byun BH, et al. Interim PET/CT-based prognostic model for the treatment of diffuse large B cell lymphoma in the postrituximab era[J]. Ann Hematol, 2013, 92(4):471-479. DOI: 10.1007/s00277-012-1640-x
[19] Schoder H, Zelenetz AD, Hamlin P, et al. Prospective study of 3'-deoxy-3'-18f-fluorothymidine pet for early interim response assessment in advanced-stage b-cell lymphoma[J]. J Nucl Med, 2016, 57(5):728-734. DOI: 10.2967/jnumed.115.166769
-
期刊类型引用(1)
1. 董佳佳,桑士标. ~(18)F- FDG PET/CT在老年DLBCL患者诊疗中的临床应用价值. 标记免疫分析与临床. 2022(04): 565-569 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: