-
摘要:目的 探究MEX3A基因在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表达水平及沉默MEX3A基因后对NSCLC增殖、侵袭、迁移和凋亡及周期的影响。方法 通过mRNA转录组分析及癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库信息分析,筛选出在NSCLC中显著高表达的MEX3A基因。通过qRT-PCR检测MEX3A在4种常见NSCLC细胞系中的mRNA表达水平,发现MEX3A在A549和NCI-H292中显著高表达。利用RNA干扰技术(RNA interference,RNAi)沉默A549和NCI-H292中MEX3A的表达,CCK8及Transwell试验检测沉默MEX3A表达后对NSCLC增殖、侵袭及迁移的影响,流式细胞术分析沉默MEX3A表达后对A549和NCI-H292细胞周期及凋亡的影响。结果 MEX3A在A549和NCI-H292中高表达。沉默MEX3A后NSCLC增殖、侵袭及迁移被显著抑制,细胞周期阻滞于G2/M期,促进细胞凋亡。结论 MEX3A作为NSCLC的促癌基因,参与了NSCLC的生长及增殖过程。Abstract:Objective To investigate the expression of MEX3A in non-small cell lung cancer (NSCLC) cells and the effects of MEX3A knockout on cell cycle, proliferation, invasion, migration, and apoptosis.Methods We screened out MEX3A, which was significantly highly expressed, by mRNA microarray and The Cancer Genome Atlas (TCGA) database information analysis. Quantitative real-time polymerase chain reaction (qRT- PCR) was used to detect the expression level of MEX3A in NSCLC cells. A549 and NCI- H292 cells showed high expression of MEX3A. RNA interference (RNAi) method was used to silence MEX3A in A549 and NCI- H292 cells. Cell counting kit-8 (CCK8) and Transwell assays were used to determine the effects of MEX3A knockout on proliferation, invasion, and migration in NSCLC cells. Flow cytometry was used to analyze the effects of MEX3A knockout on cell cycle and apoptosis.Results A549 and NCI-H292 cells showed high expression of MEX3A. After silencing MEX3A, the proliferation, invasion, and migration of NSCLC cells were significantly decreased, while the cell cycle was blocked at G2/M phase and its apoptotic ability was weakened.Conclusions MEX3A may play an important role as an oncogene in the growth and proliferation of NSCLC cells.
-
在过去30年间,中国肺癌相关死亡上升了4倍以上[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌相关死亡约80%[2]。NSCLC的发生和发展通常与肿瘤相关基因的表达有关。因此,寻找NSCLC新的分子生物学标志物并将其作为NSCLC诊断及治疗靶点至关重要。
MEX3A蛋白是一种RNA结合蛋白,其N端具有高度保守的KH结构域[3-4],MEX3A通过KH结构域与mRNA联合,介导mRNA的翻译、监控和降解过程[5],进而调节细胞的一系列功能。已有研究表明,MEX3A在膀胱癌、胃癌[6]、肾母细胞瘤[7]、膀胱尿路上皮癌[8]以及肝癌[9]中异常表达,但MEX3A在NSCLC中的作用及功能却鲜有研究。据此,本文探究了MEX3A在NSCLC中的表达效果以及沉默MEX3A基因后对NSCLC发生和发展的影响。
1. 材料与方法
1.1 材料
1.1.1 转录组芯片分析及TCGA数据库数据分析
利用转录组芯片分析技术,对云南省肿瘤医院收集的15例宣威地区的肺癌样本(癌和癌旁组织)进行mRNA转录组芯片分析,通过芯片制备、杂交反应、信号检测、数据分析,筛选出差异基因。对来自癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库中共226例肺腺癌样本与20例正常组织样本进行RNA序列分析。
1.1.2 细胞系与细胞培养
人NSCLC细胞系A549、NCI-H292及人正常的肺上皮细胞系BEAS-2B均购自昆明动物研究所细胞中心,XWLC和GLC均受赠于云南省肿瘤医院。A549、NCI-H292和BEAS-2B细胞均在RPMI- 1640培养基(Hyclone,美国)中培养,XWLC和GLC在DMEM高糖培养基(Hyclone,美国)中培养,每种培养基中均添加10%胎牛血清(Hyclone,美国)、100 g/mL青霉素和100 g/mL链霉素(Hyclone,美国)。所有细胞均培养在37℃、5%CO2的恒温培养箱中培养。
1.2 方法
1.2.1 细胞转染
选取MEX3A高表达的A549和NCI-H292细胞系进行转染。细胞以5×104/孔接种于培养皿中,培养24 h后,更换为不含抗生素的培养基,用脂质体RNAiMAX(Invitrogen,美国)将MEX3A的靶向抑制剂小干扰RNA(siMEX3A:5'- GCAAGAUCCUCGAGUACAATT-3',上海吉玛公司)和阴性对照siRNA(siNC:5'-UUCUCUCUC CGAACGUGUCUCUCUGACGUTU TT-3',上海吉玛公司)转染至细胞,转染后继续培养48 h以待分析。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)
根据试剂盒说明,提取细胞总RNA并将其反转录为cDNA(PrimeScriptTM RT反转录试剂盒,Takara,中国)。人GAPDH用作内参基因,qRT-PCR监测MEX3A在BEAS-2B、NCI-H292、A549、XWLC和GLC细胞中的表达水平。引物序列见表 1。
表 1 引物序列
1.2.3 细胞增殖试验
将3 000/孔细胞悬液接种在96孔板(Corning Costar,美国)中,设置3个复孔,分别在转染24、48和72 h后中加入10 μL CCK8试剂(Dojindo Laboratories,Kumamoto,日本),加入CCK8试剂2.5 h后,3 h内每隔30 min用多功能酶标仪测量细胞OD 450 nm处的吸光度。
1.2.4 Transwell试验
在Transwell小室(Corning Costar,美国)中铺好10 μL的基质胶(25 mg/50 mL,BD Biosciences,美国),在无血清培养基培养细胞12 h,然后以30 000/孔将细胞接种到Transwell小室的上室中,下室用含20%胎牛血清的培养基作为诱导物,37℃培养48 h,去除培养基并用4%多聚甲醛(生工生物工程有限公司,上海)固定细胞,0.1%吉姆萨染液(北京索莱宝科技有限公司,北京)染色细胞。细胞迁移测定在相同条件下进行,上室不覆盖基质胶。最后所有细胞均于10×10倍显微镜下观察拍照。
1.2.5 细胞周期与凋亡试验
细胞周期试验:收集并纯化细胞,70%预冷的乙醇(生工生物工程有限公司,上海)固定细胞12 h,PBS洗去乙醇,与核糖核酸酶A(10 mg/mL,BD Biosciences,美国)37℃反应30 min,碘化丙啶(10 μg/mL,BD Biosciences,美国)避光染色30 min。流式细胞仪(BD Biosciences,美国)分析细胞周期,采用FlowJo 7.61软件评估G0-G1、S和G2-M期细胞的百分比。
细胞凋亡试验:用不含EDTA的胰酶消化细胞,无双抗的培养基终止消化,收集并重悬细胞,分别加5 μL碘化丙啶和5 μL Annexin V-FITC染液(细胞凋亡试剂盒,BD Biosciences,美国)避光染色20 min。流式细胞仪分析细胞凋亡。
1.3 统计学分析
采用SPSS 16.0和GraphPad Prism 5.0软件进行统计学分析。t检验用于比较组间差异。以P<0.05为差异具有统计学意义。
2. 结果
2.1 MEX3A在NSCLC中高表达
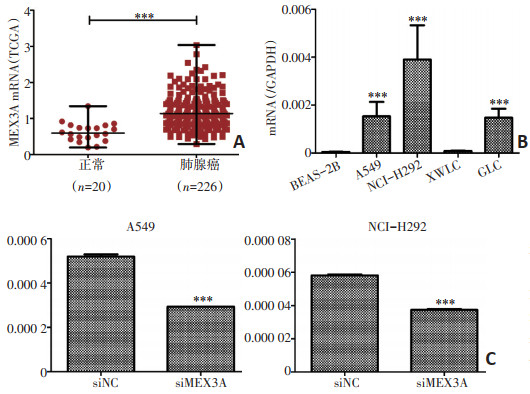
本研究对在云南省肿瘤医院收集的15例宣威地区肺癌样本(癌和癌旁组织)进行mRNA转录组芯片分析(表 2),共筛选出2 724个差异表达的基因,606个基因的mRNA表达水平显著上调,2 118个基因的mRNA表达水平显著下调。表达上调的基因中,MEX3A、ARHGAP40、GPR110、FLJ13744、PSAT1、B3GNT6、FUT2、MND1、CXCL13、MUC21上调倍数均高于6倍(P<0.05,表 3)。通过筛查基因背景后,选择表达效果明显的MEX3A基因(P<0.01,表 3)作为研究对象。对TCGA数据库数据进行统计分析显示,与正常组织(n=20)相比,MEX3A mRNA在肺腺癌组织(n=226)中显著高表达(P<0.001,图 1A)。
表 2 新鲜组织样本临床病理资料 表 3 mRNA转录组芯片筛选出在NSCLC中上调的mRNAs
表 3 mRNA转录组芯片筛选出在NSCLC中上调的mRNAs
qRT-PCR结果显示,与癌旁细胞系BEAS-2B相比,A549、NCI-H292细胞系中MEX3A mRNA表达水平显著高于BEAS-2B(P<0.001,图 1B)。此外,qRTPCR结果显示沉默MEX3A(siMEX3A)后,A549和NCI-H292的MEX3A的mRNA表达水平显著降低(P<0.001,图 1C)。
2.2 沉默MEX3A对NSCLC增殖的影响
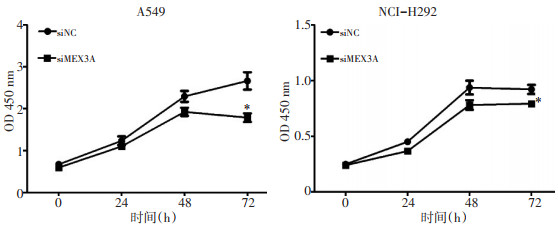
CCK8试验结果显示,与阴性对照组(siNC)相比,沉默MEX3A后,A549和NCI-H292的增殖能力均被显著抑制(P<0.05,图 2)。
2.3 沉默MEX3A对NSCLC侵袭及迁移的影响
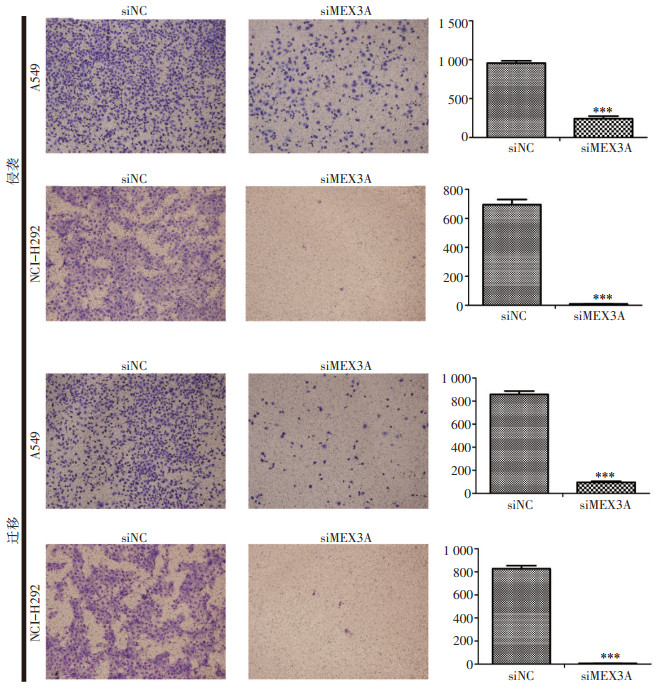
Transwell试验结果显示,与阴性对照组相比,沉默MEX3A后A549和NCI-H292细胞的侵袭(P<0.001)及迁移(P<0.001)能力均明显减弱(图 3)。
2.4 沉默MEX3A对NSCLC凋亡的影响
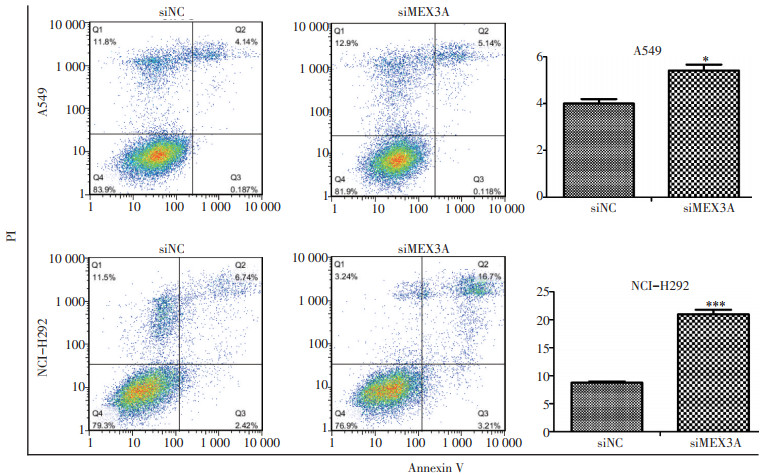
流式细胞试验结果显示,MEX3A被沉默后促进A549(P<0.05)和NCI-H292(P<0.001)的凋亡(图 4)。
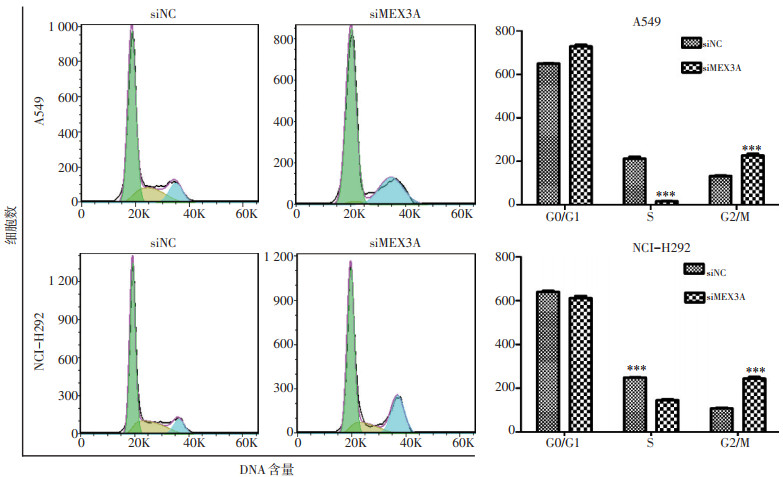
2.5 沉默MEX3A对NSCLC周期的影响
流式细胞试验结果显示,沉默MEX3A后A549及NCI-H292中G2/M期细胞明显增多,细胞周期均被阻滞于G2/M期(P<0.001,图 5)。
3. 讨论
NSCLC的靶向治疗已取得突破性进展[10],但由于诊断和治疗方法有限,导致NSCLC患者的生存和预后仍不理想。遗传因素是引起NSCLC的主要原因,研究表明,超过40% NSCLC是由未知基因异常表达引起的[11]。因此,找到NSCLC的相关生物标志物,并了解其致癌机制,对NSCLC的早期诊断和寻找治疗靶点极为重要。
MEX3是在秀丽隐杆线虫中发现的一类翻译调节蛋白,该蛋白能抑制蛋白翻译过程[12]。MEX3包含MEX3A、MEX3B、MEX3C、MEX3D基因[3],已有研究表明,MEX3蛋白的相关基因异常表达会引起胚胎死亡[12]。其中MEX3A与MEX3B是P小体的组成部分,P小体可浓缩细胞质中的酶,进而参与mRNA的调控过程[13-14]。现已有证据表明MEX3A可通过介导mRNA的代谢过程,参与细胞的生命进程。MEX3A基因的异常表达会引起癌症等多种疾病,有研究发现,MEX3A是肾母细胞瘤潜在的致癌基因[7],但MEX3A在NSCLC中的表达效果及其相关功能却鲜见研究。因此,本文对MEX3A在NSCLC中的表达与功能进行探索。首先,通过转录组芯片分析筛选出在NSCLC中表达上调最显著的MEX3A基因。为探索MEX3A基因在NSCLC中的表达水平,对TCGA数据库中226例肺腺癌样本和20例正常样本进行分析,发现MEX3A mRNA在肺腺癌组织(n=226)中显著高表达(P<0.001),与此同时qRT-PCR的结果也显示MEX3A mRNA在NSCLC细胞系A549和NCI-H292中表达显著升高(P<0.001)。以上结果均表明MEX3A在NSCLC中显著高表达。
已有研究发现,RNA干扰技术沉默MEX3A基因后膀胱癌细胞的增殖能力受到明显抑制,且凋亡效率明显增加[15-16],Shi等[8]也发现MEX3A能促进乳头状膀胱尿路上皮癌细胞的增殖和迁移,但却鲜有MEX3A对NSCLC影响的相关研究。因此,为进一步探索MEX3A在NSCLC中的功能,本研究通过RNA干扰技术沉默A549和NCI-H292的MEX3A基因,结果提示沉默MEX3A后NSCLC的增殖(P<0.05)、侵袭(P<0.001)及迁移(P<0.001)能力均明显减弱,提示MEX3A可能作为NSCLC的异常基因导致NSCLC异常增殖并失去接触抑制,而沉默MEX3A基因能降低上述异常功能。
细胞的增殖和凋亡与细胞周期调控有关,细胞周期调控异常会导致细胞增殖及凋亡异常,进而引发肿瘤。G2/M期是DNA损伤修复的重要时期,G2/M期被阻滞使DNA损伤无法被修复而走向凋亡。研究发现,MEX3A基因在胃癌细胞中高表达,主要在胃癌细胞的G2/M期发挥作用从而促进胃癌细胞的增殖与侵袭,而沉默MEX3A能有效抑制该过程[6],亦有研究表明MEX3A可以影响肠细胞的分化和细胞周期进程[17]。但目前尚缺乏关于MEX3A对NSCLC细胞凋亡和周期的影响的相关报道,本研究发现沉默MEX3A基因后A549和NCIH292细胞被明显阻滞于G2/M期(P<0.001),A549和NCIH292细胞凋亡显著上升(P<0.05)。结果提示沉默MEX3A基因可导致NSCLC被阻滞于G2/M期,并最终诱导NSCLC凋亡。
综上所述,MEX3A可能作为促癌基因参与了NSCLC细胞的生长和增殖过程,而沉默MEX3A能降低该过程。该研究为继续探究MEX3A的相关作用机制奠定了基础,提示MEX3A或许可作为NSCLC诊断和治疗的标志物,为攻克NSCLC提供新的靶点。
-
表 1 引物序列

表 2 新鲜组织样本临床病理资料

表 3 mRNA转录组芯片筛选出在NSCLC中上调的mRNAs

-
[1] Wen C, Dehnel T. China wrestles with lung cancer[J]. Lancet Oncol, 2011, 12(1):15. DOI: 10.1016/S1470-2045(10)70303-X
[2] Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of lung tumors:impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9):1243-1260. DOI: 10.1097/JTO.0000000000000630
[3] Buchet-poyau K, Coerchet J, Le hir H, et al. Identification and characterization of human Mex-3 proteins, a novel family of evolutionarily conserved RNA-binding proteins differentially localized to processing bodies[J]. Nucleic Acids Res, 2007, 35(4):1289-1300. DOI: 10.1093/nar/gkm016
[4] Valverde R, Edwards L, Regan L. Structure and function of KH domains[J]. FEBS J, 2008, 275(11):2712-2726. DOI: 10.1111/j.1742-4658.2008.06411.x
[5] Cano F, Bye H, Duncan LM, et al. The RNA-binding E3 ubiquitin ligase MEX-3C links ubiquitination with MHC-I mRNA degradation[J]. EMBO J, 2012, 31(17):3596-3606. DOI: 10.1038/emboj.2012.218
[6] Jiang H, Zhang X, Luo J, et al. Knockdown of hMex-3A by small RNA interference suppresses cell proliferation and migration in human gastric cancer cells[J]. Mol Med Rep, 2012, 6(3):575-580. http://cn.bing.com/academic/profile?id=c8c0a41133e1453e029ceb4d2f40e5e9&encoded=0&v=paper_preview&mkt=zh-cn
[7] Krepischi ACV, Maschietto M, Ferreira EN, et al. Genomic imbalances pinpoint potential oncogenes and tumor suppressors in Wilms tumors[J]. Mol Cytogenet, 2016, 9:20. DOI: 10.1186/s13039-016-0227-y
[8] Shi JW, Huang Y. Mex3a expression and survival analysis of bladder urothelial carcinoma[J]. Oncotarget, 2017, 8(33):54764-54774. DOI: 10.18632/oncotarget.18399
[9] Yang DJY, Li Y, Fang X. Clinical characteristics and prognostic value of MEX3A mRNA in liver cancer[J]. PeerJ, 2020, 8:e8252. DOI: 10.7717/peerj.8252
[10] 徐嵩, 赵世康, 任凡, 等.非小细胞肺癌新辅助靶向及免疫治疗研究进展和展望[J].中国肿瘤临床, 2020, 47(6):299-303. DOI: 10.3969/j.issn.1000-8179.2020.06.151 [11] Pao W, Girard N. New driver mutations in non-small cell lung cancer[J]. Lancet Oncol, 2011, 12(2):175-180. DOI: 10.1016/S1470-2045(10)70087-5
[12] Draper BW, Mello CC, Bowerman B, et al. MEX-3 is a KH domain protein that regulates blastomere identity in early C. elegans embryos[J]. Cell, 1996, 87(2):205-216. DOI: 10.1016/S0092-8674(00)81339-2
[13] Sheth U, Parker R. Decapping and decay of messenger RNA occur in cytoplasmic processing bodies[J]. Science, 2003, 300(5620):805-808. DOI: 10.1126/science.1082320
[14] Teixeira D, Sheth U, Valencin-Sanchez MA, et al. Processing bodies require RNA for assembly and contain nontranslating mRNAs[J]. RNA, 2005, 11(4):371-382. DOI: 10.1261/rna.7258505
[15] 陈云云, 房超, 于秋爽, 等.MEX3A在人膀胱癌组织细胞中的表达及分析[J].生物医学工程与临床, 2018, 22(1):82-86. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=swyxgcylc201801020 [16] 房超, 尹晶, 于秋爽, 等.RNA干扰MEX3A基因对膀胱癌细胞增殖和凋亡的影响[J].解剖学报, 2017, 48(6):688-692. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=jpxb201706011 [17] Pereira B, Sousa S, Barros R, et al. CDX2 regulation by the RNA-binding protein MEX3A:impact on intestinal differentiation and stemness[J]. Nucleic Acids Res, 2013, 41(7):3986-3999. DOI: 10.1093/nar/gkt087



 下载:
下载: