Analysis of clinicopathological features of seven patients with lung adenocarcinoma translating to small cell lung cancer
-
摘要:目的 分析总结肺腺癌转化为小细胞癌的临床病理特征。方法 回顾性分析2014年1月至2018年12月7例于河北医科大学第四医院确诊为肺腺癌转化为小细胞肺癌(small cell lung cancer,SCLC)患者的临床、病理及随访资料。结果 随访截至2020年6月1日。肺腺癌发生小细胞癌转化的中位时间为31个月,转化前应用酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)的中位时间为14个月。3例患者的转化部位与原发部位相同。7例患者转化前神经元特异性烯醇化酶(neuron-specific enolase,NSE)水平均升高,病情进展部位多为多个部位,肺、骨、脑、胸膜及淋巴结常见。7例患者转化后的免疫组织化学指标显示TTF1均为阳性,而Napsin A均为阴性,Syn、CD56、AE1/AE3均为阳性,Ki67均为高表达,PD-L1均不表达转化后基因检测显示,6例患者仍保持原有EGFR基因突变类型。转化后治疗主要为以化疗为主的综合治疗,中位无进展生存期为6个月,5例患者死亡,中位生存时间为10个月。结论 肺腺癌一旦发生小细胞癌转化,疾病进展迅速,生存期短。肺腺癌EGFR E19突变及接受靶向治疗的患者发生小细胞癌转化的几率较大,首诊至转化的时间多>2年,转化前病情常呈多部位进展且NSE升高,转化后患者仍保持原有EGFR基因突变型。Abstract:Objective To analyze the clinicopathological features of small cell lung cancer transformed from lung adenocarcinoma.Methods We retrospectively analyzed the clinical and pathological characteristics and follow-up data of seven patients who had been diagnosed with small cell lung cancer transformed from lung adenocarcinoma following treatment from January 2014 to December 2018 at the Fourth Hospital of Hebei Medical University.Results The latest follow-up had been performed on June 1, 2020. The median time of small cell lung cancer transformation from lung adenocarcinoma following treatment was 31 months; the median time of tyrosine kinase inhibitor (TKI) application before transformation is 14 months. Three patients had transformation at the same site as the original. Seven patients had higher levels of neuron-specific enolase (NSE) before transformation. Before the transformation, disease progression mostly occurred at multiple sites, and the lung, bone, brain, pleura, and lymph nodes were commonly affected. In all cases, immunohistochemical indicators after transformation showed that thyriod transcription factor-1 (TTF-1) was positive; Napsin A was negative; Syn, CD56, and AE1/AE3 were positive; Ki67 expression was high; and PD-L1 expression was negative. Genetic testing after transformation showed that six patients had maintained the original mutant EGFR gene. Treatments after transformation were mainly comprehensive, based on chemotherapy. The median progression-free survival time after transformation was 6 months, and median survival time after transformation for five patients who died was 10 months.Conclusions Once lung adenocarcinoma undergoes transformation to small cell lung cancer, the disease progresses rapidly, and survival time is short. Patients with lung adenocarcinoma due to EGFR E19 mutation who undergo EGFR-TKI therapy are more prone to small cell lung cancer transformation, and the time to transformation generally exceeds 2 years. The sites of disease progression before transformation are often multiple, and NSE is increased. After transformation, patients generally maintain the original EGFR mutation.
-
Keywords:
- lung cancer /
- adenocarcinoma /
- small cell carcinoma /
- transformation /
- EGFR gene mutation
-
肺癌是中国乃至全球范围内发病率和死亡率最高的恶性肿瘤[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌总数的80%~85%,其中腺癌占多数。随着分子靶向药物的快速发展,表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI)在晚期NSCLC靶向治疗方面取得了重大突破,但多数患者不可避免地在10~12个月时出现获得性耐药[2]。目前已知的耐药机制中最常见的是T790M突变,约占60%,其它耐药原因包括cMet基因扩增、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)基因扩增、小细胞肺癌(small cell lung cancer,SCLC)转化等[3],其中SCLC转化为临床诊疗带来了不少困惑,尽管其发生率较低但却不容忽视。目前,肺腺癌转化为SCLC多为个案报道,对发生的个案进行汇总归纳并分析的回顾性研究较少,本研究旨在总结分析肺腺癌转化为SCLC的临床病理特征,为临床实践提供依据。
1. 材料与方法
1.1 病例资料
收集河北医科大学第四医院2014年1月至2018年12月确诊为肺腺癌转化为SCLC的病例7例,其中男性6例,女性1例,平均年龄56(30~68)岁。初诊时7例患者病理诊断均为腺癌,仅1例行免疫组织化学检查,提示为腺癌。转化前2例行左肺下叶切除术的患者行术后病理检查,其余5例均行肺肿物穿刺活检。转化后病理检查的组织来源均为穿刺活检,7例的患者行免疫组织化学检查,病理诊断均为SCLC。初诊为腺癌时7例患者神经元特异性烯醇化酶(neuron- specific enolase,NSE)值分别为12.03、23.42、15.26、10.51、14.29、11.83、12.62 μg/L,1例NSE轻度升高(表 1)。
表 1 7例肺腺癌转化SCLC患者基本临床特征
1.2 方法
1.2.1 病理检查
病理诊断采用常规病理组织学切片,使用Vantana全自动免疫组织化学染色仪器进行染色。PD-L1免疫组织化学应用Dako 22C3 pharmDx和VENTANA SP263检测仪器,获得阳性细胞比例。
1.2.2 治疗方法
7例患者转化前的治疗方法详见表 2。
表 2 7例肺腺癌转化SCLC患者转化前的治疗方法
1.2.3 随访
对纳入分析的病例进行随访,采用电话随访、门诊记录随访的方式了解疾病转归以及预后情况。随访截至日期为2020年6月1日。
1.3 统计学分析
采用SPSS 22.0软件进行统计分析,描述性统计包括平均值、中位数及范围。
2. 结果
2.1 SCLC转化前后患者的临床特征
6例初诊即存在表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的患者发生SCLC转化前应用酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的中位时间为15.5(13~20)个月。3例患者转化部位与原发部位相同(42.9%),4例不同于原发部位(57.1%);7例患者转化前NSE水平均升高(100%),平均升高3.6(1.1~8.2)倍;诊断转化前病情进展部位涉及多个部位,肺、骨、脑、胸膜及淋巴结常见。转化前3例患者发生了EGFR T790M突变(42.9%),转化后6例患者均保持原有EGFR基因突变型(85.7%),1例初诊时基因检测未发生突变的患者在转化后发生EGFR E19突变(14.3%),见表 2。
2.2 转化后病理检测
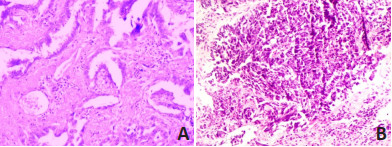
7例患者发生SCLC转化后的免疫组织化学检查显示,TTF1均为阳性,Napsin A均为阴性,Syn、CD56、AE1/AE3均为阳性,Ki67均为高表达,PD-L1均不表达(表 3,图 1)。
表 3 7例肺腺癌发生SCLC转化后的免疫组织化学指标
2.3 SCLC转化时间、转化后的治疗和预后
7例患者发生SCLC转化的时间为13~40个月,中位时间为31个月。转化后治疗主要为以化疗为主的综合治疗。随访截至2020年6月1日,随访率100%,2例患者生存,5例患者死亡。转化后的无进展生存期为1~12个月,中位无进展生存期为6个月;5例死亡患者的转化后生存时间为6~13个月,中位生存时间为10个月(表 4)。
表 4 7例肺腺癌转化SCLC患者的转化时间、转化后治疗和预后
2.4 死亡原因
7例患者中5例患者死亡,其中2例死于脑转移,2例死于肝转移,1例因肺内多发转移导致呼吸衰竭死亡。
3. 讨论
EGFR基因敏感突变的晚期NSCLC患者在接受EGFR-TKI一线治疗后,多数在10~12个月后出现疾病进展,即出现获得性耐药[2],此类患者中4%~14%病例的耐药机制是转化为SCLC[4]。目前,关于肺腺癌转化为SCLC的定义尚无统一意见,也缺乏明确的临床病理判定标准。关于SCLC转化所致耐药的机制也尚不明确,考虑可能机制如下:1)肿瘤最初即存在两种混合成分(同一部位或不同组织器官的SCLC和腺癌共存),最初诊断时腺癌可能是优势主导成分,经治疗后SCLC逐渐占据主导成分;2)EGFR-TKI治疗诱发腺癌向SCLC转化。Sequist等[4]对靶向治疗后耐药的EGFR基因突变型肺腺癌患者行二次活检,发现病理组织转化为SCLC,且转化后的SCLC组织仍保持原有EGFR基因突变型,提示其可能来源于同一组织。Shi等[5]研究显示转化型肿瘤(腺癌转化为SCLC)在转化前后常具有相同的EGFR突变,提示TKI治疗后的SCLC起源于腺癌。本研究结果与上述两项研究基本一致,7例患者有6例转化后仍保持原有EGFR基因突变型,1例转化后发生了EGFR E19突变,此例患者最初采用血液基因检测,而转化后应用组织基因检测,不除外检测差异因素。
本研究中7例肺腺癌转化为SCLC诊断明确,EGFR E19突变及靶向治疗后更易发生SCLC转化,发生转化的时间多>2年。转化前多为多部位病情进展且NSE均升高,转化后保持原有EGFR基因突变型。肺腺癌患者一旦发生SCLC转化,疾病进展迅速,生存期短,预后较差。Marcoux等[6]回顾性分析67例EGFR突变的SCLC或高级别神经内分泌癌,初诊时其中58例患者为NSCLC,9例患者为SCLC或含SCLC成分的混合型病理类型。58例初诊为NSCLC患者经TKI治疗后97%转化为经典型SCLC,2例转化为大细胞神经内分泌癌。NSCLC患者突变类型主要为EGFR E19(69%)和L858R(25%),SCLC转化前58例NSCLC患者中93%接受了TKI治疗且均经历了2线及以上的治疗过程,转化后采用铂类联合依托泊甙或单药紫杉类治疗,可以达到50%以上的临床反应率,但中位无进展生存期仅为3.4(2.4~5.4)个月,中位生存期仅为10.9(8.0~13.7)个月,转化后常见中枢神经系统(central nervous system,CNS)转移。Ahmed等[7]研究结果显示,30例肺腺癌患者转化前均经历多线治疗,发生SCLC转化的中位时间为36个月。Roca等[8]报道了39例EGFR突变肺腺癌患者转化为SCLC后的中位生存期为6个月。Ferrer等[9]报道提示EGFR突变型NSCLC患者经过多线治疗后发生SCLC转化的概率更高,多数患者仍保留原有的基因突变类型。本研究和上述4项研究结果类似,提示临床上经EGFR-TKI治疗后耐药或多线治疗后病情持续进展的肺腺癌患者需积极进行病灶的二次活检和基因检测,发生转化后治疗方案多选择针对SCLC的治疗方案。同时,本研究观察到NSE指标的升高,提示可以考虑NSE作为一项检测指标,若患者NSE增高伴有短期多部位进展应关注SCLC转化的可能性。
本研究7例患者SCLC转化后的免疫组织化学检测显示Syn、CD56、AE1/AE3均为阳性,Ki67均为高表达,符合SCLC特征,提示恶性程度高,预后差。另外,7例的PD-L1均不表达,其中有1例患者应用免疫治疗无效,Marcoux等[6]的研究中17例患者应用免疫检查点抑制剂治疗亦均无效,表明肺腺癌发生SCLC转化后的免疫治疗尚待研究,筛选适合接受免疫治疗的特定人群尚需进一步探索。随着活检技术的提高、基因检测技术的成熟,肺腺癌治疗后发生SCLC转化的病例会越来越多地被发现及研究,本研究发现并分析了肺腺癌治疗后发生SCLC转化的常见临床病理特征,对指导临床实践有重大意义。但本研究也存在一定的局限性,如为回顾性研究、病例数少、初诊时患者未行全基因组测序、发生SCLC转化时未行多部位活检等。综上所述,在临床诊疗中提高二次活检意识,根据病情动态进行基因检测,可以更早地发现SCLC转化患者并制定精准治疗方案。
-
表 1 7例肺腺癌转化SCLC患者基本临床特征

表 2 7例肺腺癌转化SCLC患者转化前的治疗方法

表 3 7例肺腺癌发生SCLC转化后的免疫组织化学指标

表 4 7例肺腺癌转化SCLC患者的转化时间、转化后治疗和预后

-
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics2018: GLOBOCAN estimates of incidence and mortality worldwidefor 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. DOI: 10.3322/caac.21492
[2] Engelman JA, Janne PA. Mechanisms of acquiredresistance to epidermal growth factor receptor tyrosine kinaseinhibitors in nonsmall cell lung cancer[J]. Clin Cancer Res, 2008, 14(10):2895-2899. DOI: 10.1158/1078-0432.CCR-07-2248
[3] Lim SM, SynNL, Cho BC, et al. Acquired resistanceto EGFR targeted therapy in non-small cell lung cancer:mechanisms and therapeutic strategies[J]. Cancer Treat Rev, 2018, 65:1-10. DOI: 10.1016/j.ctrv.2018.02.006
[4] Sequist LV, Waltman BA, Dias-Santagata D, et al. Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors[J]. Sci Transl Med, 2011, 3(75):26-75. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=e7e96e7b5700809c2551366b832fde36
[5] Shi X, Duan H, Liu X, et al. Genetic alterations andprotein expression in combined small cell lung cancers and small cell lungcancers arising from lung adenocarcinomas after therapy with tyrosine kinaseinhibitors[J]. Oncotarget, 2016, 7(23):34240-34249. DOI: 10.18632/oncotarget.9083
[6] Marcoux N, Gettinger SN, O'Kane G, et al. EGFR-mutant adenocarcinomasthat transform to small-cell lung cancer and other neuroendocrinecarcinomas: clinical outcomes[J]. J Clin Oncol, 2019, 37(4): 278-285. DOI: 10.1200/JCO.18.01585
[7] Ahmed T, Vial MR, Ost D, et al. Non-small cell lung cancer transdifferentiation into small cell lung cancer: A case series[J]. Lung Cancer, 2018, 122:220-223. DOI: 10.1016/j.lungcan.2018.06.024
[8] Roca E, Gurizzan C, Amoroso V, et al. Outcome of patients with lung adenocarcinoma with transformation to small-cell lung cancer following tyrosine kinase inhibitors treatment:A systematic review and pooled analysis[J]. Cancer Treat Rev, 2017, 59:117-122. DOI: 10.1016/j.ctrv.2017.07.007
[9] Ferrer L, GiajLevra M, Brevet M, et al. A brief report of transformation from NSCLC to SCLC: Molecular and therapeutic characteristics [J]. J Thorac Oncol, 2019, 14(1):130-134. DOI: 10.1016/j.jtho.2018.08.2028
-
期刊类型引用(3)
1. 张月馨,周聪,谭义炫,王微. 胸腔积液沉渣包埋组织TTF-1、Galectin-3的表达水平与肺腺癌恶性生物学行为间的关系. 国际检验医学杂志. 2024(09): 1031-1036+1043 .  百度学术
百度学术
2. 任桂灵,吴小山,陈延杰,管文婕,宋晓坤,朱捷. 1例多线TKI耐药的晚期肺癌转化为SCLC治疗策略分析及文献复习. 海峡药学. 2024(06): 63-67 .  百度学术
百度学术
3. 余雯文,叶华,陈阿丽,李继法. 晚期肺腺癌转化为小细胞肺癌1例并文献复习. 浙江医学. 2022(04): 422-423+431 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: